Ангиопатия при сахарном диабете патогенез
… судьбу и прогноз, трудоспособность и качество жизни больного сахарным диабетом определяют сердечно-сосудистые нарушения.
Диабетическая ангиопатия – генерализованное поражение крупных (макроангиопатия) и мелких (прежде всего капилляров – микроангиопатия) кровеносных сосудов при сахарном диабете; проявляется повреждением стенок сосудов в сочетании с нарушением гемостаза
Патогенез диабетической ангиопатии. В патогенезе диабетической ангиопатии имеют значение следующие патогенные факторы: (1) снижение секреции эндотелиального релаксирующего фактора и других факторов, регулирующих тонус сосудов; (2) усиленный синтез глюкозаминогликанов и неферментативное гликозилирование белков, липидов и других компонентов сосудистой стенки и, как следствие, нарушение проницаемости и прочности стенки сосуда, развитие в ней иммунопатологических реакций, сужение просвета сосудов, уменьшение площади внутренней поверхности сосудов; (3) активация полиольного пути превращения глюкозы вызывает накопление сорбитола и фруктозы в стенках сосудов с изменением осмотическое равновесия в них с последующим развитием отека, сужением просвета микрососудов и углублением в них дистрофических процессов; (4) нарушение жирового обмена способствует активизации перекисного окисления липидов, который сопровождается спазмом сосудов; повреждающее действие на эндотелий сосудов оказывает повышение в крови концентрации липопротеинов низкой и очень низкой плотности; (5) нарушение азотистого обмена с развитием диабетической диспротеинемии (повышение в сыворотке крови относительного содержания a2-глобулинов, гаптоглобинов, С-реактивного белка и фибриногена) на фоне нарушенной проницаемости сосудов, создает условия для инфильтрации субэндотелиального пространства грубодисперсными белками; (6) абсолютный избыток соматотропного гормона, кортизола и катехоламинов обладает прямым сосудоповреждающим действием, активизирует полиольный путь утилизации глюкозы, вызывает стойкий сосудистый спазм и др.
Патогенез нарушения гемостаза при сахарном диабете. В крови повышается концентрация вазоактивных и тромбогенных производных арахидоновой кислоты (простагландинов и тромбоксанов), одновременно снижается содержание веществ, обладающих антиагрегационным и антитромбогенным действием. Развивающаяся при сахарном диабете гиперкатехоламинемия сопровождается стимуляцией агрегации тромбоцитов, синтеза тромбина, фибриногена и других коагулогенных метаболитов. Гипергликемия и диспротеинемия повышают агрегационную способность тромбоцитов и эритроцитов. В результате полиольного отека эритроциты утрачивают способность проходить через капилляры, просвет которых меньше диаметра эритроцитов. Торможение секреции эндотелиального релаксирующего фактора ведет снижению дезагрегантной и нарастанию тромбогенной активности тромбоцитов.
Диабетическая микроангиопатия. Для микроангиопатии характерна триада факторов Сенако-Вирхова: изменения в сосудистой стенке, нарушения системы свертывания крови и замедление кровотока, которые создают условия для микротромбирования. Эти изменения по мере заболевания обнаруживаются на протяжении всего сосудистого русла, оказывая основное влияние на почки, сетчатку глаза, периферические нервы, миокард и кожу приводит к развитию диабетической нефропатии, ретинопатии, нейропатии, кардиопатии, дерматопатии. Наиболее ранними проявлениями диабетических ангиопатий являются сосудистые изменения в нижних конечностях, частота которых колеблется от 30 до 90%.
Ряд авторов считают, что микроангиопатия не является осложнением, а входит в клинический синдром сахарного диабета. При этом основной или начальной формой проявления заболевания некоторые авторы считают нейропатию, которая в свою очередь приводит к развитию ангиопатии. В то же время W.Kane (1990) считает, что нейропатия при диабете является следствием ишемии нерва, то есть результатом поражения vasa nervorum. По его мнению, поражение мелких сосудов (капилляров, vasa vasorum, vasa nervorum) является характерным и патогномичным для диабета. Поражение автономных нервов в свою очередь приводит к нарушению функции сосудов. Параллельно развиваются дегенеративные изменения в периферических нервах, вследствие чего может наступить полное выпадение болевой чувствительности на стопе и голени.
Классификация диабетической микроангиопатии (W.Wagner, 1979): Степень (ишемического поражения нижних конечностей) 0 – без визуальных изменений кожных покровов; степень 1 – поверхностные изъязвления, не распространяющиеся на всю дерму, без признаков воспаления; степень 2 – более глубокие изъязвления, захватывающие прилегающие сухожилия или костную ткань; степень 3 – язвенно-некротический процесс, сопровождается присоединением инфекции с развитием отека, гиперемии, возникновением абсцессов, флегмоны, контактного остеомиелита; степень 4 – гангрена одного пальца и более или гангрена дистального отдела стопы; степень 5 – гангрена большей части стопы или всей стопы.
Диабетическая макроангиопатия. Макроангиопатия – основная причина смерти больных сахарным диабетом. Риск развития этих осложнений у таких пациентов в 2-3 раза превышает таковой в общей популяции. Морфологически диабетическая макроангиопатия представляет собой следствие ускоренного атеросклероза, который при сахарном диабете имеет ряд особенностей: мультисегментарность поражения артерий, более бурное (прогрессирующее) течение, возникновение в молодом возрасте (как у мужчин, так и у женщин), слабый ответ на лечение антитромботическими препаратами, и др. Поражаются в первую очередь коронарные и церебральные артерии, артерии нижних конечностей. Клинические проявления такого атеросклероза (ИБС, цереброваскулярная болезнь и др.) с одной стороны, не являются специфическими осложнениями сахарного диабета, но с другой стороны часто рассматриваются как проявления диабетической макроангиопатии в силу специфики атеросклеротического процесса при сахарном диабете. Помимо атеросклероза, в крупных артериях обнаруживают кальциноз средней оболочки артерий (склероз Менкеберга) и диффузный артериофиброз. Указанные изменения не являются специфическими только для диабета, кроме оссификации бедренной и большеберцовой артерий, которая встречается исключительно у больных сахарным диабетом.
Классификация диабетической макроангиопатии. Стадия 1 компенсации периферического кровообращения: скованность движений по утрам, утомляемость, чувство онемения и «зябкость» в пальцах и стопах, потливость стоп; перемежающаяся хромота через 500-1000 м. Стадия 2а субкомпенсации: острая восприимчивость к холоду, «зябкость» и онемение стоп, изменение ногтевых пластинок (гиперкератоз), бледность кожных покровов, выпадение волос на голенях; потливость, перемежающаяся хромота через 200-500 м. Стадия 2б субкомпенсации: перемежающаяся хромота через 50–200 м; регионарное систолическое давление (РСД) – 75 мм рт. ст.; лодыжечно-плечевой индекс (ЛПИ) 0,65; дефицит регионарного систолперфузионного давления (ДРСПД) 60–65%. Стадия 3а декомпенсации без трофических нарушений: РСД – 41 мм рт. ст., ЛПИ 0,32; ДРСПД – 80–90%; боли в покое, особенно ночью, судороги в икроножных мышцах; парастезии в виде чувства жжения, отчетливый акроцианоз при опускании конечности и восковидная бледность в горизонтальном положении; кожа источена, сухость, шелушение, выражен симптом борозды; отмечена плантарная ишемия; хромота – до 50 м. Стадия 3б декомпенсации с трофическими нарушениями: постоянные боли в конечности; гипостатический отек стоп и голени, тугоподвижность суставов стопы, признаки хронической интоксикации, появляются отдельные некротические язвы на пальцах и стопах трещины пяточной области и подошвы. Стадия 4 гангрены: необратимые большие некротические участки ткани на стопе и голени, гангрена пальцев и стопы, выраженная интоксикация, РСД 29–31 мм рт. ст.; ЛПИ<0,30; ДРСПД 84–95%.
У больных сахарным диабетом микро- и макроангиопатии часто сочетаются с изменениями соматической и вегетативной нервной систем, и тогда уже на ранних функциональных стадиях, которые обусловлены нарушениями нейрогормональной регуляции сосудистого тонуса, появляются жалобы на вазомоторные изменения разной степени выраженности (вазоконстрикция или вазодилатация). Присоединение к вазомоторным нарушениям медиокальциноза или атеросклероза способствует нарушению эластичности сосудистой стенки, снижает способность сосудов к вазодилатации при физической нагрузке, что постепенно приводит к недостаточности кровообращения. Вазоконстрикция артерий, артериол, нарушения структуры и функции капилляров приводят к повышению общего периферического сопротивления и наряду с нейрогормональными факторами ведут к формированию гипертензии. Кроме того, нагрузка давлением на гипертрофированный левый желудочек вызывает рано или поздно недостаточность кровообращения. Изменение функции вегетативной нервной системы в результате нейропатии служит у больных сахарным диабетом причиной появления серьезных клинических симптомов и синдромов; это – ортостатическая гипотония, тахикардия покоя, безболевой инфаркт миокарда, бессимптомная гипогликемия, нарушение регуляции температуры тела и другие.
Диагностика. Диагностика диабетической ангиопатии проводится в двух направлениях: (1) методы исследования, направленные на оценку общего состояния больного; (2) методы исследования, оценивающие степень поражения сосудистого русла конечности и определяющие возможность выполнения реконструктивной сосудистой операции для сохранения конечности (вместо ампутации).
(1) Методы исследования, направленные на оценку общего состояния больного: оценка тяжести сахарного диабета, а также характера патологических изменений сердца и почек. Амбулаторные исследования: биохимический анализ крови (уровень глюкозы крови; суточный профиль глюкоземии; уровень мочевины, креатинина); электрокардиографию (ЭКГ); рентгенографию пораженной стопы в 2 проекциях; посев из гнойной раны стопы для определения микрофлоры и ее чувствительности к антибактериальным препаратам; измерение артериального давления (АД) на берцовых артериях с определением лодыжечно-плечевого индекса давления (ЛПИ), который равен отношению систолического давления на берцовых артериях к таковому на плечевой артерии. В специализированном стационаре выполняют: биохимический анализ крови (помимо перечисленных выше показателей, определяют протромбиновое время, уровень фибриногена, тромбоцитов крови, электролитов); ЭКГ с нагрузочными тестами; чреспищеводную электростимуляцию сердца (ЧПЭС), направленную на выявление скрытой коронарной недостаточности и определение резерва коронарного кровоснабжения; дуплексное сканирование бифуркаций общих сонных артерий (часто сочетанное поражение при отсутствии клинических проявлений); рентгенографию грудной клетки; рентгенографию пораженной стопы в 2 проекциях; посев из раны стопы для определения микрофлоры и ее чувствительности к антибактериальным препаратам.
(2) Методы исследования, оценивающие степень поражения сосудистого русла конечности и определяющие возможность выполнения реконструктивной сосудистой операции для сохранения конечности (вместо ампутации). Макрогемодинамику изучают с помощью измерения пальцевого АД на стопе; измерения сегментарного АД на стандартных уровнях нижних конечностей с определением ЛПИ (при отсутствии сосудистой патологии индекс равен единице, при облитерации — ниже 0,7, при критической ишемии его величина – 0,5 и ниже, что требует необходимости проведения ангиографии с целью определения участка окклюзии и решения вопроса о необходимости ангиопластики или люминальной ангиопластики); спектрального анализа допплеровского сигнала с магистральных артерий на всем протяжении пораженной конечности, включая стопу; рентгеноконтрастной ангиографии с обязательным контрастированием диcтального артериального русла нижних конечностей (выполняется при планировании реконструктивного сосудистого вмешательства, чаще при синдроме ишемической диабетической стопы).
Для оценки изменений микрогемодинамики нижней конечности используют следующие методы: определение транскутанного напряжения кислорода на стопе в первом межпальцевом промежутке в положении больного сидя и лежа; лазерную допплеровскую флоуметрию; компьютерную видеокапилляроскопию. (!) Все исследования необходимо проводить на фоне консервативной терапии.
Принципы лечения диабетической ангиопатии: (1) нормализация метаболических нарушений (прежде всего, углеводного обмена, так как гипергликемия может играть одну из основных ролей в атерогенезе); (2) контроль показателей липидного обмена, особенно уровней триглицеридов и ЛПНП (липопротеидов низкой плотности), и при их повышении назначение гиполипидемических средств (статины, фибраты, антиоксиданты); (3) назначение препарата метаболического действия (триметазидина), который активирует окисление глюкозы в миокарде путем ингибирования окисления свободных жирных кислот; (4) использование антитромбоцитарных средств (ацетилсалициловая кислота, дипиридамол, Тиклид, гепарин, Вазапростан); (5) контроль артериального давления и достижение целевых уровней АД (130/85 мм рт. ст.) для предупреждения прогрессирования нефро- и ретинопатий, снижения смертности от инсульта и инфаркта миокарда (ингибиторы ангиотензинпревращающего фермента, антагонисты кальциевых каналов); (6) нормализация вегетативного гомеостаза, которая достигается путем ингибирования альдозоредуктазы, повышения активности сорбитол-дегидрогеназы, усиления антиоксидантной защиты (перспективно в указанном плане использование препаратов a-липоевой кислоты).
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 5 июня 2015; проверки требуют 4 правки.
Диабетическая ангиопатия (новолат. angiopathia diabetica; др.-греч. ἀγγεῖον — сосуд и πάθος — страдание, болезнь) — генерализованное поражение крупных (макроангиопатия) и мелких (прежде всего капилляров — микроангиопатия) кровеносных сосудов при сахарном диабете. Проявляется повреждением стенок сосудов в сочетании с нарушением гемостаза.[1]
Возникновение диабетической ангиопатии[править | править код]
Главным фактором, который способствует возникновению диабетической ангиопатии, является плохое лечение сахарного диабета, при котором происходят выраженные нарушения не только углеводного обмена с высоким уровнем глюкозы в крови и значительными (более 6 ммоль/л) перепадами его в течение суток, но также и белкового и жирового. В таких случаях ухудшается кислородное обеспечение тканей, в том числе стенок сосудов, и нарушается кровоток в мелких сосудах.
Также имеют значение и возникающие нарушения гормонального баланса, увеличение секреции ряда гормонов, которые усугубляют нарушения обменных процессов и неблагоприятно влияют на сосудистую стенку.[2]
Диабетическая макроангиопатия[править | править код]
Органами-мишенями при диабетической макроангиопатии являются, главным образом, сердце и нижние конечности. Фактически макроангиопатия заключается в ускоренном прогрессировании атеросклеротических процессов в сосудах сердца и нижних конечностей.[1]
Диабетическая микроангиопатия[править | править код]
- Диабетическая нефропатия
- Диабетическая ретинопатия
- Микроангиопатия сосудов нижних конечностей
В процесс диабетической микроангиопатии наиболее часто вовлекаются сосуды сетчатки глаза (диабетическая ангиоретинопатия) и кровеносные капилляры клубочков нефронов (диабетическая ангионефропатия). Таким образом, основными органами-мишенями диабетической микроангиопатии являются глаза и почки[1].
Примечания[править | править код]
Источник
Статья посвящена механизмам развития и подходам к терапии диабетической микроангиопатии. Обсуждаются терапевтические подходы к лечению микроангиопатий, возможности применения добезилата кальция.
Сахарный диабет (СД) является глобальной медико-социальной проблемой современности в силу катастрофического роста численности больных во всем мире и тяжелых последствий заболевания для пациента. По данным Международной федерации диабета (IDF), на 2017 г. в мире насчитывалось 425 млн больных СД, а к 2040 г. прогнозируемое число больных составит 642 млн [1]. При недостаточно эффективном лечении СД может значительно ограничивать жизнь пациентов, приводить к ранней инвалидизации и преждевременной смерти из-за развития сосудистых осложнений. Хроническая гипергликемия сочетается с повреждением различных органов, особенно сердечно-сосудистой, нервной системы, почек и органа зрения [2, 3].
Хронические (сосудистые) осложнения СД разделяют на микроангиопатии и макроангиопатии. К первым относятся диабетическая нефропатия (ДН) (специфическое поражение сосудов почек) и ретинопатия (поражение сосудов глаз). Макроангиопатии (ИБС, цереброваскулярные нарушения, облитерирующие поражения периферических сосудов) обусловлены атеросклерозом, который у больных СД начинается раньше и протекает тяжелее [4]. По вине СД каждые 90 мин развивается новый случай слепоты, 60 мин — ДН, требующая гемодиализа, 19 мин — ампутация нижней конечности, 12 мин — новый случай инсульта, 19 мин — один сердечный приступ [5].
Патогенетические механизмы развития осложнений СД
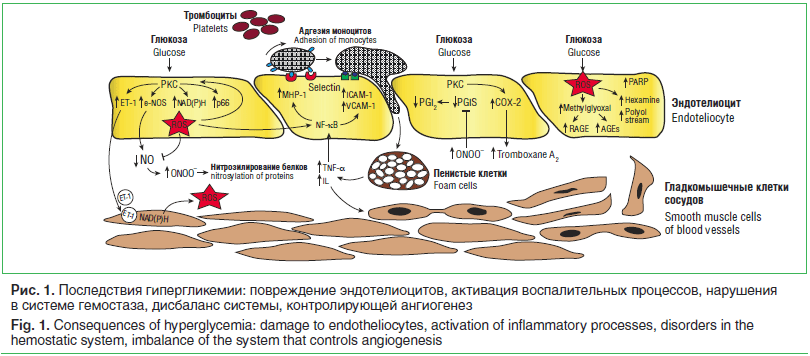
Длительная и стойкая гипергликемия — ведущий фактор развития сосудистых осложнений СД, который приводит к активации многоступенчатого каскада метаболических нарушений (рис. 1), общей конечной точкой которых являются ухудшение кровотока, гипоксия, клеточная энергетическая недостаточность, эндотелиальная дисфунк-ция [3, 6, 7]. Молекулярные механизмы развития микроангиопатий разнообразны и находятся в стадии детального изучения. Предложено несколько объяснений патологических механизмов поражения микрососудистого русла при СД. Неферментативное гликозилирование белков обусловлено способностью глюкозы образовывать с аминокислотными остатками различных белков соединения, участвующие в обмене. Последние являются исходным материалом для образования в химических реакциях веществ, которые получили название конечных продуктов гликозилирования (КПГ). Их период полураспада более длительный, чем белков (от нескольких месяцев до нескольких лет). По мере нарастания гликемии процесс гликозилирования сдвигается в сторону образования необратимых КПГ, которые накапливаются в различных тканях и сохраняются в них даже при достижении и поддержании нормогликемии. Внутриклеточная продукция КПГ, изменяя транскрипцию генов, структуру белков внеклеточного матрикса и циркулирующих белков крови, приводит к нарушению функции многих клеток, сосудистым повреждениям, повышению проницаемости базальной мембраны сосудов [4, 7]. При воздействии на КПГ-рецепторы моноцитов и макрофагов происходит активация последних, что запускает продукцию различных провоспалительных цитокинов (интерлейкина-1 (IL-1), фактора некроза опухолей-альфа (TNF-a) и факторов роста (тромбоцитарного фактора роста, трансформирующего фактора роста-бета (TGF-β)).
Хроническая гипергликемия сопровождается внутриклеточным накоплением глюкозы (в т. ч. в нейронах, эндотелии сосудов) и активацией патологических путей метаболизма глюкозы на фоне недостаточной эффективности утилизации глюкозы в пентозофосфатном пути [2, 7]. Избыток глюкозы неизбежно используется по полиоловому пути (путь ее утилизации в инсулиннезависимых тканях) с образованием сорбитола, внутриклеточное накопление которого приводит к увеличению осмолярности межклеточного пространства, отеку ткани. Накопление фруктозо-
6-фосфата стимулирует гексозаминовый путь; повышение уровня дигидроксиацетонфосфата (DGAP) приводит к продукции глицеральдегид-3-фосфата, глицерин-3-фосфата и других метаболитов, активирующих путь протеинкиназы С (РКС) [8]. Эти соединения являются предшественниками метилглиоксаля — основного вещества, приводящего к образованию КПГ.
Последствием активации РКС становится активация ядерного фактора κb (NF-κb), что приводит к снижению продукции NO, повышению уровней эндотелина-1 (ET-1), TGF-β и ингибитора активатора плазминогена-1, нарушению кровотока и возникновению окклюзии капилляров [2, 8]. Активация РКС на фоне гипергликемии способствует увеличению сосудистой проницаемости, усилению неоваскуляризации, нарушению целостности гематоретинального барьера и активации процессов перекисного окисления липидов.
Оксидативный стресс (ОС) также является важным механизмом формирования диабетических сосудистых осложнений. Гипергликемия сопровождается повышением скорости аутоокисления глюкозы с последующим увеличением свободных радикалов и развитием ОС. К метаболическому стрессу также приводит повышенное образование реактивных оксидантов, образующихся в результате аутоокисления жирных кислот в триглицеридах, фосфолипидах и эфирах холестерина [3, 8]. При этом хроническая гипергликемия снижает активность факторов антиоксидантной системы (каталазы, супероксиддисмутазы, глутатионпероксидазы). ОС и, как следствие, интенсивное перекисное окисление липидов, оказывают цитотоксическое действие, что проявляется повреждением мембран эритроцитов, лизосом; нарушается структура мембран клеток, вплоть до их разрыва; ингибируется активность цитохромоксидазы. Повреждающее действие ОС заключается также в нарушении реологических свойств крови с развитием гемостаза и тромбоза [7, 8].
Рассматривая механизмы сосудистых осложнений, нельзя не отметить состояние эндотелия у больных СД. Нормально функционирующий эндотелий отличает непрерывная базальная выработка оксида азота (NO). Биологические эффекты NO включают торможение пролиферации и миграции гладкомышечных клеток сосудов (ГМК), синтез ими коллагена, уменьшение адгезии лейкоцитов к эндотелию сосудов, торможение трансэндотелиальной миграции моноцитов, агрегации и адгезии тромбоцитов, а также антиоксидантное действие [9]. Дисбаланс между факторами, обеспечивающими нормальное функционирование эндотелия, представляет дисфункцию эндотелия, которая характерна для больных СД. Гипергликемия ингибирует продукцию NO эндотелиальными и ГМК сосудов, блокируя работу NO-синтазы и активируя генерацию активных форм кислорода. Кроме того, гипергликемия сопровождается нарушениями функционирования системы гемостаза и дисбалансом регуляторной системы, контролирующей ангиогенез (рис. 1). 
Микрососудистые осложнения сахарного диабета
Диабетические микроангиопатии имеют специфическую клинико-морфологическую картину и развиваются только при СД. Наибольшего внимания среди сосудистых осложнений заслуживают диабетическая нефропатия и ретинопатия (ДР) [4]. При небольшой длительности СД 2-го типа уже 35% больных имеют непролиферативную ДР, 14% — препролиферативную, 28% — ДН на стадии микроальбуминурии, 55% — клинические стадии диабетической нейропатии [10]. При длительности заболевания более 10 лет 60% больных имеют ДР, 48% — ДН [11].
Диабетическая нефропатия
Хорошо известно, что ДН — это одно из наиболее серьезных, инвалидизирующих последствий СД 2, поскольку ведет к прогрессирующей почечной дисфункции, хронической почечной недостаточности и смерти больного [4, 12]. ДН стоит на втором месте среди причин смерти, связанных с СД 2, после сердечно-сосудистых заболеваний. Частота развития ДН колеблется в пределах 40–50% у больных СД 1 и 15–30% у больных СД 2 [13]. Клиническими исследованиями доказана устойчивая взаимосвязь между возрастом дебюта, длительностью СД и риском развития и прогрессирования ДН [14–16].
В настоящее время широко используется наднозологическое понятие хронической болезни почек (ХБП), объединяющее всех пациентов с сохраняющимися в течение 3-х и более месяцев признаками повреждения почек и/или снижением их функции, вне зависимости от первичного диагноза [17]. Для первичной диагностики патологии почек, контроля эффективности и безопасности терапии, скорости прогрессирования патологического процесса и определения прогноза важна оценка стадии почечных
нарушений по величине скорости клубочковой фильтрации (СКФ) как наиболее полно отражающей количество и суммарный объем работы нефронов и с учетом уровня альбуминурии [18–21]. Особая опасность ХБП состоит в том, что она может длительное время не вызывать никаких жалоб и изменения самочувствия, которые побудили бы больного обратиться к специалисту. Выявление ДН на ранней стадии позволяет существенно — на 10–15 лет увеличить додиализный период, наступающий при хронической почечной недостаточности [22].
Диабетическая ретинопатия
Уязвимым при гипергликемии является и орган зрения, наиболее опасным поражением которого является ДР. У лиц трудоспособного возраста среди населения развитых стран мира ДР — одна из основных причин снижения остроты зрения и слепоты, которая у больных СД наступает в 25 раз чаще, чем в общей популяции [10, 23]. Ретинальные сосудистые осложнения проявляются как у больных с СД 2, так и при СД 1, при котором относительный риск развития ДР вдвое выше, чем при СД 2 [24]. С увеличением продолжительности СД повышается вероятность сосудистых изменений в сетчатке. Показательно, что увеличение уровня HbA1c всего на 1% вдвое увеличивает риск развития ДР [23].
ДР имеет несколько стадий развития. Начальные изменения (непролиферативная ретинопатия) связаны с кровоизлияниями в ткань сетчатки, а также с просачиванием через измененную сосудистую стенку компонентов крови. Если патологическое просачивание появляется в центральных отделах глазного дна (в макулярной зоне), то сетчатка в этой области теряет свою прозрачность, что может приводить к значительному снижению зрения у таких больных — развивается диабетический макулярный отек. Развитию диабетической макулопатии способствуют два процесса: микроокклюзия капилляров (наиболее раннее проявление) и гиперпроницаемость капилляров, связанная с прорывом внутреннего гематоретинального барьера (стенки капилляров сетчатки), иногда в сочетании с нарушением наружного гематоретинального барьера (пигментного эпителия сетчатки) [25]. При этом диабетический макулярный отек не является специфическим проявлением непролиферативной ДР, а может возникать на любой стадии патологического процесса. Дальнейшие изменения связаны с нарушением проходимости сосудов (препролиферативная ДР) и разрастанием новообразованных сосудов и патологической соединительной ткани (пролиферативная ретинопатия). На этих стадиях могут происходить массивные кровоизлияния, отслойка сетчатки и, как следствие, потеря зрения [25].
Изменениям на клеточном уровне, приводящим к нарушению микроциркуляции и ангиогенеза, предшествует ряд метаболических сдвигов. Известно, что в условиях длительно существующей гипергликемии метаболические нарушения (активация полиолового и гексозаминового пути превращения глюкозы, ОС, образование КПГ, хроническое воспаление), гемодинамические факторы (ускорение кровотока, нарушение ауторегуляции тонуса сосудов, внутрикапиллярная гипертензия) играют ключевую роль в развитии и прогрессировании ДР [2, 24, 26]. Немаловажное значение в патогенезе ДР имеют и гемореологические факторы (нарушения в системе коагуляционного звена гемостаза, активация тромбоцитов), нарушение ангиогенного баланса, что приводит к образованию микротромбов, ишемии сетчатки. Сетчатка является структурой с относительно высокой метаболической активностью, уровнем клеточного дыхания и потребностью в кислороде, поэтому ишемия ткани может привести к необратимым последствиям.
В результате активации всех этих путей повреждаются нервные элементы сетчатки и контактирующие с ее слоями капилляры хориоидеи (т. е. развивается микроангиопатия). Хотя нарушение микроциркуляции служит классическим признаком осложнений СД, известно, что нейродегенерация сетчатки происходит раньше. Нейродегенерация сопровождается апоптозом нейронов и дисфункцией глии, а ранние аномалии микроциркуляции характеризуются увеличением проницаемости сосудов, нарушением микрососудистой гемодинамики и вазорегрессией (утратой перицитов и повреждением эндотелия) [26]. Прогрессирующая дисфункция эндотелиальных клеток играет решающую роль в следующих морфоструктурных и патофизиологических изменениях сетчатки: в утолщении мембраны капиллярного базального сосуда, потере периваскулярных клеток, повреждении барьера сетчатки и неоваскуляризации [9, 27].
Роль добезилата кальция в терапии осложнений СД
При ДР, как и при других осложнениях СД, первоочередное значение придается достижению целевого гликемического контроля, поскольку cуществует сильная связь между уровнем HbA1c в крови и риском развития ретинопатии [23, 28]. Вместе с тем одним из терапевтических подходов является применение ангиопротекторов, благоприятно влияющих на микроциркуляцию, функциональное состояние эндотелия и базальной мембраны сосудистой стенки и препятствующих развитию структурных изменений сосудистой стенки. К настоящему времени накоплена определенная доказательная база по применению синтетического ангиопротектора — добезилата кальция (ДК) Докси-Хема (Сербия) при различных заболеваниях, сопровождающихся нарушением сосудистой проницаемости и микроциркуляции, в т. ч. при диабетических микроангиопатиях. ДК зарекомендовал себя как препарат, улучшающий прогноз при ДР и ДН [25, 26, 29, 30].
Основное действие ДК реализуется на уровне системы микроциркуляции (рис. 2). Ангиопротективное действие ДК обусловлено целым комплексом фармакологических эффектов в отношении патофизиологических процессов при микроангиопатиях, в числе которых антиоксидантные, противовоспалительные свойства, улучшение эндотелий-
зависимой вазодилатации, реологии крови и др. [31, 32].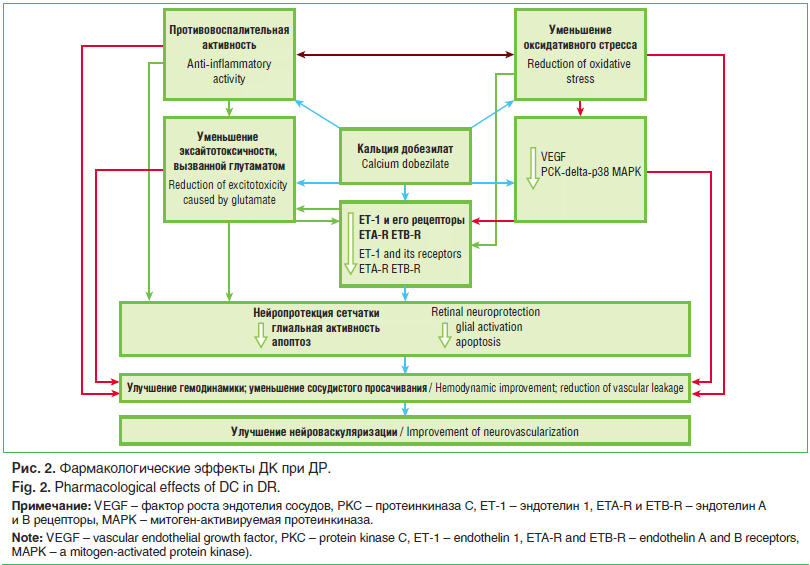
У больных СД значительно снижена продукция NO, а дисфункция эндотелия носит генерализованный характер [9], что является одним из ранних маркеров развития сосудистых нарушений. В этом плане важным свойством ДК является его способность повышать активность NO-синтазы, тем самым увеличивая синтез NO и улучшая эндотелий-зависимую вазодилатацию [33, 34]. Применение ДК сопровождается снижением уровня эндотелина-1, что связано с уменьшением тромбоксана А2, снижением уровня свободных радикалов и вязкости крови [33, 34]. Интерес представляет исследование J. Dong, в котором оценивалась эффективность ДК и ингибитора АПФ [35]. Пациенты были случайным образом распределены по трем группам (плацебо, ДК и периндоприл). В обеих группах лечения наблюдалось сравнимое снижение альбуминурии. Однако оценка динамики маркеров эндотелиальной дисфункции, таких как эндотелин-1 и NO, выявила явное преимущество ДК по сравнению с ингибитором АПФ.
Другими важными эффектами ДК, направленными на патогенетические механизмы сосудистых осложнений, являются ингибирование NF-kB и p38 митоген-активируемой протеинкиназы (p38 MAPK), уменьшение экспрессии молекул межклеточной адгезии-1 (ICAM-1) и адгезии сосудистого эндотелия-1 (VCAM-1), а также уменьшение содержания C-реактивного белка [33–36]. Стоит отметить дозозависимый антиангиогенный эффект ДК. Препарат ингибирует как сосудистый эндотелиальный фактор роста, вызывающий эндотелиальную пролиферацию и повышение сосудистой проницаемости, так и фактор роста фибробластов [32, 37].
Большой интерес представляет применение ДК и с позиции воздействия на систему тромбоцитарно-коагуляционного гемостаза. Повышенная вязкость крови обусловливает ее стаз (особенно в капиллярах и посткапиллярных венулах), которые поражаются уже на ранних стадиях диабетических микроангиопатий. Препарат способствует уменьшению агрегации тромбоцитов, снижает уровень фибриногена, тем самым улучшая реологию крови [33, 37, 38]. В частности, в исследовании С.А. Коротких и соавт. [39] было показано, что у пациентов с препролиферативной и непролиферативной ДР включение в комплексную терапию ДК с
