Целевой уровень лпнп при сахарном диабете
В обзоре приводится анализ основных характеристик, клинической эффективности и безопасности фиксированных комбинаций современных липидснижающих препаратов, показаны перспективы комбинированной терапии с использованием эзетимиба
Целевые уровни ХС-ЛНП в современных рекомендациях
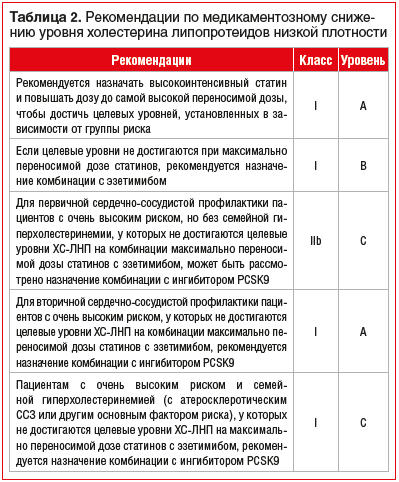
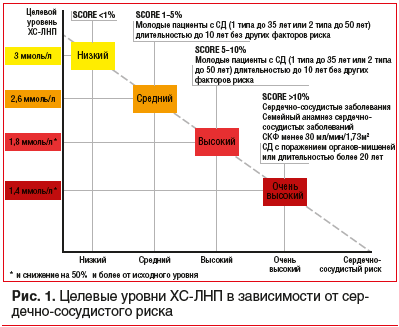
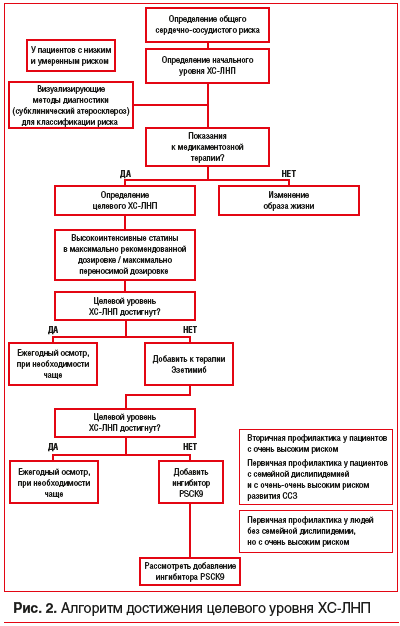
Сердечно-сосудистые заболевания (ССЗ) занимают первое место среди причин заболеваемости и смертности во всем мире [1]. Снижение уровня холестерина липопротеинов низкой плотности (ХС-ЛНП) с использованием ингибиторов ГМГ-КоА-редуктазы — краеугольный камень первичной и вторичной профилактики неблагоприятных сердечно-сосудистых исходов [2–8]. Согласно рекомендациям Европейского общества кардиологов 2019 г. пациентам с дислипидемией рекомендуется назначать высокоинтенсивный статин (например, аторвастатин или розувастатин), обеспечивающий необходимое снижение уровня ХС-ЛНП, и повышать дозу до максимальной переносимой, чтобы достичь целевых уровней ХС-ЛНП, установленных в зависимости от группы риска (табл. 1, 2). Целевые уровни ХС-ЛНП в зависимости от сердечно-сосудистого риска и алгоритм их достижения представлены на рисунках 1 и 2. У части пациентов, несмотря на использование высоких доз даже высокоинтенсивных статинов, не удается достичь целевых уровней ХС-ЛНП на фоне монотерапии. Даже при доказанности тезиса «чем ниже уровень ХС-ЛНП, тем ниже риск сердечно-сосудистой заболеваемости и смертности», несмотря на наличие четких клинических рекомендаций, показатели достижения целевого ХС-ЛНП среди пациентов, принимающих статины, составляют 33,7%, при этом у тех, кто получает статины для вторичной профилактики, — 58% [10], и им требуется комбинированная терапия с применением эзетимиба [11–15]. Прием фиксированной комбинации статина и эзетимиба повышает эффективность каждого препарата из пары (за счет синергического эффекта), увеличивает приверженность терапии и в некоторых случаях может быть более выгодным для пациента в экономическом отношении [16]. Целью данного обзора является анализ основных характеристик, клинической эффективности и безопасности фиксированных комбинаций современных липидснижающих препаратов для повышения возможности достижения целевого уровня ХС-ЛНП в соответствии с современными рекомендациями.


Симвастатин и эзетимиб
Первой фиксированной комбинацией статина и эзетимиба стала комбинация на основе симвастатина. Симвастатин 10–40 мг/сут снижает уровень ХС-ЛНП на 18–41% меньше, чем аторвастатин или розувастатин [17], что ограничивает его использование в случаях, когда требуется достижение современных целевых значений ХС-ЛНП. Биодоступность симвастатина составляет около 5%, время полувыведения — примерно 1–3 ч [18]. В целом препарат хорошо переносится, повышение уровня печеночных трансаминаз встречается у 1% пациентов [19].
Эзетимиб снижает уровень ХС-ЛНП, блокируя всасывание холестерина в тонком кишечнике и усиливая выделение холестерина с желчью. Множество исследований неоднократно демонстрировали синергический эффект назначения препаратов из класса статинов и эзетимиба [22–24].
Эффективность терапии эзетимибом и симвастатином была показана в рандомизированном двойном слепом плацебо-контролируемом исследовании IMProved Reduction of Outcomes: Vytorin Efficacy International Trial (IMPROVE-IT). Дизайн исследования был основан на сравнении монотерапии симвастатином (40 мг) и комбинированной терапии симвастатином и эзетимибом (40+10 мг) у пациентов после перенесенного инфаркта миокарда. В группе комбинированной терапии достигнутый уровень ХС-ЛНП был достоверно ниже (53,7 мг/дл против 69,5 мг/дл в группе монотерапии). Также было продемонстрировано уменьшение числа инфарктов и инсультов в группе комбинированной терапии (р<0,05) [25]. Интересны также результаты исследования 2017 г., которые показали, что протективный эффект комбинированной терапии был выше в группе с СКФ менее 45 мл/мин/1,73м2 [26].
Одновременный прием симвастатина и эзетимиба не увеличивал риск развития побочных эффектов статинов — миопатии и повышения уровня печеночных трансаминаз [27]. Более того, было показано, что комбинированный прием не увеличивает риск развития сахарного диабета 2 типа, что иногда наблюдается при терапии статинами в высоких дозах [28, 29].
Аторвастатин и эзетимиб
Аторвастатин в дозе 10–80 мг/сут снижает уровень ХС-ЛНП на 37–51%, уменьшает риск развития сердечно-сосудистых и цереброваскулярных осложнений, продемонстрировал свою эффективность при проведении как первичной, так и вторичной профилактики в серии клинических исследований и метаанализов [30].
Метаанализ, включивший 17 исследований, показал, что комбинированная терапия аторвастатином и эзетимибом снижает уровень ХС-ЛНП и триглицеридов и повышает уровень ХС-ЛВП (р<0,05) [31]. Комбинированная терапия продемонстрировала уменьшение атеросклероза коронарных артерий, по данным внутрисосудистого ультразвука, в сравнении с монотерапией аторвастатином [32]. Исследования показали сопоставимую частоту нежелательных реакций при комбинированной терапии аторвастатином и эзетимибом и монотерапии аторвастатином или эзетимибом, с единичными случаями повышения уровня печеночных трансаминаз, развитием миопатии или раздражением кишечника [33].
Розувастатин и эзетимиб
Розувастатин в дозе 5–40 мг/сут снижает уровень ХС-ЛНП на 46–55%, среднее снижение уровня холестерина и ХС-ЛНП — выше, чем у других препаратов из этой группы в эквивалентной дозировке. Биодоступность розувастатина составляет 20% (сопоставима с биодоступностью аторвастатина), время полувыведения — 19 ч. Большая часть препарата выделяется с желчью (72%), оставшаяся часть — с мочой. Препарат не метаболизируется системой цитохромов печени, в связи с этим практически не взаимодействует с другими препаратами. Такие побочные эффекты, как миопатия и рабдомиолиз встречаются редко (менее 0,1% и менее 0,01% соответственно) [19].
Эффективность и безопасность розувастатина были продемонстрированы в исследовании The Justification for the Use of statins in Prevention: an International Trial Evaluating Rosuvastatin (JUPITER) trial [33]. Назначение розувастатина снижало риск развития инфаркта, инсульта, уменьшало необходимость в реваскуляризации и госпитализации по поводу нестабильной стенокардии, а также риск смерти от всех причин на 44% по сравнению с плацебо (р<0,00001). Результаты исследования HOPE-3 (Heart Outcomes Prevention Evaluation 3) показали, что терапия розувастатином в сравнении с плацебо снижала риск развития сердечно-сосудистых осложнений у пациентов из группы со средним риском, в то время как только антигипертензивная терапия (кандесартаном) в сравнении с плацебо не приводила к снижению риска [35]. По сравнению с симвастатином и аторвастатином использование розувастатина уже в дозе 10 мг превосходит симвастатин в максимальной дозе 40 мг и эквивалентно применению аторвастатина 40 мг по способности снижать уровень ХС-ЛНП [1].
Эффективность комбинации розувастатина c эзетимибом была продемонстрирована в исследовании, включавшем 469 пациентов с высоким риском ССЗ, которые в течение 6 нед. получали либо монотерапию розувастатином (40 мг), либо комбинированную терапию розувастатином и эзетимибом (40+10 мг). Комбинированная терапия показала снижение уровня ХС-ЛНП на дополнительные 12% в сравнении с монотерапией (-69,8% против -57,1%). Более того, пациенты в группе комбинированной терапии чаще достигали целевого уровня ХС-ЛНП. Так, например, в группе с очень высоким риском 79,6% участников достигли целевых цифр (ХС-ЛНП менее 70 мг/дл), в то время как в группе монотерапии это удалось только в 35% случаев [36].
Безопасность и эффективность приема комбинированного препарата (эзетимиб 10 мг и розувастатин в дозе 5, 10 или 20 мг) были продемонстрированы в исследовании The Multiceneter Randomized Study of Rosuvastatin and Ezetimibe (MRS-ROSE). В ходе исследования сравнивалась эффективность комбинированного препарата с эффективностью монотерапии розувастатином в течение 8 нед. В зависимости от дозы розувастатина в комбинированном препарате уровень ХС-ЛНП снижался на 56–63%, что превышало эффективность монотерапии розувастатином в той же дозировке. Кроме того, у пациентов с сахарным диабетом или метаболическим синдромом отмечалось более значимое снижение уровня ХС-ЛНП, триглицеридов и общего холестерина среди получавших терапию комбинированным препаратом [37].
Исследование The Ildong Rosuvastatin & Ezetimibe for Hypercholestelomia (I-ROSETTE) показало, что безопасность и переносимость комбинированной терапии были сопоставимы с таковыми при монотерапии розувастатином [38].
Более высокая эффективность и благоприятный профиль безопасности комбинированной терапии розувастатином и эзетимибом по сравнению с увеличением дозы розувастатина были показаны в многоцентровом рандомизированном двойном слепом исследовании, проведенном в странах Северной и Южной Америки и Европы. 440 участников исследования были разделены на 2 параллельные группы (в зависимости от дозировки розувастатина), каждая из которых, в свою очередь, также разделялась на 2 группы: прием комбинированного препарата или увеличение дозы розувастатина (с 5 до 10 мг или с 10 до 20 мг, а в комбинированной терапии доза статина оставалась прежней). Целевого уровня ХС-ЛНП от 70 до 100 мг/дл достигли 59,4% пациентов, получавших комбинированную терапию, и только 30,9% при увеличении дозы розувастатина [39].
В январе 2019 г. в России зарегистрирован первый препарат фиксированной комбинации розувастатина и эзетимиба Розулип® Плюс. Препарат Розулип® Плюс показан в дополнение к диете пациентам с первичной гиперхолестеринемией (за исключением гетерозиготной семейной гиперхолестеринемии). Розулип® Плюс назначается в качестве заместительной терапии пациентам, липидный профиль которых адекватно контролировался одновременным применением отдельных препаратов розувастатина и эзетимиба в дозах, эквивалентных соответствующим дозам в фиксированной комбинации.
Перспективы комбинированной терапии с использованием эзетимиба
Бемпедоевая кислота — это липидснижающий препарат нового поколения, который способен снизить уровень ХС-ЛНП на 40%. Бемпедоевая кислота — это пролекарство, которое в печени превращается в бемпедоевый ацетил-коэнзим А, являющийся ингибитором фермента АТФ-цитрат липазы. В соответствии со своим механизмом действия этот препарат не только снижает уровень ХС-ЛНП, но и блокирует синтез жирных кислот [40–42].
Кoмбинация бемпедоевой кислоты (120 или 180 мг/сут) и эзетимиба (10 мг/сут) у пациентов с непереносимостью статинов и у тех, кто мог получать терапию статинами, привела к снижению уровня ХС-ЛНП на 43,1% и 47,7% соответственно в зависимости от дозировки препарата. Монотерапия бемпедоевой кислотой снижает уровень ХС-ЛНП на 27,5% и 30,1% (соответственно указанной дозе) и хорошо переносится [43]. В клиническом исследовании III фазы добавление этого препарата к терапии статинами и эзетимибом у пациентов с высоким и очень высоким риском развития ССЗ снижало уровень ХС-ЛНП на 28%, а риск развития ССЗ — на 33% [44]. Комбинация бемпедоевой кислоты и эзетимиба продолжает исследоваться как перспективная комбинация.
Заключение
Эзетимиб часто используется в качестве второго препарата для достижения целевого уровня ХС-ЛНП. Убедительно доказано, что комбинация статинов и эзетимиба эффективна и безопасна. В свете обновленных рекомендаций Европейского общества кардиологов 2019 г. комбинированная терапия розувастатином и эзетимибом привлекает особое внимание ввиду снижения рекомендуемых целевых значений ХС-ЛНП у пациентов с очень высоким риском менее 1,4 ммоль/л и снижения уровня ХС-ЛНП на 50% и более. Исследования продемонстрировали, что комбинация высокоинтенсивного статина (такого, как розувастатин) и эзетимиба снижает уровень ЛНП в среднем на 65% от исходного [9]. Достижение целевых значений ЛНП снизит риск развития сердечно-сосудистых осложнений, а видимый результат увеличит приверженность пациента терапии.
Препараты нового поколения на основе бемпедоевой кислоты демонстрируют многообещающие результаты по снижению уровня ХС-ЛНП как в монотерапии, так и в комбинации с другими препаратами (например, с эзетимибом) и интересны с точки зрения расширения возможностей достижения целевого ХС-ЛНП у пациентов, которые не могут принимать статины по разным причинам. Фиксированные комбинации липидснижающих препаратов позволяют уменьшить частоту нежелательных побочных реакций (например, уже доказано, что при совместном приеме эзетимиба со статинами снижается риск развития сахарного диабета), за счет синергического эффекта отмечается более значимое снижение уровня ХС-ЛНП и риска развития сердечно-сосудистых осложнений, более того, значительно повышается приверженность длительной липидснижающей терапии.
Источник
Дислипидемия у больного диабетом может быть результатом:
– некомпенсированного обмена веществ;
– побочным эффектом некоторых препаратов, включая высокие дозы бета-блокаторов (за исключением карведилола (carvedilol)), высокие дозы диуретиков, системных кортикостероидов и других иммуносупрессантов, антивирусных ингибиторов протеазы, андрогенов, прогестинов (за исключением микронизированного прогестерона и деспиронона (despironone)) или эстрогенов;
– ожирения;
– сопутствующих болезней, таких, как гипотиреоз, частота которого, кстати, повышена при сахарном диабете;
– наследственной гиперлипидемии.
Все вышеуказанные возможности должны быть учтены у каждого больного диабетом.
На момент выявления диабета у больного должен исследоваться липидный профиль, целевые значения которого указаны в табл.7.
Таблица .7
Целевые значения липидного обмена у больных сахарным диабетом
Показатели
Целевые значения, ммоль/л (мг%)
Мужчины
Женщины
Общий холестерин
4,5 (< 175,0)
ХС-ЛПНП у лиц без ССБ
< 2,6 (< 100,0)
ХС-ЛПНП у лиц с ССБ
< 1,8 (< 70,0)
ХС-ЛПВП
> 1,0 (> 35)
> 1,2 (> 46)
Триглицериды
< 1,7 (< 150)
Если показатели липидного обмена не превышают целевых значений, указанных в табл.7, то липидный профиль достаточно делать 1 раз в 2 года.
Если выявлена дислипидемия, то у больного необходимо с особой тщательностью контролировать способствующие ей факторы. При плохом контроле гликемии больному следует назначить программу интенсивного лечения для достижения и поддержания ее целевых значений (А1с < 7%). Любые препараты, провоцирующие дислипидемию, должны быть по возможности отменены. Больного дополнительно обследуют на диабетическую нефропатию или злоупотребление алкоголем. В случае наследственной гиперлипидемии обычно наблюдается умеренная или выраженная гиперхолистеринемия, не корректируемая компенсацией инсулиновой недостаточности. Поэтому кроме устранения инсулиновой недостаточности необходимо и назначение гиполипидемических препаратов.
У больных диабетом, которым показана лекарственная терапия гиперлипидемии, статины становятся препаратами первого выбора, потому что имеют явное преимущество при снижении риска ССБ и ССС. Более того, терапия статинами рекомендуется большинству больных диабетом старше 40 лет независимо от уровня ХС-ЛПНП.
Терапию статинами назначают обязательно на фоне мероприятий, модифицирующих образ жизни в сторону более «здорового». Основное показание для нее — превышение целевых показателей липидного обмена, и ее назначают всем больным с ИБС независимо от исходного уровня липидов. Если, несмотря на назначение максимальных доз статинов, целевые значения липидов не достигаются, то результат считается удовлетворительным, если ХС-ЛПНП снижается на 30—40% от исходного. В этом случае для достижения целевых значений статины можно комбинировать с фибратами, эзетимибом, никотиновой кислотой или секвестрантами желчных кислот.
В ряде последних обширных клинических исследований было показано, что у больных диабетом снижение уровня холестерина липопротеинов низкой плотности (ХС-ЛПНП) и триглицеридов плазмы, а также повышение уровня холестерина липопротеинов высокой плотности (ХС-ЛПВП) снижает частоту сердечно-сосудистых событий (ССС). В связи с этим на сегодня при диабете рекомендуется активное лечение нарушений липидного обмена.
Обмен липопротеинов при сахарном диабете
Липопротеины представляют собой сферические, макромолекулярные комплексы, которые являются носителями различных липидов и белков в плазме. Гидрофобные триглицериды и молекулы эфиров холестерина образуют ядро липопротеинов, и это ядро окружено амфипатическими (как гидрофобными, так и гидрофильными) фосфолипидами и белками. От сотен до нескольких тысяч молекул триглицеридов и эфиров холестерина несет в себе ядро липопротеинов. Аполипопротеины являются поверхностными белками липопротеинов. Они не только способствуют освобождению липидов из ядра, но также играют важную роль в регуляции уровня липидов плазмы и транспорта липопротеинов. Аполипопротеин (апо) В100 необходим для секреции печеночных липопротеинов очень низкой плотности (ЛПОНП), промежуточной плотности (ЛППП) и низкой плотности (ЛПНП). АпоВ48 представляет собой усеченную форму апоВ100 и обеспечивает поступление хиоломикронов из тонкого кишечника. АпоА-I является главным структурным белком ЛПВП.
Нарушение обмена хиломикронов, липопротеинов очень низкой
и высокой плотности у больных диабетом
После приема пищи пищевые жиры (триглицериды) и холестерин абсорбируются клетками тонкого кишечника и включаются в ядро образующихся хиломикронов, которые поступают в лимфатическую систему и затем в циркуляцию через верхнюю полую вену. В капиллярном русле жировой ткани и мышц хиломикроны взаимодействуют с ферментом липопротеиновая липаза (ЛпЛ), в результате триглицеридное хиломикроновое ядро гидролизируется и высвобождаются свободные жирные кислоты (СЖК). СЖК захватываются адипоцитами, в которых они снова включаются в состав триглицеридов. Когда мышца захватывает СЖК, они используются ею как источник энергии, включаясь во внутриклеточные метаболические процессы. Хиломикроновые ремнанты («остатки») представляют собой продукты вышеуказанного липолитического процесса, которые потеряли до 75% триглицеридов, и они быстро метаболизируются печенью. Печеночная триглицеридовая липаза (ПЛ), которая гидролизирует триглицериды хиломикроновых ремнантов, также играет определенную роль в элиминации ремнантов. Нарушение метаболизма хиломикронов и холомикроновых ремнантов часто наблюдается при СД2, при котором активность ЛпЛ может быть умеренно снижена. В то же время инсулинорезистентность активирует образование хиломикронов в кишечнике. При СД1 нарушение липидного обмена наблюдается только в случае декомпенсированного сахарного диабета и характеризуется выраженным снижением активности ЛпЛ, что сопровождается повышенным уровнем триглицеридов после еды. Не исключаются и генетически детерминированные дефекты ЛпЛ.
ЛПОНП производятся печенью, и их ядро состоит из триглицеридов и эфиров холестерина, а на поверхности расположены молекулы Апо100 и фосфолипиды. Активирует продукцию и секрецию в печени ЛПОНП повышенное поступление СЖК из жировой ткани, хотя не исключен и повышенный синтез в печени СЖК и холестерина при СД2, что также повышает продукцию ЛПОНП. В плазме триглицериды в ЛПОНП гидролизируются ЛпЛ и тем самым трансформируются в меньшие по размеру и более плотные ЛПОНП и ЛППП. При этом ЛППП подобны хиломикроновым ремнантам с тем отличием, что, кроме утилизации в печени, в плазме они катаболизируются до ЛПНП. Следовательно, активность ЛпЛ необходима для нормального функционирования метаболического каскада от ЛПОНП, через ЛППП и до ЛПНП. АпоВ100, единственный белок на поверхности ЛПНП, является лигандом для рецепторов ЛПНП, и поэтому концентрация ЛПНП в плазме зависит как от продукции ЛПНП, так и доступности рецепторов ЛПНП.
Уровень триглицеридов ЛПОНП часто повышен у больных СД2. Повышенный уровень холестерина за счет ЛПНП объясняется при диабете большим его содержанием в каждой липопротеиновой частице. Гликирование или перекисное окисление ЛПНП при диабете нарушает процессы их нормальной элиминации и приводит к преимущественному их накоплению в сосудистой стенке. Тем более что инсулин активирует экспрессию гена рецепторов ЛПНП, и, следовательно, инсулинорезистентность или дефицит инсулина тоже могут нарушать метаболизм ЛПНП.
ЛПВП являются наиболее сложными по строению частицами, которые представляют собой комплекс апоА-I, апоА-II и апоА-VI с фосфолипидами. Исходные частицы называются пре-бета-ЛПВП и являются акцепторами свободного клеточного холестерина, и потому ЛПВП — это прежде всего резервный путь транспорта холестерина из периферических тканей в печень, откуда он выводится из организма. Эфиры холестерина ЛПВП могут также включаться в частицы ЛПОНП и хиломикроны в присутствии холестерил эстер транспортного белка (ХЭТБ).
При СД2 уровень ХС-ЛПВП, как правило, снижен, что связано с повышенным транспортом эфиров холестерина из ЛПВП в ЛПОВП и хиломикроны. При СД1 ХС-ЛПВП нормален или даже повышен.
Возврат к списку
Дислипидемия у больного диабетом может быть результатом:
– некомпенсированного обмена веществ;
– побочным эффектом некоторых препаратов, включая высокие дозы бета-блокаторов (за исключением карведилола (carvedilol)), высокие дозы диуретиков, системных кортикостероидов и других иммуносупрессантов, антивирусных ингибиторов протеазы, андрогенов, прогестинов (за исключением микронизированного прогестерона и деспиронона (despironone)) или эстрогенов;
– ожирения;
– сопутствующих болезней, таких, как гипотиреоз, частота которого, кстати, повышена при сахарном диабете;
– наследственной гиперлипидемии.
Все вышеуказанные возможности должны быть учтены у каждого больного диабетом.
На момент выявления диабета у больного должен исследоваться липидный профиль, целевые значения которого указаны в табл.7.
Таблица .7
Целевые значения липидного обмена у больных сахарным диабетом
Показатели | Целевые значения, ммоль/л (мг%) | |
Мужчины | Женщины | |
Общий холестерин | 4,5 (< 175,0) | |
ХС-ЛПНП у лиц без ССБ | < 2,6 (< 100,0) | |
ХС-ЛПНП у лиц с ССБ | < 1,8 (< 70,0) | |
ХС-ЛПВП | > 1,0 (> 35) | > 1,2 (> 46) |
Триглицериды | < 1,7 (< 150) | |
Если показатели липидного обмена не превышают целевых значений, указанных в табл.7, то липидный профиль достаточно делать 1 раз в 2 года.
Если выявлена дислипидемия, то у больного необходимо с особой тщательностью контролировать способствующие ей факторы. При плохом контроле гликемии больному следует назначить программу интенсивного лечения для достижения и поддержания ее целевых значений (А1с < 7%). Любые препараты, провоцирующие дислипидемию, должны быть по возможности отменены. Больного дополнительно обследуют на диабетическую нефропатию или злоупотребление алкоголем. В случае наследственной гиперлипидемии обычно наблюдается умеренная или выраженная гиперхолистеринемия, не корректируемая компенсацией инсулиновой недостаточности. Поэтому кроме устранения инсулиновой недостаточности необходимо и назначение гиполипидемических препаратов.
У больных диабетом, которым показана лекарственная терапия гиперлипидемии, статины становятся препаратами первого выбора, потому что имеют явное преимущество при снижении риска ССБ и ССС. Более того, терапия статинами рекомендуется большинству больных диабетом старше 40 лет независимо от уровня ХС-ЛПНП.
Терапию статинами назначают обязательно на фоне мероприятий, модифицирующих образ жизни в сторону более «здорового». Основное показание для нее — превышение целевых показателей липидного обмена, и ее назначают всем больным с ИБС независимо от исходного уровня липидов. Если, несмотря на назначение максимальных доз статинов, целевые значения липидов не достигаются, то результат считается удовлетворительным, если ХС-ЛПНП снижается на 30—40% от исходного. В этом случае для достижения целевых значений статины можно комбинировать с фибратами, эзетимибом, никотиновой кислотой или секвестрантами желчных кислот.
В ряде последних обширных клинических исследований было показано, что у больных диабетом снижение уровня холестерина липопротеинов низкой плотности (ХС-ЛПНП) и триглицеридов плазмы, а также повышение уровня холестерина липопротеинов высокой плотности (ХС-ЛПВП) снижает частоту сердечно-сосудистых событий (ССС). В связи с этим на сегодня при диабете рекомендуется активное лечение нарушений липидного обмена.
Обмен липопротеинов при сахарном диабете
Липопротеины представляют собой сферические, макромолекулярные комплексы, которые являются носителями различных липидов и белков в плазме. Гидрофобные триглицериды и молекулы эфиров холестерина образуют ядро липопротеинов, и это ядро окружено амфипатическими (как гидрофобными, так и гидрофильными) фосфолипидами и белками. От сотен до нескольких тысяч молекул триглицеридов и эфиров холестерина несет в себе ядро липопротеинов. Аполипопротеины являются поверхностными белками липопротеинов. Они не только способствуют освобождению липидов из ядра, но также играют важную роль в регуляции уровня липидов плазмы и транспорта липопротеинов. Аполипопротеин (апо) В100 необходим для секреции печеночных липопротеинов очень низкой плотности (ЛПОНП), промежуточной плотности (ЛППП) и низкой плотности (ЛПНП). АпоВ48 представляет собой усеченную форму апоВ100 и обеспечивает поступление хиоломикронов из тонкого кишечника. АпоА-I является главным структурным белком ЛПВП.
Нарушение обмена хиломикронов, липопротеинов очень низкой
и высокой плотности у больных диабетом
После приема пищи пищевые жиры (триглицериды) и холестерин абсорбируются клетками тонкого кишечника и включаются в ядро образующихся хиломикронов, которые поступают в лимфатическую систему и затем в циркуляцию через верхнюю полую вену. В капиллярном русле жировой ткани и мышц хиломикроны взаимодействуют с ферментом липопротеиновая липаза (ЛпЛ), в результате триглицеридное хиломикроновое ядро гидролизируется и высвобождаются свободные жирные кислоты (СЖК). СЖК захватываются адипоцитами, в которых они снова включаются в состав триглицеридов. Когда мышца захватывает СЖК, они используются ею как источник энергии, включаясь во внутриклеточные метаболические процессы. Хиломикроновые ремнанты («остатки») представляют собой продукты вышеуказанного липолитического процесса, которые потеряли до 75% триглицеридов, и они быстро метаболизируются печенью. Печеночная триглицеридовая липаза (ПЛ), которая гидролизирует триглицериды хиломикроновых ремнантов, также играет определенную роль в элиминации ремнантов. Нарушение метаболизма хиломикронов и холомикроновых ремнантов часто наблюдается при СД2, при котором активность ЛпЛ может быть умеренно снижена. В то же время инсулинорезистентность активирует образование хиломикронов в кишечнике. При СД1 нарушение липидного обмена наблюдается только в случае декомпенсированного сахарного диабета и характеризуется выраженным снижением активности ЛпЛ, что сопровождается повышенным уровнем триглицеридов после еды. Не исключаются и генетически детерминированные дефекты ЛпЛ.
ЛПОНП производятся печенью, и их ядро состоит из триглицеридов и эфиров холестерина, а на поверхности расположены молекулы Апо100 и фосфолипиды. Активирует продукцию и секрецию в печени ЛПОНП повышенное поступление СЖК из жировой ткани, хотя не исключен и повышенный синтез в печени СЖК и холестерина при СД2, что также повышает продукцию ЛПОНП. В плазме триглицериды в ЛПОНП гидролизируются ЛпЛ и тем самым трансформируются в меньшие по размеру и более плотные ЛПОНП и ЛППП. При этом ЛППП подобны хиломикроновым ремнантам с тем отличием, что, кроме утилизации в печени, в плазме они катаболизируются до ЛПНП. Следовательно, активность ЛпЛ необходима для нормального функционирования метаболического каскада от ЛПОНП, через ЛППП и до ЛПНП. АпоВ100, единственный белок на поверхности ЛПНП, является лигандом для рецепторов ЛПНП, и поэтому концентрация ЛПНП в плазме зависит как от продукции ЛПНП, так и доступности рецепторов ЛПНП.
Уровень триглицеридов ЛПОНП часто повышен у больных СД2. Повышенный уровень холестерина за счет ЛПНП объясняется при диабете большим его содержанием в каждой липопротеиновой частице. Гликирование или перекисное окисление ЛПНП при диабете нарушает процессы их нормальной элиминации и приводит к преимущественному их накоплению в сосудистой стенке. Тем более что инсулин активирует экспрессию гена рецепторов ЛПНП, и, следовательно, инсулинорезистентность или дефицит инсулина тоже могут нарушать метаболизм ЛПНП.
ЛПВП являются наиболее сложными по строению частицами, которые представляют собой комплекс апоА-I, апоА-II и апоА-VI с фосфолипидами. Исходные частицы называются пре-бета-ЛПВП и являются акцепторами свободного клеточного холестерина, и потому ЛПВП — это прежде всего резервный путь транспорта холестерина из периферических тканей в печень, откуда он выводится из организма. Эфиры холестерина ЛПВП могут также включаться в частицы ЛПОНП и хиломикроны в присутствии холестерил эстер транспортного белка (ХЭТБ).
При СД2 уровень ХС-ЛПВП, как правило, снижен, что связано с повышенным транспортом эфиров холестерина из ЛПВП в ЛПОВП и хиломикроны. При СД1 ХС-ЛПВП нормален или даже повышен.
Возврат к списку
Источник
