Иммунопатогенез сахарного диабета 1 типа
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке “Файлы работы” в формате PDF
Содержание……………………………………………..………………….…2
Глава 1.
Сахарный диабет 1 типа….…………………………….………………….…3
Сравнение с СД2 типа.………………………………………………………..3
Патофизиология…………..………………………….…………………….…4
Нейропатии…………………………….………………………………………5
Ангиопатии………………………………………………………………….…5
Нефропатии……………………………………………………………………6
Двойной сахарный диабет………………………………………………..…..6
Глава 2.
Сахарный диабет 2 типа………………………………………………………7
Патофизиология…………………………………………………………….…7
Литература…………………………………………………………………….10
Глава 1.
Сахарный диабет 1 типа.
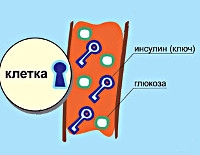
Сахарный диабет (СД) 1 типа является мультисистемным заболеванием как с биохимическими так и с анатомическими (структурными) последствиями. Это хроническое заболевание углеводного, жирового, и белкового обмена, вызванное недостатком инсулина, который возникает от стойкой и прогрессирующей неспособности поджелудочной железы вырабатывать инсулин из-за аутоиммунного разрушения бета-клеток.
СД 1 типа может возникнуть в любом возрасте. Наиболее распространен среди несовершеннолетних, но также может развиваться и у взрослых, особенно в возрасте 30-40 лет.
Сравнение СД1 типа и СД2 типа.
В отличие от людей с СД 2-го типа, лица с СД 1 типа, как правило, не страдают ожирением и, как правило, у них начало заболевания связано с развитием диабетического кетоацидоза (ДКА). Отличительной чертой больных СД 1 типа заключается в том, что если отменить инъекции инсулина — это вызовет кетоз и, в конечном счете, разовьется кетоацидоз. Таким образом, эти больные постоянно зависят от экзогенного инсулина.
Лечение.
Лечение СД 1 типа требует пожизненной терапии инсулином. Мультидисциплинарный подход врача, медсестры и диетолога, а также регулярные консультации специалистов, необходимы для контроля гликемии, а также для ограничения развитие разрушительных осложнений и управления такими осложнениями, когда они развиваются.
Патофизиология СД1 типа.
Сахарный диабет (СД) 1 типа является кульминацией лимфоцитарной инфильтрации и деструкции инсулин-секретирующих бета-клеток островков Лангерганса в поджелудочной железе. Из-за разрушения бета-клеток их масса снижается, секреция инсулина уменьшается до тех пор, пока имеющийся инсулин больше не является достаточным для поддержания нормального уровня глюкозы в крови. После того как 80-90% бета-клеток разрушены, развивается гипергликемия и диагноз «сахарный диабет» может быть поставлен. Пациенты нуждаются в экзогенном инсулине, чтобы исправить возникшую катаболическую катастрофу, предотвратить кетоз, снизить гипергликемию, и нормализовать жировой и белковый обмен.
В настоящее время, аутоиммунная природа заболевания считается основным фактором в патофизиологии СД 1 типа. У генетически восприимчивых людей, вирусные инфекции могут стимулировать выработку антител против вирусных белков, которые вызывают аутоиммунные реакции против антигенно подобных молекул бета-клеток.
Примерно 85% пациентов с СД 1 типа имеют, циркулирующие антитела к островковым клеткам, и у большинства также обнаруживаются антитела к инсулину до получения инсулиновой терапии. Наиболее часто встречаются антитела, направленные против декарбоксилазы глутаминовой кислоты (GAD), фермента, который находится в бета-клетках поджелудочной железы.
Распространенность СД 1 типа увеличивается у пациентов с другими аутоиммунными заболеваниями, такими как болезнь Грейвса, тиреоидит Хашимото, и болезнь Аддисона. Pilia и др обнаружили высокую распространенность антител (IA2) и анти-GAD антител у пациентов с аутоиммунным тиреоидитом.
В исследованиях Philippe и др. использовалась компьютерная томография (КТ), результаты теста со стимуляцией глюкагоном, и измерение эластазы-1 в кале для подтверждения снижение объема секреции поджелудочной железы у лиц с СД. Эти результаты, которые в равной степени присутствуют при СД 1 и 2-го типов, могут также объяснить, связанную экзокринную дисфункцию, которая появляется при СД.
Полиморфизм генов человеческого лейкоцитарного антигена (HLA) II класса главного комплекса гистосовместимости, которые кодируют DR и DQ считаются основными генетическими детерминантами СД 1 типа. Около 95% пациентов с СД 1 типа имеют либо HLA-DR3 или HLA-DR4. Гетерозиготы этих гаплотипов имеют значительно больший риск для развития СД, чем гомозиготы. HLA-DQs рассматриваются также как специфический маркер восприимчивости СД 1 типа. В то же время некоторые гаплотипы (например, HLA-DR2) вызывают сильную защиту против развития СД 1 типа.
Сенсорная и вегетативная нейропатии.
Сенсорная и вегетативная нейропатии у людей с диабетом вызваны аксональной дегенерацией и сегментарной демиелинизацией. Многие факторы влияют на это, в том числе накопление сорбита в периферических чувствительных нервах из-за устойчивой гипергликемии. Моторная нейропатия и черепная-мононейропатия развиваються в результате сосудистых заболеваний кровеносных сосудах, питающих нервы.
Ангиопатия.
С помощью видео капилляроскопии, Barchetta обнаружил высокую распространенность капиллярных изменений у пациентов с сахарным диабетом, особенно тех у кого есть повреждения сетчатки.
Это отражает общность поражения микрососудистого русла у пациентов обоих типов сахарного диабета.
Микрососудистые заболевания вызывают множественные патологические осложнения у людей с диабетом. Гиалиновый атеросклероз, характерный рисунок из утолщения стенки мелких артериол и капилляров, является широко распространенным осложнением и отвечает за ишемические изменения в почках, сетчатке глаза, головного мозга и периферических нервов.
Атеросклероз главных почечных артерий и их интраренальных ветвей вызывает хроническую ишемию нефрона. Это является существенным компонентом множественных почечных поражений при сахарном диабете.
Дефицит витамина D является важным независимым прогностическим фактором развития коронарной кальцификации у пациентов с СД 1 типа. Joergensen и др установили, что дефицит витамина D при диабете 1 типа может спрогнозировать все причины смертности, но не развития микрососудистых осложнений.
Нефропатия.
В почках характерно утолщении стенки мелких артериол и капилляров, что приводит к диабетической нефропатии, которая характеризуется протеинурией, гиалинозом клубочков (Kimmelstiel-Wilson), и хронической почечной недостаточностью. Обостряется экспрессия цитокинов, таких как трансформирующий ростовой фактор бета 1 (TGF-beta1), он является частью патофизиологии гломерулосклероза, который начинается на ранних стадиях диабетической нефропатии.
Генетические факторы влияют на развитие диабетической нефропатии.
Двойной диабет.
В районах, где показатели СД 2-го типа и ожирение являются высокими, лица с СД 1 типа могут подвергаться генетическим и экологическим факторам, которые приводят к проявлению особенностей СД 2 типа, таких как снижение чувствительности к инсулину. Это состояние называется двойной диабет.
В исследовании, которое включало 207 пациентов с СД 1 типа, Epstein и др использовали расчетную скорость утилизации глюкозы (eGDR) для оценки резистентности к инсулину и обнаружил, что eGDR была значительно ниже (и, таким образом, инсулинорезистентность была выше) у черных больных (5.66 мг/кг/мин), чем у испаноязычных пациентов (6.70 мг/кг/мин) или белых пациентов (7.20 мг/кг/мин). Кроме того, низкий уровень GDR был связан с повышенным риском сосудистых осложнений диабета (например, сердечно-сосудистых заболеваний, диабетической ретинопатии, или тяжелых хронических заболеваний почек).
Глава 2.
Сахарный диабет 2 типа.
Сахарный диабет 2-го типа (инсулиннезависимый диабет) — метаболическое заболевание, характеризующееся хронической гипергликемией, развивающейся в результате нарушения взаимодействия инсулина с клетками тканей.
Патофизиология.
При сахарном диабете 2-го типа установлен ряд патофизиологических нарушений, которые в конечном итоге приводят к гипергликемии — среди них основными являются периферическая инсулинорезистентность, нарушенная продукция глюкозы печенью и нарушенная секреция инсулина. На ранней стадии развития заболевания толерантность к глюкозе остается нормальной, т. к. характерная для этого типа диабета инсулинорезистентность преодолевается за счет повышения секреции инсулина. Однако при нарастании инсулинорезистентности компенсация уменьшается вследствие невозможности дальнейшего увеличения продукции инсулина бета-клеткам и, что сопровождается возникновением гипергликемии после еды (углеводной нагрузки). На более поздних стадиях развития заболевания секреция инсулина снижается и гипергликемия возникает не только после еды, но и натощак.
Инсулинорезистентность может прослеживаться на пререцепторном, рецепторном и пострецепторном уровнях. Пререцепторная инсулинорезистентность может быть обусловлена нарушениями превращения проинсулина в инсулин и С-пептид и/или нарушением ранней фазы секреции инсулина. Рецепторная инсулинорезистентность, как полагают, связана с уменьшением числа рецепторов на поверхности клетки и структурными их изменениями. Пострецепторные дефекты включают изменения активности трансдукторов, участвующих в передаче инсулинового сигнала внутри клетки, принимающих участие в синтезе белка, митогенезе. синтезе гликогена и в транспорте глюкозы.
Среди пострецепторных нарушений большое значение придается генетическому полиморфизму различных трансдукторов, ответственных за передачу инсулинового сигнала внутри клетки, в частности.
субстратных белков IRS-1 и фермента фосфоинозитол-3-киназы, передающей сигнал и вызывающей перемещение белка — носителя глюкозы GLUT-4 к клеточной мембране. В мышечной ткани обнаружены изменения активности инсулинзависимой гликогенсинтетазы и полиморфизм гена гликогенсинтетазы (хромосома 19).
Инсулинорезистентность развивается не только в скелетных мышцах, но и в других тканях, в частности, в печени. У здоровых людей печень поддерживает определенный уровень гликемии за счет гликогенолиза и глюконеогенеза из аминокислот, лактата, глицерина, жирных кислот. Инсулин способствует образованию гликогена и подавляет глюконеогенез. При сахарном диабете 2-го типа инсулинорезистентность печеночных клеток проявляется недостаточным подавлением глюконеогенеза инсулином, вследствие чего возникает повышение уровня сахара крови натощак, а также нарушением синтеза гликогена и повышением уровня глюкозы после еды.
Нарушения секреции инсулина при сахарном диабете 2-го типа на ранних стадиях заболевания могут быть обусловлены понижением чувствительности бета-клеток к стимулирующему действию глюкозы. Секреция инсулина в ответ на углеводную нагрузку при этом заболевании развивается позже и уровень инсулина не соответствует уровню гликемии, так что усвоение глюкозы уменьшено по сравнению со здоровыми людьми на 30—60%.
На более поздних стадиях сахарного диабета 2-го типа продукция инсулина прогрессивно уменьшается. Причина подобного уменьшения точно не установлена. Считается, что хроническая гипергликемия и избыточное содержание свободных жирных кислот могут оказывать повреждающее действие на бета-клетки. Таким образом, инсулинорезистентность тканей, принимающих участие в распределении и усвоении глюкозы, а также нарушения чувствительности бета-клеток к стимулирующему действию глюкозы с соответствующими нарушениями секреции инсулина приводят к развитию гипергликемии при сахарном диабете 2-го типа. Персистирующая гипергликемия сама по себе способна приводить к дистрофии и гибели бета-клеток, при этом секреция эндогенного инсулина снижается, что вызывает дальнейшее ухудшение утилизации глюкозы тканями и увеличение гипергликемии. Несмотря на достаточно большое количество выявленных дефектов действия инсулина на периферии, к настоящему времени невозможно назвать, какие именно гены непосредственно связаны с развитием сахарного диабета 2-го типа; можно говорить только о полигенном характере наследования заболевания. По-видимому, существует два типа генетических дефектов, во-первых, вызывающих развитие инсулинорезистентности, а во-вторых, приводящих к пониженной секреторной активности бета-клеток или понижению их чувствительности к гипергликемии.
Литература.
Эндокринология под редакцией И.И. Дедова, Г.А. Мельниченко// Эндокринология: 2007.- 7. -263-341
Эндокринология Шостак Н.А.// Эндокринология: 2007. – 5. – 128. – 265.
Патофизиология А.Д. Адо.// Патофизиология:2000. – 15. – 359-373.
Allhormon.ru
eurolab.ua
10
Источник
Сахарный диабет 1 типа – это эндокринное заболевание, характеризующееся недостаточным производством инсулина и повышением уровня глюкозы в крови. Из-за продолжительной гипергликемии пациенты страдают от жажды, теряют вес, быстро утомляются. Характерны мышечные и головные боли, судороги, кожный зуд, усиление аппетита, частые мочеиспускания, бессонница, приливы жара. Диагностика включает клинический опрос, лабораторные исследования крови и мочи, выявляющие гипергликемию, недостаток инсулина, метаболические нарушения. Лечение проводится методом инсулинотерапии, назначается диета, занятия физической культурой.
Общие сведения
Термин «диабет» происходит из греческого языка и означает «течет, вытекает», таким образом, название болезни описывает один из ее ключевых симптомов – полиурию, выделение большого количества мочи. Сахарный диабет 1 типа называют также аутоиммунным, инсулинозависимым и ювенильным. Заболевание может проявиться в любом возрасте, но чаще манифестирует у детей и подростков. В последние десятилетия отмечается рост эпидемиологических показателей. Распространенность всех форм сахарного диабета составляет 1-9%, на долю инсулинозависимого варианта патологии приходится 5-10% случаев. Заболеваемость зависит от этнической принадлежности пациентов, наиболее высока среди скандинавских народов.

Сахарный диабет 1 типа
Причины СД 1 типа
Факторы, способствующие развитию болезни, продолжают исследоваться. К настоящему времени установлено, что сахарный диабет первого типа возникает на основе сочетания биологической предрасположенности и внешних неблагоприятных воздействий. К наиболее вероятным причинам поражения поджелудочной железы, снижения выработки инсулина относят:
- Наследственность. Склонность к инсулинозависимому диабету передается по прямой линии – от родителей к детям. Выявлено несколько комбинаций генов, предрасполагающих к болезни. Они наиболее распространены среди жителей Европы и Северной Америки. При наличии больного родителя риск для ребенка увеличивается на 4-10% по сравнению с общей популяцией.
- Неизвестные внешние факторы. Существуют некие воздействия среды, провоцирующие СД 1 типа. Этот факт подтверждается тем, что однояйцевые близнецы, имеющие абсолютно одинаковый набор генов, заболевают вместе лишь в 30-50% случаев. Также установлено, что люди, мигрировавшие с территории с низкой заболеваемостью на территорию с более высокой эпидемиологией, чаще болеют диабетом, чем те, кто отказался от миграции.
- Вирусная инфекция. Аутоиммунный ответ на клетки поджелудочной может быть запущен вирусной инфекцией. Наиболее вероятно влияние вирусов Коксаки и краснухи.
- Химикаты, лекарства. Бета-клетки железы, производящей инсулин, могут быть поражены некоторыми химическими средствами. Примерами таких соединений являются крысиный яд и стрептозоцин – препарат для онкологических больных.
Патогенез
В основе патологии лежит недостаточность производства гормона инсулина в бета-клетках островков Лангерганса поджелудочной железы. К инсулинозависимым тканям относятся печеночная, жировая и мышечная. При сокращении секреции инсулина они перестают принимать глюкозу из крови. Возникает состояние гипергликемии – ключевой признак сахарного диабета. Кровь сгущается, нарушается кровоток в сосудах, что проявляется ухудшением зрения, трофическими поражениями конечностей.
Недостаточность инсулина стимулирует распад жиров и белков. Они поступают в кровь, а затем метаболизируются печенью в кетоны, которые становятся источниками энергии для инсулиннезависимых тканей, включая ткани головного мозга. Когда концентрация сахара крови превышает 7-10 ммоль/л, активизируется запасной путь выведения глюкозы – через почки. Развивается глюкозурия и полиурия, вследствие чего возрастает риск дегидратации организма и дефицита электролитов. Для компенсации потери воды усиливается чувство жажды (полидипсия).
Классификация
Согласно рекомендациям Всемирной организации здравоохранения, сахарный диабет I типа подразделяют на аутоиммунный (спровоцированный выработкой антител к клеткам железы) и идиопатический (органические изменения в железе отсутствуют, причины патологии остаются неизвестными). Развитие болезни происходит в несколько стадий:
- Выявление предрасположенности. Проводятся профилактические обследования, определяется генетическая отягощенность. С учетом средних статистических показателей по стране рассчитывается уровень риска развития заболевания в будущем.
- Начальный пусковой момент. Включаются аутоиммунные процессы, повреждаются β-клетки. Антитела уже вырабатываются, но производство инсулина остается нормальным.
- Активный хронический аутоиммунный инсулит. Титр антител становится высоким, количество клеток, производящих инсулин, сокращается. Определяется высокий риск манифестации СД в ближайшие 5 лет.
- Гипергликемия после углеводной нагрузки. Деструкции подвергается значительная часть вырабатывающих инсулин клеток. Производство гормона уменьшается. Сохраняется нормальный уровень глюкозы натощак, но после приема пищи в течение 2 часов определяется гипергликемия.
- Клиническая манифестация болезни. Проявляются симптомы, характерные для сахарного диабета. Секреция гормона резко снижена, деструкции подвержено 80-90% клеток железы.
- Абсолютная инсулиновая недостаточность. Все клетки, ответственные за синтез инсулина, погибают. Гормон поступает в организм только в форме препарата.
Симптомы СД 1 типа
Основные клинические признаки манифестации заболевания – полиурия, полидипсия и потеря веса. Учащаются позывы к мочеиспусканию, объем суточной мочи достигает 3-4 литров, иногда появляется ночное недержание. Пациенты испытывают жажду, ощущают сухость во рту, выпивают до 8-10 литров воды за сутки. Аппетит усиливается, но масса тела уменьшается на 5-12 кг за 2-3 месяца. Дополнительно может отмечаться бессонница ночью и сонливость днем, головокружения, раздражительность, быстрая утомляемость. Больные чувствуют постоянную усталость, с трудом выполняют привычную работу.
Возникает зуд кожи и слизистых оболочек, высыпания, изъязвления. Ухудшается состояние волос и ногтей, долго не заживают раны и иные кожные поражения. Нарушение кровотока в капиллярах и сосудах называется диабетической ангиопатией. Поражение капилляров проявляется снижением зрения (диабетическая ретинопатия), угнетением функций почек с отеками, артериальной гипертензией (диабетическая нефропатия), неравномерным румянцем на щеках и подбородке. При макроангиопатии, когда в патологический процесс вовлекаются вены и артерии, начинает прогрессировать атеросклероз сосудов сердца и нижних конечностей, развивается гангрена.
У половины больных определяются симптомы диабетической нейропатии, которая является результатом электролитного дисбаланса, недостаточного кровоснабжения и отека нервной ткани. Ухудшается проводимость нервных волокон, провоцируются судороги. При периферической нейропатии пациенты жалуются на жжение и болезненные явления в ногах, особенно по ночам, на ощущение «мурашек», онемение, повышенную чувствительность к прикосновениям. Для автономной нейропатии характерны сбои со стороны функций внутренних органов – возникают симптомы расстройств пищеварения, пареза мочевого пузыря, мочеполовых инфекций, эректильной дисфункции, стенокардии. При очаговой нейропатии формируются боли различной локализации и интенсивности.
Осложнения
Продолжительное нарушение углеводного обмена может привести к диабетическому кетоацидозу – состоянию, характеризующемуся накоплением в плазме кетонов и глюкозы, повышением кислотности крови. Протекает остро: исчезает аппетит, появляется тошнота и рвота, боль в животе, запах ацетона в выдыхаемом воздухе. При отсутствии медицинской помощи наступает помрачение сознания, кома и смерть. Больные с признаками кетоацидоза нуждаются в неотложном лечении. Среди других опасных осложнений диабета – гиперосмолярная кома, гипогликемическая кома (при неправильном применении инсулина), «диабетическая стопа» с риском ампутации конечности, тяжелая ретинопатия с полной потерей зрения.
Диагностика
Обследование пациентов осуществляет врач-эндокринолог. Достаточными клиническими критериями болезни являются полидипсия, полиурия, изменения веса и аппетита – признаки гипергликемии. В ходе опроса врач также уточняет наличие наследственной отягощенности. Предполагаемый диагноз подтверждается результатами лабораторных исследований крови, мочи. Обнаружение гипергликемии позволяет различить сахарный диабет с психогенной полидипсией, гиперпаратиреозом, хронической почечной недостаточностью, несахарным диабетом. На втором этапе диагностики проводится дифференциация различных форм СД. Комплексное лабораторное обследование включает следующие анализы:
- Глюкоза (кровь). Определение сахара выполняется трехкратно: с утра натощак, через 2 часа после нагрузки углеводами и перед сном. О гипергликемии свидетельствуют показатели от 7 ммоль/л натощак и от 11,1 ммоль/л после употребления углеводной пищи.
- Глюкоза (моча). Глюкозурия указывает на стойкую и выраженную гипергликемию. Нормальные значения для данного теста (в ммоль/л) – до 1,7, пограничные – 1,8-2,7, патологические – более 2,8.
- Гликированный гемоглобин. В отличие от свободной, несвязанной с белком глюкозы, количество гликозилированного гемоглобина крови остается относительно постоянным на протяжении суток. Диагноз диабета подтверждается при показателях 6,5% и выше.
- Гормональные тесты. Проводятся тесты на инсулин и С-пептид. Нормальная концентрация иммунореактивного инсулина крови натощак составляет от 6 до 12,5 мкЕД/мл. Показатель С-пептида позволяет оценить активность бета-клеток, объем производства инсулина. Нормальный результат – 0,78-1,89 мкг/л, при сахарном диабете концентрация маркера снижена.
- Белковый метаболизм. Выполняются анализы на креатинин и мочевину. Итоговые данные дают возможность уточнить функциональные возможности почек, степень изменения белкового обмена. При поражении почек показатели выше нормы.
- Липидный метаболизм. Для раннего выявления кетоацидоза исследуется содержание кетоновых тел в кровотоке, моче. С целью оценки риска атеросклероза определяется уровень холестеринов крови (общий холестерин, ЛПНП, ЛПВП).
Лечение СД 1 типа
Усилия врачей нацелены на устранение клинических проявлений диабета, а также на предупреждение осложнений, обучение пациентов самостоятельному поддержанию нормогликемии. Больных сопровождает полипрофессиональная бригада специалистов, в которую входят эндокринологи, диетологи, инструктора ЛФК. Лечение включает консультации, применение лекарственных средств, обучающие занятия. К основным методам относятся:
- Инсулинотерапия. Использование препаратов инсулина необходимо для максимально достижимой компенсации метаболических нарушений, предотвращения состояния гипергликемии. Инъекции являются жизненно необходимыми. Схема введения составляется индивидуально.
- Диета. Пациентам показана низкоуглеводная, в том числе кетогенная диета (кетоны служат источником энергии вместо глюкозы). Основу рациона составляют овощи, мясо, рыба, молочные продукты. В умеренных количествах допускаются источники сложных углеводов – цельнозерновой хлеб, крупы.
- Дозированные индивидуальные физические нагрузки. Физическая активность полезна большинству больных, не имеющих тяжелых осложнений. Занятия подбираются инструктором по ЛФК индивидуально, проводятся систематически. Специалист определяет продолжительность и интенсивность тренировок с учетом общего состояния здоровья пациента, уровня компенсации СД. Назначается регулярная ходьба, легкая атлетика, спортивные игры. Противопоказан силовой спорт, марафонский бег.
- Обучение самоконтролю. Успешность поддерживающего лечения при диабете во многом зависит от уровня мотивации больных. На специальных занятиях им рассказывают о механизмах болезни, о возможных способах компенсации, осложнениях, подчеркивают важность регулярного контроля количества сахара и применения инсулина. Больные осваивают навык самостоятельного выполнения инъекции, выбора продуктов питания, составления меню.
- Профилактика осложнений. Применяются лекарства, улучшающие ферментную функцию железистых клеток. К ним относятся средства, способствующие оксигенации тканей, иммуномодулирующие препараты. Проводится своевременное лечение инфекций, гемодиализ, антидот-терапия для выведения соединений, ускоряющих развитие патологии (тиазидов, кортикостероидов).
Среди экспериментальных методов лечения стоит отметить разработку ДНК-вакцины BHT-3021. У пациентов, получавших внутримышечные инъекции в течение 12 недель, повышался уровень C-пептида – маркера активности островковых клеток поджелудочной железы. Другое направление исследований – превращение стволовых клеток в железистые клетки, производящие инсулин. Проведенные опыты на крысах дали положительный результат, но для использования метода в клинической практике необходимы доказательства безопасности процедуры.
Прогноз и профилактика
Инсулинозависимая форма сахарного диабета является хроническим заболеванием, но правильная поддерживающая терапия позволяет сохранить высокое качество жизни больных. Профилактические меры до сих пор не разработаны, так как не выяснены точные причины болезни. В настоящее время всем людям из групп риска рекомендовано проходить ежегодные обследования для выявления заболевания на ранней стадии и своевременного начала лечения. Такая мера позволяет замедлить процесс формирования стойкой гипергликемии, минимизирует вероятность осложнений.
Источник
