Инсулин лантус при 2 типе сахарно диабета
Статьи
Опубликовано в журнале:
«Ремедиум», сентябрь 2010, с. 30-31
И.И. Кочергина, Е.В. Доскина, А.С. Аметов,
кафедра эндокринологии и диабетологии с курсом эндокринной хирургии РМАПО, г. Москва
Цель работы
Исследовать влияние сочетанной терапии инсулином Лантус и метаболическим препаратом Дибикор на состояние углеводного обмена у больных сахарным диабетом 2-го типа и достижение целевых показателей, обеспечивающие низкий риск развития ангиопатии.
Согласно Алгоритмам специализированной медицинской помощи больным сахарным диабетом (2007) и Рекомендациям European Diabetes Policy Group (1998-1999) составляют: HbA1c ≤ 6,5%, ГН ≤ 5,5-6,0 ммоль/л, ППГ 6,5%, ГН>6,0 и ППГ>7,5 ммоль/л возрастает риск развития макроангиопатии (атеросклероза), а при HbA1c>7,5%, ГН>7,0 и ППГ>9,0 ммоль/л возрастает риск развития микроангиопатии).
Обоснование
Для профилактики сосудистых диабетических осложнений важно не только непосредственное воздействие на углеводный обмен, но и компенсация его путём влияния на оксидативный стресс, играющий важную роль в патогенезе диабетических осложнений. Для этого был выбран препарат Дибикор (ООО «ПИК-ФАРМА), действующим началом которого является жизненно необходимая сульфоаминокислота – Таурин. Таурин является естественным метаболитом сульфокислот и обладает антиоксидантными, осморегулирующими, детоксикационными, мембраностабилизирующими, гиполипидемическими и сахароснижающими свойствами. Кроме того, являясь природным кальциевым антагонистом, таурин регулирует уровень внутриклеточного кальция, играющего важную роль в регуляции таких жизненно важных процессов, как секреция инсулина, поддержание сосудистого тонуса, сократимость миокарда, агрегация тромбоцитов и др.
Материал и методы
Под наблюдением находились 39 пациентов с сахарным диабетом 2 типа, 25 женщин и 14 мужчин, в возрасте от 45 до 68 лет, средний возраст 55,4±2,6 года, длительность СД 2 типа 8,4±2,1 года. Состояние углеводного обмена оценивали по уровню гликемии натощак (ГН), постпрандиальной (через 2 часа после еды) гликемии (ППГ) и интегральному показателю компенсации углеводного обмена за последние 3-4 месяца – уровню гликозилированного гемоглобина (HbA1c). Степень выраженности инсулинорезистентности (ИР) оценивали по индексу ИР – НОМА, уровень которого в норме Исходно пациенты получали Метформин (Сиофор) по 1000 мг 2 раза в сутки и были декомпенсированы по сахарному диабету: HbA1c составлял 9,8±0,4%, ГН – 10,4±0,8 ммоль/л, ППГ – 12,7±0,9 ммоль/л, индекс инсулинорезистентности HOMA 5,94±0,7. Пациенты были разделены на две группы: в I группе (20 пациентов) для компенсации СД 2 типа к проводимой терапии Сиофором 1000 мг 2 раза пациентам был добавлен аналог пролонгированного инсулина 24-29 часового действия Лантус из расчета 0,4 ед/кг 1 раз в сутки, а также отечественный препарат Дибикор. Дибикор назначили в дозе 1,0 г/сутки (0,5 г 2 раза) в день в течение 6 месяцев. Во II группе (19 пациентов, группа сравнения) к Сиофору 1000 мг 2 раза был добавлен Лантус 0,4 ед/кг 1 раз в сутки.
Результаты
В I группе через 3 месяца HbA1c снизился до 8,6±0,3% (-1,2%); ГН уменьшилась до 8,3±0,2 ммоль/л, ППГ – до 9,7±0,4 ммоль/л, индекс ИР-HOMA снизился до 5,0±0,6. Через 6 месяцев: HbA1c составил 7,6±0,2%, ГН – 7,4±0,2 ммоль/л, ППГ – 8,7±0,4 ммоль/л, индекс ИР-HOMA 3,7±0,6.
Во II группе через 3 месяца HbA1c снизился до 9,2±0,4%, ГН – до 9,1±0,3 ммоль/л, ППГ – до 9,8±0,4 ммоль/л, индекс ИР-HOMA 5,6±0,5. Через 6 месяцев: HbA1c был равен 8,7±0,4%, ГН – 8,3±0,2 ммоль/л, ППГ – 9,0±0,5 ммоль/л, индекс ИР-HOMA – 4,8±0,6.
Заключение
Как видно из полученных результатов, при отсутствии компенсации сахарного диабета 2-го типа, добавление к лечению Сиофором 1000 мг 2 раза в сутки аналога пролонгированного инсулина Лантуса 0,4 ед/кг 1 раз в сутки приводило к достоверному снижению HbA1c, ГН и ППГ в течение 6 месяцев, однако снижение индекса ИР-НОМА было статистически незначимо.
В группе пациентов, получавших дополнительно метаболический препарат Дибикор (таурин) 1,0 г в сутки наблюдалось достоверное снижение HbA1c, ГН и ППГ уже через 3 месяца терапии, а через 6 месяцев были достоверно снижены все показатели, включая и индекс инсулинорезистентности НОМА. Изменения при терапии Дибикором через 6 месяцев составили: уровень HbA1 снизился на 2,2% (без Дибикора – 1,1); ГН – на 3 ммоль/л (без Дибикора на – 2,1); ППГ – на 4 (без Дибикора на – 3,7) и индекс инсулинорезистентности на 2,24 (без Дибикора на – 1,14). Эти цифры безусловно свидетельствует о более успешной компенсации течения сахарного диабета за счёт включения в схему лечения препарата Дибикор. За время испытаний Дибикора не было замечено побочных эффектов.
Таблица. Динамика показателей углеводного обмена при лечении пациентов с СД типа 2. Терапия – Лантус и Лантус + Дибикор
| Показатели | До лечения для обеих групп | Лантус+дибикор | Лантус | Норма | ||
| Через 3 месяца | Через 6 месяцев | Через 3 месяца | Через 6 месяцев | |||
| HbA1, % | 9,8±0,4 | 8,6±0,3* | 7,6±0,2*** | 9,2±0,4% (НД) | 8,7±0,4** | 4-6 |
| ГН, ммоль/л | 10,4±0,8 | 8,3±0,2* | 7,4±0,2** | 9,1±0,3 (НД) | 8,3±0,2* | <6 |
| ППГ, ммоль/л | 12,7±0,9 | 9,7±0,4** | 8,7±0,4*** | 9,8±0,4** | 9,0±0,5** | <7,5 |
| ИР HOMA | 5,94±0,7 | 5,0±0,6 (НД) | 3,7±0,6* | 5,6±0,5 (НД) | 4,8±0,6 | <2,27 |
* – p
В связи с этим рекомендуется шире использовать препарат Дибикор (таурин) в лечении больных сахарным диабетом 2-го типа.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
Врач может назначить Вам одну или две инъекции продленного инсулина в сутки (утром и вечером).
Сколько инъекций (1 или 2) будет назначено, зависит от времени действия конкретного препарата инсулина (действует он сутки или меньше) и от инсулина, который вводится на еду.
Часто днем фон обеспечивается за счет «хвостов» пищевого инсулина, а длинный инсулин вводится только на ночь.
При схеме, при которой дневной фон поддерживается за счет пищевого инсулина, следует помнить, что если Вы будете пропускать прием пищи и не вводить короткий инсулин, то Вам днем не хватит фонового инсулина.
Потребность в базальном инсулине может меняться в течение суток. Но в целом, правильно подобранная доза базального инсулина в обычном режиме (без острых заболеваний и пр.) меняется редко. Не надо без причины каждый день изменять дозу базального инсулина. Регулировать колебания глюкозы крови в результате приема пищи надо коротким инсулином.
Доза базального инсулина адекватна, если глюкоза крови в пределах целевого уровня утром натощак, ночью и в период пропусков пищи.
Базальный ночной инсулин должен «держать» тот уровень глюкозы, который был перед сном. Т.е. если доза базального инсулина подобрана правильно, то с каким сахаром Вы легли спать, с таким и должны встать.
Какие существуют требования к базальным инсулинам?
Основное требование – отсутствие пика действия. Инсулин должен действовать максимально ровно. Иначе на пике действия возможны гипогликемии. Все генно-инженерные базальные инсулины (протамин, хумулин Н, базал, генсулин Н, протафан и др.) являются пиковыми (имеют пик действия) и это их существенный недостаток. Профиль действия этих инсулинов такой: начало – через 1-2 часа с момента подкожного введения; «пик» – 5-8 часов; общая продолжительность действия – 16-18 часов (изначально была заявлена 24 часа).
Аналоги сверхдлительного действия (лантус, гларгин, левемир, туджео, тресиба) являются беспиковыми инсулинами (инсулины «плоского» действия) и это их огромное преимущество.
Как правильно подобрать фоновый инсулин?
При диабете 2 типа часто инсулинотерапия начинается с инъекции инсулина на ночь («подколка»). При диабете 1 типа базальный инсулин также часто вводится 1 раз вечером.
Оценивать дозу вечернего базального инсулина необходимо по уровню глюкозы крови ночью и утром.
Ночью и утром уровень глюкозы крови находится в пределах целевого уровня, значит, доза инсулина подобрана правильно.
Часто на практике увеличение дозы ночного базального инсулина осуществляется по уровню глюкозы натощак. Если глюкоза крови утром выше целевых значений, просто увеличивается доза ночного инсулина. Это не совсем верный подход. Необходимо сначала разобраться, почему утром высокий уровень глюкозы.
Утренняя гипергликемия – одна из самых сложных проблем в лечении сахарного диабета.
Причиной высокого уровня гликемии утром могут быть:
- Высокий уровень гликемии перед сном.
- «Поздний ужин»: («медленная» еда вечером, которая «вылазит» ночью и «висит» всю ночь).
- Недостаток инсулина.
- Недостаточная продолжительность действия инсулина.
- Ночные гипогликемии.
- Феномен «утренней зари».
- «Ранний ужин» при СД 2.
- Рост уровня глюкозы после пробуждения («стресс пробуждения», феномен «ноги на пол»).
В этом перечне не перечислены такие технические причины, как неисправность шприц-ручки, загиб канюли, испорченный инсулин, введение в места липодистрофий и др.
Чтобы проверить дозу базального ночного инсулина, надо правильно поужинать. Ужин должен быть не позднее, чем за 4 часа до сна. Также ужин должен быть необильным и «легким». При проверке базы на ужин нельзя есть макароны, гречку, перловку, сложные продукты (пельмени, блины, плов и пр.), творог и продукты из него (сырники, запеканка и др.), жирные продукты. Можно: пшенную кашу, геркулес, отварную картошку, отварные и свежие овощи, отварное мясо, отварная рыба, хлеб. Смысл раннего ужина: если поужинать поздно и соответственно поздно ввести короткий инсулин, то действие короткого инсулина наслоится на действие базального инсулина и нельзя будет правильно оценить дозу базального инсулина. Смысл «легкого» ужина: продукты должны усвоиться организмом до того, как человек ляжет спать, т.е. еда должна быть «быстрой». Если поужинать «медленной» едой, она «вылезет» ночью и всю ночь будет повышать уровень глюкозы крови.
Следующий момент – замеры глюкозы. Если нет мониторинга, замеры надо делать как минимум 5 раз: перед сном; в 00.00; в 03.00; в 06.00 и перед завтраком. Для этого заводится будильник (или спящему пациенту измеряет другой человек). Еще лучше измерять каждые 2 часа. Желательно (многие считают, что обязательно) такую проверку проводить не одну ночь, а три ночи, что исключить случайные колебания. Если четко вырисовывается проблемный участок, на нем надо провести замеры каждый час.
Какие возможны варианты
1) Глюкоза ночью и утром в пределах целевого уровня – оптимальная доза базального инсулина.
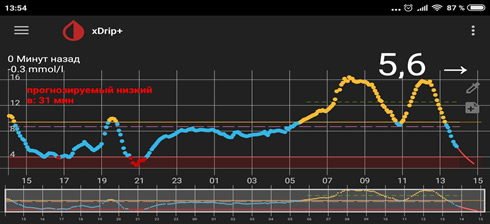
2) Линейный рост – нехватка базального инсулина (мало инсулина).
На мониторинге мы видим, что глюкоза крови с 01.00 непрерывно растет, значит надо увеличивать дозу базального инсулина. Но, если на ужин ели «тяжелую» пищу (пельмени, макароны, много мяса и др.), то это может «вылезать» еда!
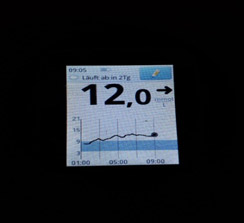
3) Рост глюкозы крови начинается ближе к утру и растет постепенно – недостаточная продолжительность действия инсулина (инсулин «не тянет» до утра).
Что можно сделать в таком случае:
а) сместить время инъекции на более позднее время;
б) попробовать увеличить дозу инсулина – если нет тенденции к низкому уровню глюкозы;
в) вводить инсулин в более «медленное» место (ногу);
г) заменить инсулин на аналог.
4) Низкий уровень глюкозы ночью, а утром высокий. Такая ситуация говорит об избытке базального инсулина.
Если доза базального инсулина избыточна, то ночью может быть низкий уровень глюкозы крови, на что организм реагирует выбросом гликогена из печени и уровень глюкозы крови растет (так называемый «откат»). Гипогликемия чаще возникает на пике действия инсулина длительного действия (если вводится «пиковый» инсулин). Гипогликемию человек может и не почувствовать. Может быть просто приступ потливости (человек просыпается весь мокрый), человеку могут сниться кошмары, а также могут возникнуть другие неспецифические симптомы. Гипогликемия может длиться несколько минут и ее можно не «поймать» при измерении глюкозы (иногда даже на мониторинге). Вместо гипогликемии фиксируются высокий уровень глюкозы и увеличивается доза инсулина. Но вместо снижения глюкозы крови получаем еще больший рост. Такая ситуация часто встречается при введении «пиковых» инсулинов. Это синдром Сомоджи – синдром передозировки инсулина.
5) Резкий рост глюкозы под утро – «утренняя заря».
В такой ситуации мы видим, что ночью глюкоза находится в целевом диапазоне, но с 4-5 утра начинается резкий рост. Борьба с «зарей» непроста. Если человек на помпе, на это время выставляется большая доза введения инсулина. Если нет, «зарю» надо «скалывать» коротким инсулином. И часто «скалывать» надо на предупреждение (т.е. путем мониторинга или частых замеров четко определяется, в какое время начинается заря, и короткий инсулин вводится до этого времени, т.к. когда «заря» развернулась, «сколоть» ее непросто).
6) Рост уровня глюкозы после пробуждения («стресс пробуждения», феномен «ноги на пол»).

Ситуация похожа с «утренней зарей», но возникает после того как человек проснулся. Т.е. человек проснулся с нормальным уровнем глюкозы крови, получает базальный инсулин суточного действия, не завтракает и не вводит инсулин короткого действия. Казалось бы, глюкоза крови не должна расти (еды нет, базальный инсулин есть). Однако нередко, чем дольше не ест человек, тем больше растет глюкоза и плохо «скалывается» коротким инсулином. Это печень начинает Вас «кормить», раз не хотите есть сами. В такой ситуации надо ввести привычку завтракать вскоре после пробуждения.
В целом, ситуации с утренней зарей, передозировкой или нехваткой инсулина бывает очень сложно дифференцировать.
Проверка базального инсулина в течение дня осуществляется пропуском пищи. Чтобы оценить базу с утра до обеда, утром не вводится короткий инсулин, до обеда ничего не есть, измерять глюкозу каждый час. Чтобы оценить участок с обеда до ужина, между завтраком и ужином должно пройти не менее 4 часов, в обед не вводится короткий инсулин, пропускается обед, измеряется глюкоза каждый час. Аналогично – участок от ужина до сна. На протяжении всего проверяемого периода не должно быть перекусов, введения дополнительных доз инсулина.
Способ проверки базы пропуском еды не подходит, если дневной фон обеспечивается за счет «хвостов» короткого инсулина (т.е. инсулин длительного действия с продолжительностью действия менее 12 часов вводится 1 раз в сутки на ночь). Проверка базы должна в отсутствие физической активности, острых заболеваний, стрессов. Нельзя проверять базу после перенесенной гипогликемии.
Источник
Применение инсулина гларгина (Лантус)
в лечении сахарного диабета (опыт
эндокринологической службы Москвы)
Лантус (инсулин гларгин) – уникальный препарат инсулина длительного действия. Уровень инсулина гларгина в крови после однократной инъекции сохраняется на приблизительно постоянном уровне на протяжении суток, а это имитирует физиологическую базальную секрецию инсулина. Лантус с успехом используется не только в терапии сахарного диабета типа 1, но и в терапии сахарного диабета типа 2 в сочетании с пероральными сахаропонижающими средствами. Многочисленные многоцентровые клинические испытания и исследование, недавно проведенное московскими эндокринологами, показали, что Лантус помогает добиться жесткого контроля уровня глюкозы – главной цели лечения сахарного диабета и профилактики его осложнений.
Введение
Клинические исследования Diabetes Control and Complication Study (DCCT) при сахарном диабете (СД) типа 1 и United Kingdom Prospective Diabetes Study (UKPDS) и Kumamoto Study при СД типа 2 четко доказали необходимость жесткого контроля уровня глюкозы для профилактики осложнений СД. Так, в исследовании DCCT снижение HbA1c с 9 до 7 % привело к уменьшению риска ретинопатии на 63 %, нефропатии – на 54 %, нейропатии – на 60 %. В исследовании UKPDS было показано, что снижение HbA1c с 7,9 до 7 % ведет к уменьшению риска ретинопатии на 21 %, а нефропатии – на 34 %. Таким образом, на сегодняшний день, согласно рекомендациям Американской диабетической ассоциации (АДА), терапевтическая цель для больных СД типа 1 и типа 2 – снижение HbA1c до уровня ниже 7,0 %. Более жесткие цели предложены European Diabetes Policy Group (1998) для больных СД типа 1: HbA1c – в пределах 6,1-7,5 %, уровень глюкозы натощак – 5,1-6,5 ммоль/л, через 2 часа после еды – 7,6-9 ммоль/л и перед сном – 6-7,5 ммоль/л; для больных СД типа 2: HbA1c – ниже 6,5 %, уровень глюкозы натощак – не выше 5,5 ммоль/л, через 2 часа после еды – ниже 7,5 ммоль/л.
Однако, несмотря на очевидную необходимость жесткого контроля гликемии для профилактики поздних осложнений СД, в реальной жизни больные имеют уровень HbA1c гораздо выше рекомендованного не только European Diabetes Policy Group, но и АДА, т. е. находятся в состоянии хронической суб- и декомпенсации углеводного обмена.
При СД типа 1, требующем пожизненной инсулинотерапии, такая ситуация связана с объективными сложностями имитации физиологической секреции инсулина. Это обусловлено несовершенством имеющихся в арсенале эндокринологов препаратов инсулина (например, наличием нескольких пиков активности у инсулинов средней длительности действия (NPH); более продолжительным, чем необходимо, периодом активности инсулинов короткого действия).
При СД типа 2 приходится постоянно повышать дозы пероральных сахаропонижающих средств (ПСПС) с целью контроля гликемии. Это обусловлено естественным течением СД типа 2, когда нарушение секреции инсулина бета-клетками начинается задолго до постановки диагноза. В дальнейшем скорость снижения секреции инсулина составляет примерно 5 % в год. Таким образом, переход на инсулинотерапию при СД типа 2 с целью компенсации функции бета-клеток является логичным терапевтическим подходом для достижения оптимального контроля гликемии [6].
Одним из способов улучшения контроля гликемии является создание и внедрение новых препаратов инсулина, обладающих улучшенными фармакокинетическими и фармакодинамическими свойствами. В настоящее время в повседневную клиническую практику вошел аналог инсулина длительного действия – инсулин гларгин (Лантус, Санофи-Авентис, Франция).
Физико-химическая характеристика инсулина гларгина
На сегодняшний день инсулин гларгин (21А-Gly-30Bа-L-Ar гамма-30Bb-L-Arg-инсулин) является единственным инсулином длительного действия, при однократном введении которого обеспечивается контроль базальной гликемии в течение 24 часов [2]. Инсулин гларгин производится генно-инженерным методом; в качестве продуцента используют непатогенный лабораторный штамм E. coli K12. В молекуле инсулина гларгина в 21 положении А-цепи Asn заменен на Gly, а к С-концу В-цепи в положения 31 и 32 добавлены 2 остатка Arg (рис. 1).
Эти модификации позволили сместить изоэлектрическую точку молекулы с рН 5,4 до 6,7. Благодаря этому уменьшилась растворимость препарата при физиологических значениях рН, т. е. в нейтральной среде подкожной клетчатки. При этом инсулин гларгин хорошо растворим во флаконе при рН 4. Поскольку препарат во флаконе имеет кислый рН, его нельзя смешивать с инсулинами, имеющими нейтральный рН, например с инсулинами короткого действия. В то же время растворимая (прозрачная) форма препарата не требует встряхивания непосредственно перед введением, в отличие от ситуации с инсулинами NPH и инсулинами длительного действия (Ultralente), когда неправильное перемешивание ведет к значительной вариабельности действия. После подкожного введения препарат вступает в реакцию нейтрализации с образованием микропреципитатов, из которых в дальнейшем происходит высвобождение гексамеров инсулина гларгина и их диссоциация с образованием димеров и мономеров (рис. 2).
Фармакологическая характеристика Лантуса
В нескольких исследованиях сравнивали фармакокинетику и фармакодинамику Лантуса, инсулина NPH и инсулина Ultralente [2, 3]. В этих исследованиях применяли эугликемический клэмп-тест либо использовали меченные радиоактивным йодом препараты инсулина и гамма-счетчики, позволяющие регистрировать время до уменьшения радиоактивности на 25 % (T75 %) после подкожного введения препаратов (отражает всасывание из подкожной клетчатки) и остаточную радиоактивность через 24 часа после введения. Исследования проводили как на здоровых добровольцах, так и больных СД типа 1 и 2. Результаты показали, что действие Лантуса начинается медленнее и является более плавным и длительным, чем действие инсулинов NPH и Ultralente (рис. 3).
Благодаря уникальной фармакодинамике однократное введение Лантуса позволяет на протяжении 24 часов максимально имитировать физиологическую базальную секрецию инсулина, что значительно снижает риск гипогликемии и вариабельность концентрации глюкозы (в сравнении с инсулинами NPH и Ultralente). Кроме того, Лантус обеспечивает базальный контроль гликемии в течение 24 часов после однократной инъекции независимо от времени введения. Это делает его применение не только эффективным, но и удобным для больных, улучшая качество их жизни и облегчая проведение инсулинотерапии как для врача, так и для больного. В настоящее время завершены многоцентровые испытания, подтвердившие эффективность и безопасность Лантуса как у больных СД типа 1 [4], так и у больных СД типа 2 [1, 7-10].
Лантус вводят подкожно один раз в сутки (утром или перед сном) и применяют у взрослых и детей старше 6 лет с СД типа 1 и взрослых больных СД типа 2. Лантус зарегистрирован FDA в апреле 2000 г. и Европейским Aгентством по Экспертизе Лекарственных средств (EMEA) в июне 2000 г. В России Лантус зарегистрирован в 2003 г.
Возможности клинического применения Лантуса
Эффективность и безопасность комбинации Лантуса с ПСПС у больных СД типа 2, декомпенсированных на монотерапии ПСПС, была подтверждена в 24-недельном исследовании Treat-to-Target [5], в котором участвовали 756 больных, не получавших ранее инсулин. Показано, что точный подбор дозы Лантуса на фоне терапии ПСПС улучшает контроль гликемии (в конце исследования средний уровень HbA11c составил 6,96 %). Кроме того, вариабельность уровня глюкозы и частота ночных гипогликемий были ниже в группе, получавшей в качестве базального инсулина Лантус, а не инсулин NPH.
Целью исследования Porcellati и соавт. было сравнение влияния Лантуса и инсулина NPH на уровень глюкозы и реакции на гипогликемию у больных СД типа 1. В исследование включили 121 больного СД типа 1, получавшего интенсивную инсулинотерапию (инсулин NPH 4 раза в день и Лизпро-инсулин перед каждым приемом пищи). Больные продолжали лечение инсулином NPH 4 раза в день (n = 60) или получали Лантус 1 раз в день перед ужином (n = 61) в течение года. У 11 больных в каждой группе оценивали реакцию на гипогликемию, вызванную гиперинсулинемией, до и через год после начала лечения. Результаты показали, что среднесуточный уровень глюкозы при лечении Лантусом был ниже, чем при лечении инсулином NPH (соответственно 7,6 ± 0,11 и 8,1 ± 0,22 ммоль/л; p < 0,05). Содержание HbA1c через 4 месяца не изменилось в группе инсулина NPH и снизилось в группе Лантуса с 7,1 ± 0,1 до 6,7 ± 0,1 %. Через 12 месяцев уровень HbA1c оставался ниже в группе Лантуса (6,6 ± 0,1 %; p < 0,05) по сравнению с группой инсулина NPH. Частота легкой гипогликемии (уровень глюкозы в крови не выше 4 ммоль/л) при лечении Лантусом была ниже, чем при лечении инсулином NPH (соответственно 7,2 ± 0,5 и 13,2 ± 0,6 эпизодов на больного в месяц; p < 0,05). Через год терапия инсулином NPH не привела к изменению реакции на гипогликемию, в то время как в группе Лантуса пороговый и максимальный ответы на гипогликемию (уровень адреналина в плазме и симптомы) улучшились (p < 0,05). Таким образом, более простая схема инсулинотерапии с использованием Лантуса привела к снижению уровня HbA1c и частоты гипогликемий и улучшению реакции на гипогликемию. Исследование показало, что Лантус лучше подходит для интенсивной терапии СД типа 1, чем инсулин NPH.
В исследовании INSIGHT (Implementing New Strategies with Insulin Glargine for Hyperglycemia Therapy), результаты которого были доложены на сессии АДА в июне 2005 г., участвовали 405 больных СД типа 2. В течение 6 месяцев пациенты получали либо Лантус 1 раз в день в дополнение к ПСПС без повышения их дозы, либо оптимизированную терапию ПСПС без инсулина. Результаты показали, что раннее добавление Лантуса к текущей антидиабетической терапии эффективнее в плане снижения HbA1c, чем оптимизация пероральной терапии при сравнимой частоте гипогликемий [12].
Исследование LANMET показало эффективность и безопасность добавления Лантуса к метформину у больных СД типа 2 и избыточным весом или ожирением [11]. Кроме того, была продемонстрирована возможность успешного вовлечения пациентов в процесс лечения заболевания и подбора эффективной дозы инсулина.
Исследование ATLANTUS (A Trial comparing Lantus® Algorithms to achieve Normal blood glucose Targets in patients with Uncontrolled blood Sugar), в котором приняли участие около 5000 больных СД типа 2 из 59 стран мира, проводилось в Великобритании. Было показано, что простой алгоритм подбора дозы Лантуса значительно улучшает контроль уровня глюкозы при низком риске тяжелой гипогликемии [13]. Кроме того, было получено подтверждение возможности начала терапии Лантусом как при лечении у эндокринолога, так и в условиях общей практики. Частота тяжелой ночной гипогликемии была сравнима у больных, получающих помощь в условиях общей практики у врачей-терапевтов и в специализированных эндокринологических учреждениях.
Результаты основополагающих исследований по лечению СД показали, что снижение уровня HbA1c уменьшает риск микро- и макрососудистых осложнений. Более чем у половины больных СД типа 2, неспособных достичь целевого контроля гликемии, добавление Лантуса к терапии ПСПС является действенным способом улучшения контроля гликемии [5].
Опыт применения Лантуса московскими эндокринологами
Традиционно одним из первых регионов, где начал применяться новый инсулин, стала Москва. В многоцентровом открытом 12-недельном исследовании, которое проводилось в 22 поликлиниках и стационарах города, приняли участие 574 больных СД.
Основными целями исследования были:
- оценка эффективности Лантуса в достижении адекватного контроля гликемии (HbA1c ниже 7 %, уровень глюкозы натощак ниже 5,5 ммоль/л) у больных СД типа 1 и типа 2, не компенсированных на предшествующей терапии ПСПС;
- накопление врачами опыта применения Лантуса в лечении больных СД типов 1 и 2 с использованием удобного алгоритма перевода на данный препарат и подбора его доз.
Рекомендованная начальная доза Лантуса для больных СД типа 1, которые ранее получали инсулин NPH
1 раз в день, была эквивалентна дозе инсулина NPH. Если больные СД типа 1 получали более одной инъекции инсулина NPH в сутки, то при назначении Лантуса суточную дозу инсулина NPH рекомендовали снижать на 20-30 %.
Рекомендованная начальная доза Лантуса при добавлении к ПСПС у больных СД типа 2, ранее никогда не получавших инсулин, составляла 10 МЕ. Пациентов, которые получали инсулин NPH 1 раз в день, было рекомендовано переводить на Лантус в той же дозе. Если больные получали более 1 инъекции инсулина NPH в сутки, то при назначении Лантуса суточную дозу инсулина NPH рекомендовали снижать на 20-30 %.
Как у больных СД типа 1, так и у больных СД типа 2 дозу Лантуса корректировали индивидуально, 1 раз в неделю, с учетом результатов самоконтроля уровня глюкозы натощак, добиваясь ее снижения до значений не выше 5,5 ммоль/л.
Анализ полученных данных показал, что применение Лантуса в качестве базального инсулина у больных СД типа 1 снижает средний уровень HbA1c более чем на 2 % в течение 12 недель, причем целевой уровень HbA1c (ниже 7 %) был достигнут практически у половины больных. Не менее значимым представляется отсутствие изменения соотношения болюсного/базального инсулинов до включения в исследование и через 12 недель. Необходимо подчеркнуть, что удовлетворенность терапией и желание продолжать лечение Лантусом выразили 99 % больных.
Через год от начала терапии Лантусом средний уровень HbA1c снизился на 2,5 %, а целевой уровень HbA1c (ниже 7 %) был достигнут у 62 % больных (рис. 4).
Результаты исследования продемонстрировали высокую эффективность применения Лантуса при СД типа 2. В течение 12 недель средний уровень HbA1c снизился с 9,9 до 7,8 %, а уровень глюкозы натощак – с 11,3 до 6,3 ммоль/л. Целевое значение HbA1c было достигнуто у 40 % больных, доля больных с уровнем HbA1c 7-8 % увеличилась с 2 до 29 %, а доля больных с уровнем HbA1c выше 8 % снизилась с 94 до 31 % (рис. 5). Положительный ответ на вопросы об удовлетворенности лечением и желании продолжать терапию Лантусом дали 98 % больных с СД типа 2.
В группе из 77 больных СД типа 2, наблюдавшихся в течение года, средний уровень HbA1c снизился до 7,2 %, причем целевой уровень HbA1c (ниже 7 %) был достигнут у 64 % больных, доля больных с уровнем HbA1c 7-8 % увеличилась с 14 до 22 %, а доля пациентов с уровнем HbA1c выше 8 % снизилась с 81 до 14 % (рис. 6).
Анализ эффективности Лантуса в подгруппах больных СД типа 2 показал, что независимо от вида исходной терапии ее интенсификация за счет добавления Лантуса позволила улучшить контроль гликемии во всех подгруппах (рис. 7).
Необходимо подчеркнуть, что данное исследование проводилось в обычных поликлиниках и стационарах Москвы и в нем принимали участие типичные больные, которые на момент включения в исследование находились в состоянии суб- и декомпенсации СД. Перевод на Лантус и дальнейшее наблюдение осуществлялись теми же врачами, которые вели больных ранее. Участие в исследовании помогло врачам приобрести опыт применения Лантуса, достаточно просто и безопасно начинать инсулинотерапию у больных СД типа 2. Кроме этого, в результате данной работы врачи имели возможность оценить удобство и эффективность предложенного алгоритма подбора дозы Лантуса.
Заключение
Применение Лантуса в качестве базального инсулина позволяет значительно улучшить контроль гликемии у больных СД типа 1 и СД типа 2 не только при кратковременном, но и при длительном лечении. Полученные московскими эндокринологами данные согласуются с результатами международных клинических исследований.
- Fritsche, et al. Glimepiride combined with morning insulin glargine, bed NPH insulin, or bed insulin glargine in patients with type 2 diabetes mellitus. A randomized control trial. Ann Intern Med 2003,138:952-59.
- Lepore M, Pampanelli S, Bolli G. Diabetes 2000;49:2142-48.
- Owens DR, et al. Pharmacokinetics of 1251-labeled insulin glargine in healthy men: comparison witn NPH insulin and the influence of different subcutaneous injection sites. Diabetes Care 2000;23:813-19.
- Raskin P, Klaff L, et al. Diabetes Care 2000;23: 1666-71.
- Riddle MC, et al. The Treat-To-Target Trial. Diabetes Care 2003;26:3080-86.
- Wright A, et al. Sulfonylurea inadequacy: efficacy of addition of insulin over 6 years in patients with type 2 diabetes mellitus in the U.K. Prospective Diabetes Study (UKPDS 57). Diabetes Care 2002;25:330-36.
- Yki-Jarvinen H. Combination therapy with insulin and oral agents. Optimizing glycemic control in patients with type 2 diabetes mellitus. Diabetes Met Res Rev 2002;18(suppl. 3):S77-81.
- Yki-Jarvinen H. Combination therapy with insulin in type 2 diabetes. Diabetes Care 2001;24: 758-67.
- Yki-Jarvinen H. Insulin therapy in type 2 diabetes: role of the long acting insulin glargin analogue. Eur J Clin Invest 2004;34(6):410-16.
- Yki-Jarvinen H, et al. Less nocturnal hypoglycemia and better post-dinner glucose control with bed insulin glargin compared with bed NPH insulin during combination insulin therapy in type 2 diabetes. HOE 901/3002 Study Group, Diabetes Care 2000;23:1130-36.
- Yki-Jarvinen H. Diabetes Care 2001;24(4): 758-67.
- Gerstein HC, Yale J-F, Harris SB, et al. A Randomized Trial of Early Glargine Use to Achieve Optimal A1c Levels in Insulin Na_ve People with Type 2 Diabetes. Presented at the 65th Annual Scientific Sessions of the American Diabetes Association, San Diego, California, USA 2005.
- DDavies M, Evans R, Storms F, et al. Initiation of Insulin Glargine in Sub-optimally Controlled Patients with Type 2 Diabetes: Sub-analysis of the AT.LANTUS Trial comparing Impact of Primary Care vs Secondary Care on Treatment Outcome in the UK. Presented at the 65th Annual Scientific Sessions of the American Diabetes Association, San Diego, California, USA, 2005.
- Storms F, Shutler S, Rodriguez J, et al. The AT.LANTUS Trial investigating treatment algorithms for insulin glargine (LANTUS®) therapy: Results in patients with type 1 and type 2 diabetes. Presented at 40th Annual Meeting of the European Association for the Study of Diabetes in Munich, Germany.
Источник
