Новые исследования сахарного диабета 1 типа
Главная » 1-med-fact, лучшее, самое-самое
⇐ ⇒
Сахарный диабет — одна из самых прогрессирующих болезней человечества. Введение инсулина для человека с сахарным диабетом 1 типа пока ничем не заменимая процедура. Но благодаря новым методам лечения, возможно, в скором времени удастся освободить людей из плена этой тяжелой болезни.
Новейшие исследования показали, что введение минимального числа заключенных в микрокапсулы клеток поджелудочной железы нормализовало уровень глюкозы в крови подопытных животных на 17 недель и более. Сахарный диабет без инсулина (без его самостоятельного введения) становится достижимой реальностью.
Число людей, живущих с сахарным диабетом, уже 425 миллионов. К 2045 году таких людей в мире станет более 630 миллионов.
Если человек с сахарным диабетом не борется с ним — не следит за состоянием уровня глюкозы в крови, не соблюдает диету и норму физической нагрузки, не использует необходимые лекарства, а при необходимости — инсулин, то его ждут крайне тяжелые осложнения, лишение нормального образа жизни и ранняя смерть.
Наиболее тяжелая форма болезни — сахарный диабет 1 типа. В этом случае у человека погибают бета-клетки в его поджелудочной железе и его организм теряет возможность производить собственный гормон инсулин. Без инсулина клетки организма не в состоянии нормально существовать, в частности, получать глюкозу из крови — в результате человек погибает.
Сахарный диабет I типа составляет до 10% всех случаев диабета.
Среди детей наиболее распространенным является именно сахарный диабет 1 типа. Всего на данный момент им страдают более 1 миллиона детей по всему миру.
Единственным опробованным, массовым и надежным способом жизни с сахарным диабетом 1 типа на сегодняшний день является инсулинотерапия. Только постоянный мониторинг уровня сахара в крови (с помощью глюкометра или систем постоянного мониторинга, вроде Freestyle Libre или Dexcom ), постоянные инъекции инсулина с помощью шприц-ручек или инсулиновых помп и учет съеденного — дают шанс человеку на полноценную жизнь.
Если человек с сахарным диабетом успешно осуществляет самоконтроль и ему удается проводить успешную инсулинотерапию, то его качество жизни ничем не отличается от обычной, и он сможет реализоваться наравне со всеми — чему свидетельствуют многие очень успешные люди — политики, ученые, спортсмены и актеры с сахарным диабетом.
.
Однако инсулинотерапия не восстанавливает физиологическую саморегуляцию, требует постоянных усилий со стороны человека и его близких и сохраняет постоянный риск опасных состояний — гипогликемии и сопутствующих сахарному диабету осложнений.
Уже несколько десятилетий ведется поиск альтернативных решений проблемы сахарного диабета 1 типа. Одно из них — создание «искусственной поджелудочной железы», которая самостоятельно контролирует уровень сахара в крови и вводит необходимые дозы инсулина (1,2).
Второй путь — пересадка донорской поджелудочной железы или её фрагментов; пересадка островков поджелудочной железы (с бета-клетками) от человека или животных а также попытки искусственного выращивания инсулин-продуцирующих клеток из стволовых клеток для их последующего ввода в организм.
Но этот путь до сих пор сталкивался с существенными сложностями. Пересадки от человека — из-за крайне малого числа донорского материала по сравнению с требуемым, высокой стоимости и большого числа иммунных реакций организма на пересажанный материал.
Пересадки островков поджелудочной железы от животных также сталкиваются с большим числом трудностей. Главные из которых: нефункционирование должным образом пересаженных клеток, иммунный ответ организма и опасность заражения человека (и человеческой популяции в целом) болезнями животных-доноров.
В частности, чтобы сохранить эффективность пересаженных клеток, человеку приходится принимать сильные иммуннодепрессанты, тем самым существенно снижая собственную защитную систему и подвергая свою жизнь большому риску.
Крайне недостаточное число материала для пересадки от человека (донорами могут быть только погибшие люди) и серьезная (к счастью, пока гипотетическая) опасность заразить человечество зооинфекцией в случае пересадки клеток от животных стимулируют разработку технологий создания тканеинженерных конструкций, замещающих работу островков поджелудочной железы. Клетки, которые должны выполнять функцию погибших бета-клеток человека, либо выделяются из донорского материала, либо выращиваются из различного типа стволовых клеток и «закрепляются» в специальных биокаркасах.
К сожалению, попытки выращивания работающих островковых клеток из различного типа стволовых клеток пока не привели к тому уровню успешности, когда полученные клетки можно было бы использовать для лечения сахарного диабета. Биоинженерные же работы с клетками доноров вполне успешны.
Например, решением части проблем клеточной трансплантации является технология заключения островков поджелудочной железы в микрокапсулы, которые и вводятся больному сахарным диабетом 1 типа. Технология микрокапсулирования помогает изолировать клетки островков поджелудочной железы доноров от иммунной системы пациента. При этом сами клетки должны как можно дольше сохранять жизнедеятельность (осуществлять свободный обмен питательными веществами и кислородом) и эффективно выполнять свою основную функцию — производить инсулин в ответ на повышение уровня глюкозы в крови.
Современные технологии позволяют производить такие микрокапсулы из биосовместимых и нетоксичных материалов. Различные группы ученых во многих странах пытаются усовершенствовать данный метод.
Одна из недавно решенных задач – это уменьшение числа вводимых микрокапсул. Дело в том, что ранее, в процессе микрокапсулирования островков поджелудочной железы, большая часть микрокапсул оставалась пустыми. Из-за этого значительно увеличился объем имплантируемого материала, что сильно увеличивало иммунную реакцию после имплантации.
Для разделения микрокапсул использовались магнитные наночастицы и созданный с помощью 3D-печати чип с микроканалами, который и разделял полученные ранее микрокапсулы на пустые и те, в которых находились островки поджелудочной железы. В результате общий объем имплантата снизился почти на 80%.
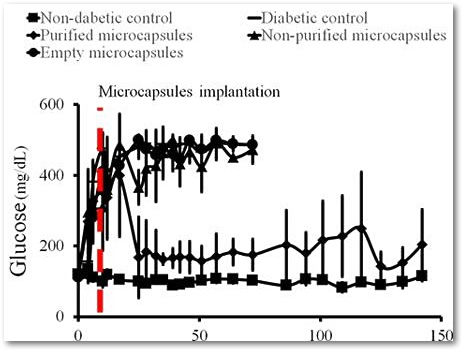
Очищенные имплантаты вводились подкожно крысам с сахарным диабетом 1 типа — в результате в течение более 17 недель уровень глюкозы в крови животных восстанавливался до нормогликемии (<200 мг / дл).
Уровень глюкозы в крови у подопытных крыс. Вверху: графики животных с введенными пустыми микрокапсулами (большие точки); с несортированными микрокапсулами (треугольники). Внизу: график животных с отобранными микрокапсулами (маленькие точки) и контрольный график уровня глюкозы у животных без сахарного диабета (квадраты).
Этот и подобные эксперименты дарят надежду миллионам больным сахарным диабетом на то, что в скором времени удастся совершить прорыв лечении одной из самых массовых болезней человечества.
Пока же больные сахарным диабетом 1 типа должны особо тщательно соблюдать процедуры инсулинотерапии, чтобы сохранить своё здоровье до массового внедрения новых технологий.
Поделиться информацией из статьи:
.
ТЕМЫ: Биология Здоровье Медицина Человек Болезни Диета Продолжительность жизни Сахарный диабет
ЧИТАЙТЕ ТАКЖЕ:
Источник
Сахарный диабет – заболевание, приводящее к пожизненным инъекциям инсулина, инвалидности и фатальным осложнениям. Ученые из Приволжского исследовательского медицинского университета (ПИМУ) приступили к разработке принципиально нового метода лечения этого недуга.
Чтобы понять механизм технологии, нужно сказать о том, как работает поджелудочная железа, отчего возникает диабет. В этом органе есть так называемые бета-клетки, объединенные в островки, которые автоматически продуцируют инсулин в ответ на повышение уровня глюкозы в крови. При ряде аутоиммунных или хронических болезней общая их масса снижается, появляются функциональные нарушения в виде недостаточной выработки инсулина. Результат – повышение уровня глюкозы в сыворотке крови.
– Это инсулинопотребный сахарный диабет. Он возникает, если число островков уменьшилось на 80 процентов, – рассказывает заведующий кафедрой факультетской хирургии и трансплантологии, главный внештатный трансплантолог минздрава Нижегородской области Владимир Загайнов.
Ученый подчеркивает, что метод лечения диабета только один – трансплантация поджелудочной железы. Потребность в этой операции в России удовлетворяется на тысячные доли процента, что связано с дефицитом донорских органов. Во всех остальных случаях речь идет о компенсации заболевания с помощью инсулина. Однако даже пересадка сопряжена с необходимостью иммуносупрессивной терапии, чтобы организм пациента не отторгал донорский орган. А у нее есть свои минусы, особенно в отдаленном периоде.
Главная идея проекта – пересадка не всей поджелудочной железы, а только островков, состоящих из тех самых бета-клеток.
– Островки будут выделяться из донорской железы специальным способом. Даже если целая железа не годится для трансплантации, из нее можно попытаться выделить островки и пересадить их, – поясняет Владимир Загайнов.
В мире эту идею пытаются реализовать разными способами и с разной степенью успешности. Введение островков от донора требует все той же небезопасной иммуносупрессивной терапии. В ПИМУ ученые разрабатывают вариант пересадки клеток, заключенных в специальные пористые капсулы. В теории клетки приживаются и начинают вырабатывать инсулин. Человек излечивается от диабета. А поры капсулы достаточно малы, чтобы предотвратить атаку иммунных клеток организма, поэтому никакой иммуносупрессивной терапии не требуется. Важно, что речь идет о малоинвазивных операциях, а не о сложной трансплантации. Возможных вариантов несколько: введение в брюшную полость путем пункции либо введение в печень по воротной вене.
Первые эксперименты ученых из НИИ экспериментальной онкологии и биомедицинских технологий ПИМУ вместе с Институтом металлоорганической химии РАН оказались успешными.
– В отдаленной перспективе планируем проработать выращивание бета-клеток из стволовых, – говорит Владимир Загайнов. – Параллельно вместе с коллегами из Национального медицинского исследовательского центра трансплантологии и искусственных органов имени Шумакова занимаемся легитимизацией технологии. Раньше в России за это никто не брался, поэтому трансплантация островков бета-клеток поджелудочной пока не вошла в список разрешенных, хотя в мире это уже существует. Надеемся, что в ближайшее время вопрос будет решен.
Планируем проработать выращивание бета-клеток из стволовых
В 2022 году проект, выполняемый по госзаданию Минздрава России, завершится. Можно будет испытывать метод на животных, а затем заниматься регистрацией. На мой вопрос, когда лечение будет доступно российским пациентам, профессор Загайнов ответил кратко:
– Деклараций в жизни хватает, давайте заниматься делом.
Комментарий
Ольга Занозина, доктор медицинских наук, заведующая отделением эндокринологии Нижегородской областной больницы имени Семашко:
– Наряду с совершенствованием самих инсулинов, способов их введения в организм пациента, улучшением терапевтического обучения больных сахарным диабетом развивается и другое направление – трансплантационные технологии, позволяющие вводить бета-клетки островков поджелудочной железы, которые вырабатывают инсулин, в организм больного человека.
Положительный эффект достигается при виртуозном заборе, хранении и введении островковых клеток больному человеку. При успешном результате – почти полный контроль за гликемией, отсутствие гипогликемий и потребности в экзогенном инсулине. Вся эта работа требует ювелирного мастерства.
Источник
На 80-й сессии ежегодного конгресса Американской диабетической ассоциации (ADA 2020) представили результаты недавних исследований по диабетологии. В частности, были освещены такие темы, как распространенность диастолической дисфункции среди молодых людей с диабетом в США, сравнение эффективности ингибиторов SGLT2 и агонистов рецепторов ГПП-1 для пациентов с диабетом и потенциал высокочастотной стимуляции спинного мозга для облегчения боли при диабетической нейропатии.
В США среди молодых людей с диабетом распространена диастолическая дисфункция
Согласно мнению экспертов из Медицинского центра детской больницы Цинциннати (Cincinnati Children’s Hospital Medical Center), в США практически половина подростков и молодых людей с сахарным диабетом 1-го типа (СД1) или сахарным диабетом 2-го типа (СД2) имеют диастолическую дисфункцию, являющуюся прямым предшественником сердечной недостаточности (СН).
Для анализа были использованы данные из 4 центров США по пациентам с СД1 или СД2, включенным в исследование SEARCH for Diabetes in Youth, которые в течение 2016 – 2019 гг. прошли допплерографию тканей. Средняя продолжительность заболевания диабетом у участников составляла 10,9 года. Диастолическая дисфункция у пациентов определялась нарушением показателей объема диастолического наполнения левого желудочка (ЛЖ), давления наполнения ЛЖ и скорости митрального клапана. Из 458 участников исследования 255 имели СД1 (средний возраст 21,2 года; 60,8% – белые, неиспаноязычного происхождения; 54,1% – женщины; средний уровень А1с – 9±1,9%), а 203 страдали СД2 (средний возраст 24,3 года, 24,1% – белые, неиспаноязычного происхождения; 75,4% – женщины; средний А1с – 9,6±3%).
В результате у участников с СД2 обнаружили худший профиль сердечно-сосудистого риска (выраженный более высокими показателями индекса массы тела, систолического и диастолического артериального давления, уровня триглицеридов, ХС ЛПНП и A1c, а также более низким уровнем ЛПВП), по сравнению с пациентами с СД1. Кроме того, у испытуемых с СД2 также зафиксировали более низкие показатели объема наполнения ЛЖ, скорости митрального клапана и более высокое давление ЛЖ. Вместе с тем, нескорректированная частота диастолической дисфункции была высокой в обеих группах (57,7% при СД2 против 47,2% при СД1).
Результаты исследования указывают на необходимость наблюдения за молодыми людьми с диабетом на предмет развития у них сердечно-сосудистых осложнений.
Эксперты сравнили эффективность ингибиторов SGLT2 с агонистами рецепторов ГПП-1 для пациентов с диабетом
По данным наблюдательного исследования в реальных условиях, проведенного экспертами из компании Humana, у пациентов с сахарным диабетом 2-го типа (СД2), которым назначают ингибиторы натрий-глюкозного котранспортера 2-го типа (SGLT2), зарегистрированы лучшие показатели приверженности к лечению, меньшее число обращений за медицинской помощью и более низкие расходы на медицинскую помощь, по сравнению с теми, кто использует агонисты рецепторов глюкагоноподобного пептида-1 (ГПП-1).
В ходе исследования были проанализированы сведения из базы данных Humana Research для выявления пациентов с СД2, которым недавно назначили ингибиторы SGLT2 или агонисты рецепторов ГПП-1 в период с января 2015 по июнь 2017 года. Возраст участников исследования составил 19-89 лет. В каждой из групп, проходящих лечение (либо ингибиторами SGLT2, либо агонистами рецепторов ГПП-1), было по 5507 пациентов.
Установили, что участники, которым назначили терапию агонистами рецепторов ГПП-1, были более склонны прекратить свое лечение, были подвержены более высокому риску госпитализации и с большей вероятностью обращались в отделения неотложной помощи, чем пациенты, принимавшие ингибиторы SGLT2. Кроме того, прием агонистов рецепторов ГПП-1 ассоциировался с более высокими медицинскими и фармацевтическими затратами по сравнению с использованием ингибиторов SGLT2.
Однако совокупный риск первичного сердечно-сосудистого исхода (инфаркта миокарда, инсульта или летального исхода) и вторичного сердечно-сосудистого исхода (сердечной недостаточности или смерти) был схожим среди участников обеих групп.
Высокочастотная стимуляция спинного мозга может облегчить боль при диабетической нейропатии
По данным экспертов из компании Nevro, высокочастотная стимуляция спинного мозга оказывает эффективное воздействие на облегчение боли у пациентов с диабетической нейропатией.
В исследовании SENZA-PDN приняли участие люди с болезненной диабетической нейропатией. При этом, 103 пациентов рандомизировали для прохождения традиционного медицинского лечения, а 113 участникам наряду с такой терапией также провели имплантацию стимулятора спинного мозга. Средний возраст участников равнялся примерно 61 годам, и около двух третей пациентов составили мужчины. На момент включения в испытание все пациенты испытывали боль в нижних конечностях со средней интенсивностью не менее 5 из 10 см по визуальной аналоговой шкале (VAS).
Через 3 месяца после стимуляции спинного мозга у 79% участников, которым осуществили имплантацию устройства, зарегистрировали ответную реакцию, выраженную снижением боли на 50% или более, а также отсутствием ухудшения неврологических симптомов, связанных с болезненной диабетической нейропатией. Для сравнения: лишь 5% участников, которым назначили только традиционное медицинское лечение, добились такого же результата.
Средний показатель интенсивности боли по шкале VAS среди пациентов, которым осуществили имплантацию стимулятора спинного мозга, снизился с 7,6 в начале исследования до 2,4 спустя 1 месяц и 1,7 спустя 3 месяца. Что касается участников, следовавших обычной терапии, этот показатель равнялся 7 в начале испытания, затем сократился до 6,7 спустя 1 месяц и составил 6,5 через 3 месяца.
Улучшение качества жизни, связанное с качеством сна и активной жизнедеятельностью, также было более заметным через 3 месяца в группе участников, прошедших стимуляцию спинного мозга.
Источник
Представлены результаты международного клинического исследования EDITIONJUNIOR на Российской научно-практической конференции детских эндокринологов, которая прошла с 12 по 13 сентября в Санкт-Петербурге. Целью исследования была оценка применения базального инсулина последнего поколения инсулин гларгин 300 ЕД/мл у детей с 6 лет и старше, которые имеют сахарный диабет и требуют лечения инсулином.1 В исследовании приняли участие 463 пациента в возрасте от 6 до 17 лет, среди которых были пациенты и из России.
В нашей стране отмечаются высокие темпы роста заболеваемости и распространенности сахарного диабета. По данным федерального регистра сахарного диабета, в РФ на 01.01.2019 г. на диспансерном учете состояло 4,58 млн человек с этим заболеванием. Среди них более 38 000 составляют пациенты с сахарным диабетом в возрасте до 18 лет.2
Особенностью сахарного диабета 1 типа у детей и подростков является большая вариабельность глюкозы в крови, чем у взрослых. Детский организм более чувствителен к инсулину, потребность в котором может быстро меняться. Важно постоянно поддерживать динамическое равновесие между гипогликемией и гипергликемией. Именно поэтому по мнению специалистов для данной возрастной группы особенно необходима современная инсулинотерапия, обеспечивающая имитацию физиологической секреции инсулина.
«В течение последних лет мы достигли значительного прогресса в лечении сахарного диабета у детей и подростков: появляются новые технологии управления заболеванием, совершенствуются подходы к самоконтролю, все шире применяются системы мониторирования показателей здоровья. Однако основой терапии сахарного диабета остается инсулинотерапия. Одной из целей лечения юных пациентов с сахарным диабетом является достижение максимально близкого к норме уровня углеводного обмена. Достичь его непросто из-за необходимости соблюдения хрупкого баланса между оптимальным уровнем гликемии и риском гипогликемии. Появление нового поколения базальных аналогов инсулина, в том числе инсулина гларгин 300 ЕД/мл, позволяет расширить наши возможности управления сахарным диабетом у детей и подростков», – отметила Петеркова В.А., академик РАН, профессор, д.м.н., научный руководитель Института Детской эндокринологии, заведующая кафедрой детской эндокринологии-диабетологии ФГБУ «НМИЦ эндокринологии» Минздрава России, Главный внештатный детский специалист эндокринолог Минздрава России.
Препарат был одобрен к применению у пациентов 6 лет и старше в России в декабре 2019 г.3 на основании данных открытого рандомизированного, контролируемого клинического исследования по сравнению инсулинов гларгин 300 ЕД/мл и гларгин 100 ЕД/мл у детей и подростков с сахарным диабетом 1 типа EDITION JUNIOR.4
- Сайт Государственного реестра лекарственных средств. [Электронный ресурс] 07 февраля 2020 г. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=424c4ad4-27fe-44e0-ad39-6b840d1de94c&t=
- Викулова О.К., Дедов И.И., Шестакова М.В., Железнякова А.В., Исаков М.А. Атлас регистра сахарного диабета РФ. Том 22, спецвыпуск 2. 2019. https://dia-endojournals.ru/dia/article/view/12208/9338
- Инструкция по медицинскому применению препарата Туджео СолоСтар®. РУ ЛП-003 653 от 30.05.2016
- Danne T et al.., Diabetes Care 2020;43:1512–1519 | https://doi.org/10.2337/dc19-1926.
Источник
