Синтез кетоновых тел при голодании и сахарном диабете
Синтез
кетоновых тел в печени. При
низком соотношении инсулин/глюкагон в
крови в жировой ткани активируется
распад жиров. Жирные кислоты поступают
в печень в большем количестве, чем в
норме, поэтому увеличивается скорость
β-окисления (рис. 8-32). Скорость реакций
ЦТК в этих условиях снижена, так как
оксалоацетат используется для
глюконеогенеза. В результате скорость
образования ацетил-КоА превышает
способность ЦТК окислять его. Ацетил-КоА
накапливается в митохондриях печени и
используется для синтеза кетоновых
тел. Синтез кетоновых тел происходит
только в митохондриях печени.
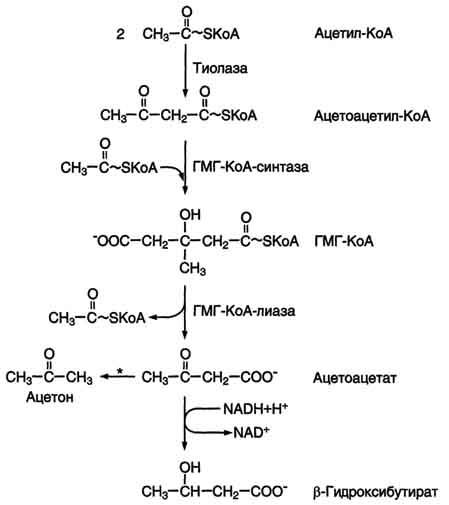
Синтез
кетоновых тел начинается с взаимодействия
двух молекул ацетил-КоА, которые под
действием фермента тиолазы образуют
ацетоацетил-КоА (рис. 8-33). С ацетоацетил-КоА
взаимодействует третья молекула
ацетил-КоА, образуя 3-гидрокси-3-метилглутарил-КоА
(ГМГ-КоА). Эту реакцию катализирует
фермент ГМГ-КоА-синтаза. Далее ГМГ-КоА-лиаза
катализирует расщепление ГМГ-КоА на
свободный ацетоацетат и ацетил-КоА.
Ацетоацетат
может выделяться в кровь или превращаться
в печени в другое кетоновое тело –
β-гидроксибутират путём восстановления.
В
клетках печени при активном β-окислении
создаётся высокая концентрация NADH. Это
способствует превращению большей части
ацетоацетата в β-гидроксибутират,
поэтому основное кетоновое тело в крови
– именно β-гидроксибутират. При голодании
для многих тканей жирные кислоты и
кетоновые тела становятся основными
топливными молекулами. Глюкоза
используется в первую очередь нервной
тканью и эритроцитами.
При
высокой концентрации ацетоацетата
часть его неферментативно декарбоксилируется,
превращаясь в ацетон. Ацетон не
утилизируется тканями, но выделяется
с выдыхаемым воздухом и мочой. Таким
путём организм удаляет избыточное
количество кетоновых тел, которые не
успевают окисляться, но, являясь
водорастворимыми кислотами, вызывают
ацидоз.
406
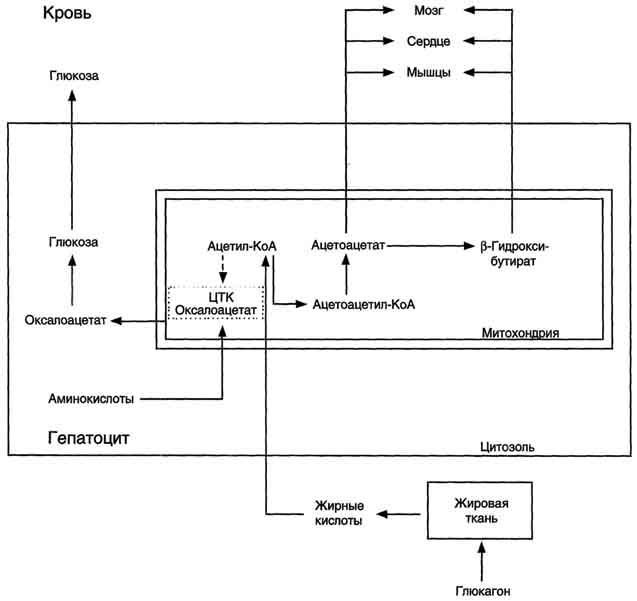
Рис.
8-32. Активация синтеза кетоновых тел при
голодании. Точечные
линии – скорость метаболических путей
снижена; сплошные линии – скорость
метаболических путей повышена. При
голодании в результате действия глюкагона
активируются липолиз в жировой ткани
и (3-окисление в печени. Количество
оксалоацетата в митохондриях уменьшается,
так как он, восстановившись до малата,
выходит в цитозоль, где опять превращается
в Оксалоацетат и используется в
глюконеогенезе. В результате скорость
реакций ЦТК снижается и, соответственно,
замедляется окисление ацетил-КоА.
Концентрация ацетил-КоА в митохондриях
увеличивается, и активируется синтез
кетоновых тел. Синтез кетоновых тел
увеличивается также при сахарном диабете
(см. раздел 11).
407

Рис.
8-33. Синтез кетоновых тел в митохондриях
гепатоцитов. Регуляторный
фермент синтеза кетоновых тел
(ГМГ-КоА-синтаза) ингибируется свободным
КоА. – реакция идёт неферментативно при
высокой концентрации кетоновых тел в
крови.
Регуляция
синтеза кетоновых тел. Регуляторный
фермент синтеза кетоновых тел – ГМГ-КоА
синтаза.
ГМГ-КоА-синтаза
– индуцируемый фермент; его синтез
увеличивается при повышении концентрации
жирных кислот в крови. Концентрация
жирных кислот в крови увеличивается
при мобилизации жиров из жировой ткани
под действием глюкагона, адреналина,
т.е. при голодании или физической работе.
ГМГ-КоА-синтаза
ингибируется высокими концентрациями
свободного кофермента А.Когда
поступление жирных кислот в клетки
печени увеличивается, КоА связывается
с ними, концентрация свободного КоА
снижается, и фермент становится активным.Если
поступление жирных кислот в клетки
печени уменьшается, то, соответственно,
увеличивается концентрация свободного
КоА, ингибирующего фермент. Следовательно,
скорость синтеза кетоновых тел в печени
зависит от поступления жирных кислот.
Окисление
кетоновых тел в периферических тканях
При
длительном голодании кетоновые тела
становятся основным источником энергии
для скелетных мышц, сердца и почек. Таким
образом
408
глюкоза
сохраняется для окисления в мозге и
эритроцитах. Уже через 2-3 дня после
начала голодания концентрация кетоновых
тел в крови достаточна для того, чтобы
они проходили в клетки мозга и окислялись,
снижая его потребности в глюкозе.
β-Гидроксибутират
(рис. 8-34), попадая в клетки, дегидрируется
NAD-зависимой дегидрогеназой и превращается
в ацетоацетат. Ацетоацетат активируется,
взаимодействуя с сук-цинил-КоА – донором
КоА:
Ацетоацетат
+ Сукцинил-КоА → Ацетоацетил- КоА +
Сукцинат.
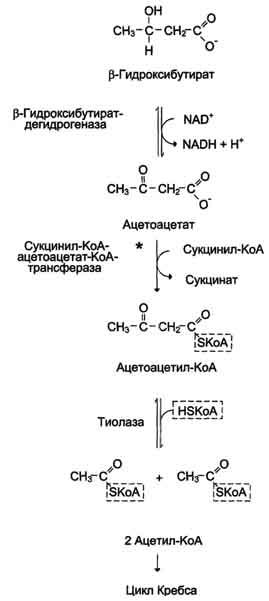
Рис.
8-34. Окисление кетоновых тел в тканях.
Реакцию
катализирует сукцинил-КоА-ацето-ацетат-КоА-трансфераза.
Этот фермент не синтезируется в печени,
поэтому печень не использует кетоновые
тела как источники энергии, а производит
их “на экспорт”. Кетоновые тела –
хорошие топливные молекулы; окисление
одной молекулы β-гидроксибутирата до
СО2 и Н2О обеспечивает синтез 27 молекул
АТФ. Эквивалент одной макроэргической
связи АТФ (в молекуле сукцинил-КоА)
используется на активацию ацетоацетата,
поэтому суммарный выход АТФ при окислении
одной молекулы β-гидроксибутирата – 26
молекул.
Кетоацидоз. В
норме концентрация кетоновых тел в
крови составляет 1-3 мг/дл (до 0,2 мМ/л), но
при голодании значительно увеличивается.
Увеличение концентрации кетоновых тел
в крови называют кетонемией, выделение
кетоновых тел с мочой – кетонурией.
Накопление кетоновых тел в организме
приводит к кетоацидозу: уменьшению
щелочного резерва (компенсированному
ацидозу), а в тяжёлых случаях – к сдвигу
рН (некомпенсированному ацидозу), так
как кетоновые тела (кроме ацетона)
являются водорастворимыми органическими
кислотами (рК~3,5), способными к диссоциации:
СН3-СО-СН2-СООН
↔ СН3-СО-СН2-СОО- + Н+.
Ацидоз
достигает опасных величин при сахарном
диабете, так как концентрация кетоновых
тел при этом заболевании может доходить
до 400-500 мг/дл. Тяжёлая форма ацидоза –
одна из основных причин смерти при
сахарном диабете. Накопление протонов
в крови нарушает связывание кислорода
гемоглобином, влияет на ионизацию
функциональных групп белков, нарушая
их кон-формацию и функцию.
Гиперкетонемия —
это накопление кетоновых тел в крови.
К ним относятся ацетоуксусная кислота,
р-оксимасляная кислота, ацетон.
Основной
причиной гиперкетонемии является
увеличение содержания в крови свободных
жирных кислот — гиперлипацидемия.
Последняя связана с усилением липолиза
в жировой ткани, например, при сахарном
диабете I типа, лихорадке, во втором
периоде голодания.
Избыток
свободных жирных кислот поступает в
печень, где под действием ферментов
р-окисления образуется большое количество
ацетил-КоА. Какая-то его часть подвергается
дальнейшим превращениям в цикле Кребса
(интенсивность этого процесса зависит
от энергетических потребностей
гепатоцитов), а оставшееся неиспользованное
количество идет на образование кетоновых
тел, которые поступают в кровь и могут
быть утилизированы как ценный
энергетический субстрат периферическими
клетками.
При
некоторых заболеваниях, например, при
сахарном диабете I типа, использование
кетоновых тел клетками нарушается. Это
усугубляет гиперкетонемию.
Гиперкетонемия всегда
сопровождается кетонурией (ацетонурией)
— появлением кетоновых тел (ацетона) в
моче.
Кетонурия
Обнаружение
кетоновых тел в общем анализе мочи
называют – кетонурия. В норме кетоновые
тела в моче не обнаруживаются, так как
ежедневно выводятся из организма
органами выделения, в количестве 25-50 мг
в сутки. К таким телам относятся ацетон,
уксусная и бета-осмолярная кислоты. В
моче здорового человека медики не
выявляют кетоновых тел.
Причины
появления кетоновых тел
К
причинам накапливания в моче кетоновых
тел относятся многие причины, некоторые
из них несут угрозу нормальной
жизнедеятельности организма. Вот одни
из причин:
длительное
голодание организма;общее
переохлаждение;физические
перегрузки;беременность;
чрезмерное
употребление белков с пищей;грипп;
анемия;
рак
и другие заболевания.
Если
кетонурия спровоцирована сахарным
диабетом, то наличие кетоновых тел в
моче является своеобразным сигналом
для организма о том, что нужно пересмотреть
свой рацион питания.
Часто
такая патология встречается, если
нарушен баланс между употребляемыми
жирами и углеводами. Если кетонурия
сопровождается сильно выраженным
плодовым запахом мочи (чаще яблочным),
то это говорит о высоком содержании
глюкозы в моче при сахарном диабете.
При
обнаружении кетоновых тел в моче при
сахарном диабете, медики говорят о
переходе заболевания в более тяжелую
стадию. Очень большое содержание в моче
ацетона и уксусной кислоты при сахарном
диабете, свидетельствует о приближении
состояния гипергликемической комы у
больного.
Если
при исследовании анализа мочи больного,
в ней обнаружен только ацетон без
содержания глюкозы, то речь идёт о другом
заболевании, не имеющем отношения к
диабету.
Ацидоз (от лат. acidus
— кислый) —
cмещение кислотно-щелочного
баланса организма в
сторону увеличения кислотности
(уменьшению рН).
Причины
ацидоза
Обычно
продукты окисления органических кислот
быстро удаляются из организма. При
лихорадочных заболеваниях, кишечных
расстройствах, беременности, голодании и
др. они задерживаются в организме, что
проявляется в лёгких случаях появлением
в моче ацетоуксусной
кислоты и ацетона (т. н. ацетонурия),
а в тяжёлых (например, при сахарном
диабете)
может привести к коме.
Соседние файлы в папке экз
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
При состояниях, сопровождающихся снижением глюкозы крови, клетки органов и тканей испытывают энергетический голод. Так как окисление жирных кислот процесс “трудоемкий”, а нервные клетки вообще неспособны окислять жирные кислоты, то печень облегчает использование этих кислот тканями, заранее окисляя их до уксусной кислоты и переводя последнюю в транспортную форму – кетоновые тела.
К кетоновым телам относят три соединения близкой структуры – ацетоацетат, 3-гидроксибутират и ацетон.
Строение кетоновых тел
Стимулом для образования кетоновых тел служит поступление большого количества жирных кислот в печень. Как уже указывалось, при состояниях, активирующих липолиз в жировой ткани, не менее 30% образованных жирных кислот задерживаются печенью. К таким состояниям относится голодание, сахарный диабет I типа, длительные физические нагрузки. Так как синтез ТАГ в этих условиях невозможен, то жирные кислоты из цитозоля попадают в митохондрии и окисляются с образованием кетоновых тел.
Для понимания причин развития кетонемии при различных ситуациях необходимо понимать роль оксалоацетата для регуляции цикла трикарбоновых кислот. При голодании соотношение инсулин/глюкагон низкое и поэтому в печени активно идет глюконеогенез, для которого используется оксалоацетат. Поэтому при голодании жирные кислоты, поступающие в большом количестве в печень, не сгорают в ЦТК, а уходят в синтез кетоновых тел. При длительной мышечной нагрузке резервы гликогена в печени истощаются, развивается тенденция к гипогликемии и секретируется глюкагон, который усиливает глюконеогенез, при этом количество оксалоацетата снижается, и жирные кислоты, попавшие в печень, будут окисляться с образованием кетоновых тел.
Кроме отмеченных ситуаций, количество кетоновых тел в крови возрастает при алкогольном отравлении и потреблении жирной пищи. При богатой жирами диете, особенно у детей, жирные кислоты не успевают включиться в состав ТАГ и ЛПОНП и частично переходят в митохондрии, что увеличивает синтез кетоновых тел. При алкогольном отравлении субстратом для синтеза кетонов является ацетил-SКоА, синтезируемый при обезвреживании этанола.
В обычных условиях синтез кетоновых тел также идет, хотя в гораздо меньшем количестве. Для этого используются как жирные кислоты, так и безазотистые остатки кетогенных и смешанных аминокислот.
Для детей раннего возраста характерна неустойчивость жирового обмена, связанная с недостаточностью регуляторного влияния ЦНС и эндокринной системы. Поэтому кетонемия и кетонурия у грудных детей наблюдается чаще, чем у взрослых.
Уровень ацетоацетата быстро нарастает между 12 и 24 часами жизни и сохраняется высоким первую неделю жизни, что свидетельствует об активной мобилизации жира из депо, высокой утилизации свободных жирных кислот в печени и малом использовании кетоновых тел в тканях.
У детей до 7 лет под влиянием различных стимулов (краткое голодание, инфекции, эмоциональное возбуждение) ускоряется синтез кетоновых тел и может легко возникать кетоацидоз, сопровождающийся неукротимой рвотой (“ацетонемическая рвота“). Причиной этому служит неустойчивость углеводного обмена и малые запасы гликогена у детей, что усиливает липолиз в адипоцитах, накопление жирных кислот в крови и, следовательно, кетогенез в печени.
Синтез кетоновых тел (кетогенез)
Синтез ацетоацетата происходит только в митохондриях печени, далее он либо восстанавливается до 3-гидроксибутирата, либо декарбоксилируется до ацетона. После синтеза все три соединения поступают в кровь и разносятся по тканям. Ацетон, как летучее вещество, легко удаляется с выдыхаемым воздухом и потом. Все кетоновые тела могут выделяться с мочой.
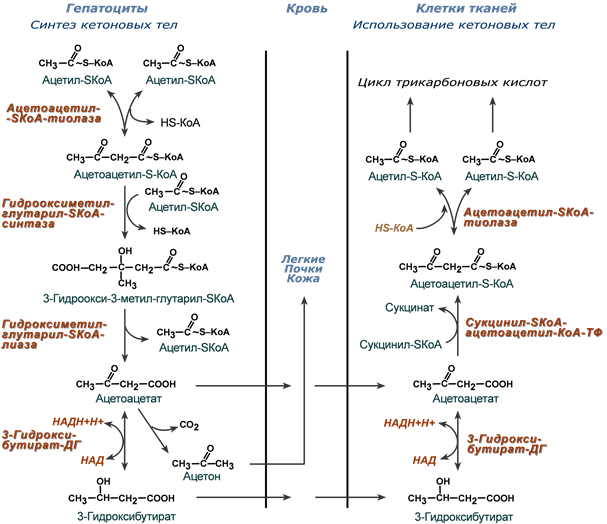
Реакции синтеза и утилизации кетоновых тел
Используются кетоновые тела клетками всех тканей, кроме печени и эритроцитов. Особенно активно, даже в норме, они потребляются миокардом и корковым слоем надпочечников.
В тканях реакции утилизации кетоновых тел в целом совпадают с обратным направлением реакций синтеза. В цитозоле клеток 3-гидроксибутират окисляется, образующийся ацетоацетат проникает в митохондрии, активируется за счет сукцинил-SКоА и превращается в ацетил-SКоА, который сгорает в ЦТК.
При голодании синтез кетоновых тел ускоряется в 60 раз (повышение до 0,6 г/л при норме менее 0,01 г/л), при сахарном диабете I типа – в 400 (!) раз (до 4 г/л).
При сахарном диабете 1 типа (инсулинзависимом) в гепатоците глюкозы может быть много, т.к. глюкоза проникает в него через ГлюТ-2 без участия инсулина. Однако, точно также как при голодании, соотношение инсулин/глюкагон низкое, и оксалоацетат очень активно уходит на синтез глюкозы, что тормозит ЦТК и отправляет ацетил-SKoA на образование кетоновых тел.
При сахарном диабете 2 типа (инсулиннезависимом) инсулина достаточно и соотношение инсулин/глюкагон велико, поэтому глюконеогенез не активен и оксалоацетата хватает для поддержания ЦТК. Образуемый здесь ацетил-SKoA либо сгорает в ЦТК, либо используется для реакций синтеза холестерина и синтеза жирных кислот (которые стимулируются инсулином). К тому же при наличии инсулина попадающие в печень жирные кислоты будут не окисляться, а вовлекаться в синтез триацилглицеролов и ЛПОНП.
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 5 ноября 2020; проверки требуют 8 правок.
Кетоз — состояние, развивающееся в результате углеводного голодания клеток, когда организм для получения энергии начинает расщеплять жир с образованием большого количества кетоновых тел. Это одна из приспособительных реакций на отсутствие углеводов в пище.[1] Эволюционный смысл кетоза — дать возможность организму выжить в условиях дефицита богатой углеводами растительной пищи, переключившись на пищу животного происхождения.[2]
Отличие от кетоацидоза[править | править код]
Кетоз — физиологическое состояние, а кетоацидоз — уже патологическое состояние, при котором содержание в крови кетоновых тел настолько велико, что происходит сдвиг кислотно-щелочного баланса организма в кислую сторону. Если вовремя не остановить развитие кетоацидоза, то может наступить риск смерти.
В состоянии кетоза кетоновые тела образуются ровно столько, сколько требуется организму для получения энергии, и все они подвергаются дальнейшему распаду. В состоянии кетоацидоза кетоновые тела бывают избыточными и организм усиленно пытается вывести излишки кетоновых тел с мочой, через кожу и через легкие.[2]
Причины развития кетоза[править | править код]
Сахарный диабет[править | править код]
Наиболее частой причиной развития кетоза является сахарный диабет.
Сахарный диабет 1-го типа[править | править код]
При сахарном диабете 1-го типа, с одной стороны, имеет место дефицит инсулина, с другой — избыток контринсулярных гормонов (глюкагона, катехоламинов, кортизола). В условиях недостатка инсулина активируются процессы гликолиза, гликогенолиза, липолиза. Массивный липолиз приводит к быстрому увеличению концентрации свободных жирных кислот в крови, из которых в печени под действием глюкагона синтезируются кетоновые кислоты. Торможение всех анаболических процессов в условиях дефицита инсулина приводит к замедлению процессов кетолизиса и развитию кетоацидоза.[3][4]
Сахарный диабет 2-го типа[править | править код]
При сахарном диабете 2-го типа имеет место относительная инсулиновая недостаточность, поэтому в случае декомпенсации этого заболевания наблюдается рост гликемии, а интенсивность процессов липолиза и кетогенеза значительно не изменяется. При поддержании кетогенной диеты происходят определённые метаболические изменения, провоцирующие синтез кетоновых тел: на 1-2-й день голодания активируются процессы гликогенолиза в печени и мышцах, на 3-4-й день продукция кетокислот значительно возрастает и достигает максимума к окончанию 2-й недели, на 1-й неделе усиливаются процессы глюконеогенеза, а со 2-й недели активность глюконеогенеза снижается и увеличивается использование кетонов головным мозгом. Таким образом, за счет преимущественного использования жиров в качестве источника энергии сохраняются жизненно важные запасы белка.[3][5]
Детский ацетонемический синдром[править | править код]
У детей вследствие кетоацидоз развивается в результате погрешностей в питании: при употреблении избытка жиров или длительных периодов голодания, а также при некоторых соматических, инфекционных, эндокринных болезнях. Проявляется он приступами циклической рвоты, которая возникает через равные промежутки времени. Периоды рвоты чередуются с периодами относительного благополучия, когда ребенка ничего не беспокоит. Заподозрить кетоз у ребенка можно также по характерному запаху ацетона и схватками болей в области живота.[1][6]
Голодание и низкоуглеводные диеты[править | править код]
Механизм развития кетоза при голодании заключается в расщеплении жиров с высвобождением жирных кислот и последующим синтезом кетоновых тел. Длительное голодание может привести к переходу кетоза в кетоацидоз и интоксикации организма. Вред длительного отказа от пищи состоит еще и в том, что для использования кетоновых тел в качестве энергии все равно необходимо небольшое количество глюкозы. Ее организм синтезирует в печени из аминокислот, образовавшихся вследствие расщепления белка. Поэтому часто люди, которые голодают, чтобы похудеть, вместо жира теряют мышечную массу.
Низкоуглеводные диеты построены на следующем принципе: употребление белка дает субстрат для синтеза глюкозы, которая используется в метаболизме кетоновых тел, образовавшихся из расщепленного жира. Организм теряет жир без потери мышечной массы. Но скорость образования глюкозы ниже скорости образования кетоновых тел, поэтому они не успевают усваиваться и развивается кетоз.
Низкоуглеводные диеты опасны для людей со скрытыми нарушениями обмена веществ, которые не проявляются при обычном режиме питания. У них может развиться метаболический ацидоз в тяжелой форме.[1][7]
Кетоновые тела в крови и моче[править | править код]
Содержание кетоновых тел в сыворотке крови здорового человека варьирует от 34,4 до 430,5 мкмоль/л в пересчете на ацетон, в моче — 20-54 мг в течение суток. Такие концентрации кетоновых тел не определяются при помощи рутинных методов в клинической практике, поэтому принято считать, что в норме кетоновые тела в крови и в моче отсутствуют.
В клинической практике для обнаружения кетоновых тел используют преимущественно качественные пробы, которые позволяют быстро определить патологическое увеличение концентрации кетоновых тел в моче.
В соответствии с этими методиками наличие ацетоацетата в клиническом анализе мочи может измеряться от «одного плюса» (+) до «четырех плюсов» (++++). Кроме того, полученный результат отражает уровень кетонов в организме за 2-4 часа до проведения исследования, то есть на момент поступления результатов из лаборатории истинная выраженность кетоза может превышать установленные значения.
Метод определения ацетоацетата в моче имеет еще один недостаток: результат исследования зависит от количества жидкости, принятой пациентом (прием большого количества жидкости дает ложноотрицательный результат, малого количества — ложноположительный).[8]
Кетоз в ветеринарии[править | править код]
Кетозы бывают первичные и вторичные. Первичные кетозы-самостоятельные заболевания, чаще встречаются у жвачных, особенно у высокопродуктивных коров и многоплодных овец, реже-у свиней, птиц и пушных зверей. Как правило, их наблюдают зимой и весной. Вторичные кетозы как стереотипный синдром возникают на фоне основной болезни, сопровождающейся расстройством пищеварения и мобилизацией жира из депо в качестве основного источника энергии.[9]
См. также[править | править код]
- Моносахариды
- Углеводы
- Голодание
- Ацетонемический синдром у детей
Примечания[править | править код]
Ссылки[править | править код]
- Диетарный кетоз
- Кетоз и кетоацидоз. Патобиохимический и клинический аспект
Источник
