Болюсно базисная терапия сахарного диабета

Сегодня для больных сахарным диабетом 1 типа не существует альтернативы терапии инсулином. В списке лечебных мероприятий она занимает первую строку. Инсулинотерапия, по сути, является заместительной гормональной терапией.
Сегодня для больных сахарным диабетом 1 типа не существует альтернативы терапии инсулином. В списке лечебных мероприятий она занимает первую строку. Инсулинотерапия, по сути, является заместительной гормональной терапией. Необходимость в ней обусловлена тем, что гипергликемия у больных сахарным диабетом 1 типа является следствием абсолютного дефицита собственного инсулина ввиду повреждения бета-клеток поджелудочной железы патологическим процессом. Своевременное успешное восполнение этого дефицита позволяет нормализовать обмен веществ и сохранить остатки функционирующих бета-клеток поджелудочной железы. В настоящее время применяется два вида инсулинотерапии – традиционная и интенсифицированная, или физиологическая. Основой понимания принципов назначения инсулина является представление о нормальной (физиологической) секреции инсулина.
Что такое «пищевой» и «базальный» инсулин?
 У здорового человека ночью и между приемами пищи уровень инсулина в венозной крови
У здорового человека ночью и между приемами пищи уровень инсулина в венозной крови
составляет 5-15 мкЕД/мл, а во время пищеварения, длящегося в среднем 2-4 часа после приема углеводистой пищи – 50-150 мкЕД/мл (поджелудочная железа очень быстро и в больших количествах выбрасывает инсулин в ответ на повышение глюкозы в крови). За сутки у взрослого человека с нормальным весом секретируется 35-70 ЕД инсулина.
Сложная кинетика инсулина, в которой различают относительно постоянную базальную секрецию и варьирующую пищевую, обеспечивает оптимальный для организма уровень гликемии в пределах 3,3-8,9 ммоль/л.
«Базальный» инсулин (примерно 0,5-1 ЕД в час, 12-24 ЕД в сутки) поддерживает нормальный обмен веществ в интервалах между едой.
«Пищевой» инсулин (1-2 ЕД на каждые 12-15 г съеденных углеводов) обеспечивает усвоениеглюкозы, поступившей с едой, печенью, мышечной и жировой тканями. Базальный инсулин помогает пищевому инсулину действовать быстрее и лучше.
Кроме того, секреция инсулина в поджелудочной железе подвержена суточным колебаниям: потребность в нем повышается в ранние утренние часы и постепенно падает в течение дня.
При сахарном диабете 1 типа, когда бета-клетки поджелудочной железы неспособны вырабатывать инсулин, оптимальным является применение препаратов с такими параметрами действия, которые позволяют имитировать физиологическую секрецию инсулина с постоянным базальным уровнем гормона в крови и пиками его концентрации в ответ на пищевую нагрузку. Поддержание гликемии на нормальном уровне реально обеспечивает возможность профилактики поздних осложнений сахарного диабета.
Адекватным уровнем показателей считают гликемию натощак и перед едой 5,1-6,5 ммоль/л, через 2 часа после еды 7,6-9,0 ммоль/л, перед сном 6,0-7,5 ммоль/л, Hb А1с 6,1-7,5%.
Что такое «интенсифицированная» инсулинотерапия?
Режим введения инсулина, предполагающий 4-5 инъекций в день препаратов инсулина различного профиля действия и такие же частые измерения глюкозы в крови самим пациентом с коррекцией дозы инсулина, называется интенсивной, или интенсифицированной инсулинотерапией. В последние два десятилетия наступило полное признание необходимости многократных в течение дня инъекций инсулина для достижения целей контроля сахарного диабета 1 типа. Особенно это касается молодых пациентов и детей, у которых, в силу предстоящего длительного течения заболевания, риск развития поздних осложнений диабета наиболее высок.
Чем обеспечивается интенсивная инсулинотерапия?
Базисно-болюсная схема введения инсулина – основа интенсивной инсулинотерапии
Потребность в инсулине, соответствующая базальному (фоновому) уровню, обеспечивается введением инсулина или аналога инсулина продленного действия 1 или 2 раза в день (в ряде случаев и более).
Можно использовать любой НПХ-инсулин, Лантус или Левемир.
Суммарная доза базального инсулина не должна превышать половины всей вводимой дозы инсулина за сутки. Пищевая (пиковая) секреция инсулина замещается инъекциями инсулина или аналога инсулина короткого действия 3 раза в день (в ряде случаев и более). Эти инъекции «на еду» называют «болюсами». Применяют любой инсулин-Р (Регуляр), НовоРапид или Хумалог. Доза болюсного инсулина определяется исходя из количества углеводов, которое предполагается съесть во время предстоящего приема пищи, и имеющегося уровня гликемии. Для каждого пациента потребность в пищевом инсулине своя и выясняется в процессе лечения. Больные диабетом должны сами научиться подбирать соотношение между количеством пищи и болюсным инсулином. Сочетание базальной и нескольких болюсных инъекций инсулина называют базисно-болюсной терапией.
Существует несколько схем введения инсулина в базисно-болюсном режиме.
 Чаще используются три из них. Первая состоит в следующем: в качестве базального вводится НПХ-инсулин утром и перед сном, перед основными приемами пищи – инсулин или аналог инсулина короткого действия. Применяют небольшие дозы НПХ-инсулина, причем утренняя чаще всего равна вечерней. Дозу инсулина короткого действия рассчитывают после количественной оценки углеводов по системе эквивалентов. Чащевсего вводят 2-3 ЕД на 1 ХЕ во время завтрака, 1-2 ЕД на 1 ХЕ во время обеда, 1-1,5 ЕД на 1 ХЕ во время ужина. При подсчете ХЕ учитываются углеводы основного и промежуточного приемов пищи. Пациенты, использующие аналоги инсулина, скорее всего могут обойтись без перекусов или, напротив, дополнительно вводить небольшую дозу Хумалога перед вторым завтраком или полдником. Вторая схема предполагает 3 инъекции базального НПХ-инсулина в сочетании с тремя инъекциями аналога инсулина короткого действия. Необходимость в 3-х инъекциях базального инсулина чаще всего возникает, если имеет место длительный перерыв между обедом и ужином, когда в качестве болюсного инсулина используется Хумалог, и в случае высокого уровня глюкозы в крови ближе к вечеру. Небольшая доза НПХ- инсулина вводится перед завтраком, в середине дня (например, перед обедом) и перед сном. Дополнительная дневная доза пролонгированного инсулина позволяет улучшить весь суточный профиль гликемии.
Чаще используются три из них. Первая состоит в следующем: в качестве базального вводится НПХ-инсулин утром и перед сном, перед основными приемами пищи – инсулин или аналог инсулина короткого действия. Применяют небольшие дозы НПХ-инсулина, причем утренняя чаще всего равна вечерней. Дозу инсулина короткого действия рассчитывают после количественной оценки углеводов по системе эквивалентов. Чащевсего вводят 2-3 ЕД на 1 ХЕ во время завтрака, 1-2 ЕД на 1 ХЕ во время обеда, 1-1,5 ЕД на 1 ХЕ во время ужина. При подсчете ХЕ учитываются углеводы основного и промежуточного приемов пищи. Пациенты, использующие аналоги инсулина, скорее всего могут обойтись без перекусов или, напротив, дополнительно вводить небольшую дозу Хумалога перед вторым завтраком или полдником. Вторая схема предполагает 3 инъекции базального НПХ-инсулина в сочетании с тремя инъекциями аналога инсулина короткого действия. Необходимость в 3-х инъекциях базального инсулина чаще всего возникает, если имеет место длительный перерыв между обедом и ужином, когда в качестве болюсного инсулина используется Хумалог, и в случае высокого уровня глюкозы в крови ближе к вечеру. Небольшая доза НПХ- инсулина вводится перед завтраком, в середине дня (например, перед обедом) и перед сном. Дополнительная дневная доза пролонгированного инсулина позволяет улучшить весь суточный профиль гликемии.
Третья схема базисно-болюсной терапии – это сочетание одной инъекции аналога инсулина пролонгированного действия и 3-х и более инъекций аналога инсулина короткого действия. Эта схема инсулинотерапии сахарного диабета 1 типа в наибольшей степени соответствует физиологическому профилю секреции инсулина, дает максимальную свободу образа жизни, позволяет достигнуть лучших показателй гликемического контроля при минимальном риске гипогликемических реакций.
В то же время это самый дорогостоящий вид инсулинотерапии. Непременным условием успешной инсулинотерапии является активное участие пациента в контроле диабета, иначе приложенные усилия и потраченное время будут бесполезны.
Все люди с сахарным диабетом 1 типа, а также часть людей с сахарным диабетом 2 типа используют базис-болюсную инсулинотерапию. Это значит, что они делают инъекции длинного (базального) инсулина (Лантус, Левемир, Тресиба, НПХ и т.д.), который необходим для глюкозы, синтезирующейся в нашем организме между приемами пищи, а также инъекции короткого (Актрапид НМ, Хумулин R, Инсуман Рапид) или ультракороткого инсулина (Хумалог, Новорапид, Апидра), то есть болюсы, которые необходимы, для снижения уровня глюкозы, получаемой нами с пищей (рис.1). В инсулиновых помпах обе эти функции выполняет ультракороткий инсулин.
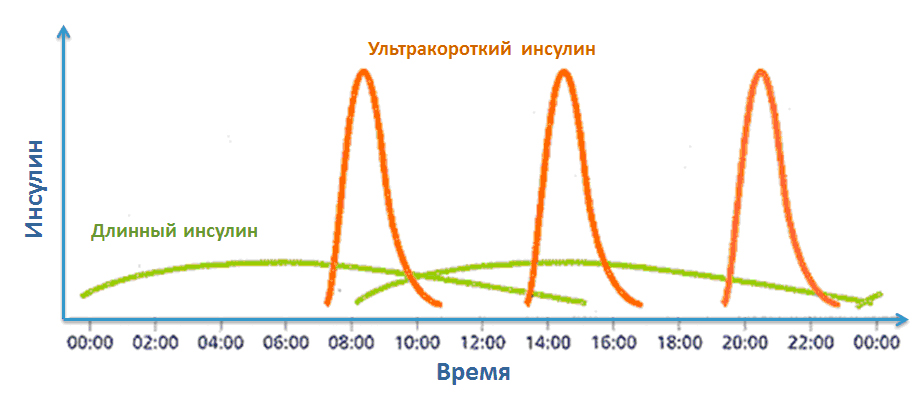
Рис.1 Базис-болюсная инсулинотерапия
Про расчет суточной дозы инсулина и базальной дозы инсулина подробно написано в статье “Расчет базальной дозы инсулина”. В рамках же данной статьи мы остановимся только на расчете дозы болюсного инсулина.
Важно напомнить, что примерно 50-70% от суточной дозы инсулина, должно приходиться на болюсный инсулин, а 30-50% на базальный. Обращаю ваше внимание, что если у вас неправильно подобрана доза базального (длинного) инсулина, то нижеописанная система расчета не принесет вам дополнительных преимуществ в контроле глюкозы крови. Рекомендуем начать с коррекции базального инсулина.
Вернемся к болюсному инсулину.
Доза болюсного инсулина = инсулин на коррекцию уровня глюкозы + инсулин на еду (на ХЕ)
Разберем каждый пункт подробней
1. Инсулин на коррекцию уровня глюкозы
Если вы измерили уровень глюкозы, и он оказался выше целевых значений, рекомендованных вашим эндокринологом, то вам нужно ввести определенное количество инсулина, чтобы снизить свой уровень глюкозы крови.
Для того чтобы рассчитать количество инсулина на коррекцию уровня глюкозы, необходимо знать:
– уровень глюкозы крови на данный момент
– ваши целевые значения уровня глюкозы (их можно узнать у своего эндокринолога и/или рассчитать с помощью калькулятора)
– коэффициент чувствительности
Коэффициент чувствительности показывает, на сколько ммоль/л 1 единица инсулина снижает уровень глюкозы крови. Для расчета коэффициента чувствительности (ISF) используется «правило 100», 100 делится на Суточную Дозу Инсулина (СДИ).
Коэффициент Чувствительности (КЧ, ISF) = 100/СДИ
ПРИМЕР: предположим, что СДИ = 39 ЕД/сут, значит Коэффициент Чувствительности = 100/39 = 2,5
В принципе, вы можете оставить один коэффициент чувствительности на весь день. Но чаще всего, с учетом нашей физиологии и времени выработки контринсулярных гормонов, утром чувствительность к инсулину хуже, чем вечером. То есть утром нашему организму требуется больше инсулина, чем в вечернее время. И если основываться на данных нашего ПРИМЕРА, то мы рекомендуем:
– утром снизить коэффициент до 2,0,
– днем оставить коэффициент 2,5,
– вечером повысить до 3,0.
Теперь рассчитаем дозу инсулина на коррекцию уровня глюкозы:
Инсулин на коррекцию уровня глюкозы = (уровень глюкозы в данный момент – целевое значение)/ коэффициент чувствительности
ПРИМЕР: человек с СД 1 типа, коэффициент чувствительности 2,5 (рассчитан выше), целевые значения глюкозы от 6 до 8 ммоль/л, уровень глюкозы крови на данный момент 12 ммоль/л.
Сначала определимся с целевым значением. У нас интервал с 6 до 8 ммоль/л. Так какое значение брать в формулу? Чаще всего берите среднее арифметическое из двух значений. То есть в нашем примере (6+8)/2=7.
Инсулин на коррекцию уровня глюкозы = (12-7)/2,5 = 2 ЕД
2. Инсулин на еду (на ХЕ)
Это то количество инсулина, которое вам нужно ввести, чтобы покрыть углеводы, поступающие с пищей.
Для того чтобы рассчитать дозу инсулина на еду, необходимо знать:
– сколько хлебных единиц или грамм углеводов вы собираетесь съесть, напомним, что в нашей стране 1ХЕ = 12 граммам углеводов (в мире 1ХЕ соответствует 10-15 граммам УВ)
– соотношение инсулин/углеводы (или углеводный коэффициент).
Соотношение инсулин/углеводы (или углеводный коэффициент) показывает сколько грамм углеводов покрывает 1 ЕД инсулина. Для расчета используется «правило 450» или «500». В нашей практике, мы используем «правило 500». А именно 500 делим на Суточную Дозу Инсулина.
Соотношение инсулин/углеводы = 500/СДИ
Возвращаясь к нашему ПРИМЕРУ, где СДИ = 39 ЕД/сут
соотношение инсулин/углеводы = 500/39= 12,8
То есть 1 единица инсулина покрывает 12,8 грамм углеводов, что соответствует 1 ХЕ. Следовательно, соотношение инсулин углеводы 1ЕД:1ХЕ
Вы можете также оставить одно соотношение инсулин/углеводы на весь день. Но, основываясь на физиологии, на том, что утром необходимо больше инсулина, чем вечером, мы рекомендуем увеличить соотношение инс/угл утром и снизить вечером.
На основе нашего ПРИМЕРА, мы бы рекомендовали:
– утром увеличить количество инсулина на 1 ХЕ, то есть 1,5 ЕД : 1 ХЕ
– днем оставить 1ЕД:1ХЕ
– вечером также оставить 1ЕД:1ХЕ
Теперь рассчитаем дозу инсулина на еду
Доза инсулина на еду = Соотношение Инс/Угл * Количество ХЕ
ПРИМЕР: в обед человек собирается съесть 4 ХЕ, и его соотношение инсулин/углеводы 1:1.
Доза инсулина на еду = 1×4ХЕ=4ЕД
3. Рассчитаем общую дозу болюсного инсулина
Как указано выше
ДОЗА БОЛЮСНОГО ИНСУЛИНА = ИНСУЛИН НА КОРРЕКЦИЮ УРОВНЯ ГЛЮКОЗЫ + ИНСУЛИН НА ЕДУ (НА ХЕ)
Исходя из нашего ПРИМЕРА, получается
Доза болюсного инсулина = (12-7)/2,5 + 1×4ХЕ = 2ЕД + 4 ЕД = 6ЕД
Конечно, на первый взгляд данная система расчета может показаться вам сложной и трудновыполнимой. Все дело в практике, необходимо постоянно считать, чтобы довести расчет доз болюсного инсулина до автоматизма.
В заключении хочется напомнить, что представленные выше данные являются результатом математического расчета, основанного на вашей суточной дозе инсулина. И это не значит, что они обязательно должны идеально подходить вам. Вероятнее всего, в ходе применения, вы поймете, где и какой коэффициент можно увеличить или уменьшить, чтобы улучшить контроль сахарного диабета. Просто в ходе данных расчетов вы получите числа, на которые можете ориентироваться, а не подбирать дозу инсулина эмпирическим путем.
Надеемся, что данная статья была вам полезна. Желаем успехов в расчете доз инсулина и стабильного уровня глюкозы!
Сахарный диабет (СД) является серьезной медико-социальной проблемой для большинства стран мира. В центре особого внимания современной диабетологии – различные сосудистые осложнения диабета, нередко определяющие прогноз, трудоспособность и продолжительность жизни больных. В настоящий момент в России состоит на учете у эндокринологов около 2,5 млн. пациентов, страдающих СД. Однако реальная цифра, учитывающая невыявленных больных, по крайней мере, в 2-3 раза больше, т.е. около 5% населения страны страдает СД.
Сахарный диабет 2 типа характеризуется недостаточностью секреции инсулина, которая возникает в результате 2 феноменов: прогрессирующей деструкции бета-клеток поджелудочной железы и резистентности периферических тканей к инсулину. Следовательно, противодиабетическую терапию следует со временем модифицировать. На начальном этапе для контроля диабета может оказаться достаточно диетотерапии, хотя вскоре больным приходится назначать пероральные сахароснижающие средства. Если максимальная пероральная сахароснижающая терапия не обеспечивает компенсацию сахарного диабета, рекомендуют применение инсулина (примерно через 10 лет болезни). На этой стадии потребность в инсулине остается невысокой, что позволяет ограничить число иньекций и суммарную дозу экзогенного инсулина. Однако, по мере прогрессирования болезни наступает момент, когда фаза гиперсекреции инсулина сменяется фазой «истощения», в этот период возникает дефицит инсулина и пациент начинает нуждаться в инсулинотерапии.
В настоящее время отсутствуют «жесткие» рекомендации по инсулинотерапии сахарного диабета 2 типа на этой стадии. Соответственно, подходы к лечению достаточно вариабельны и часто зависят от личных предпочтений врача. Как показало международное исследование DAWN (2001 год), 45% врачей из 3 тысяч опрошенных во многих странах откладывают начало инсулинотерапии, пока она не становится абсолютно необходимой; более половины используют инсулин как угрозу в отношении больных. Что же касается пациентов (в опросе участвовало более 5 тысяч), то их отличает так называемая «психологическая инсулинорезистентность» – нежелание демонстрировать свою болезнь, боязнь иньекций, опасение гипогликемий, набора веса и т.д., то есть целый набор стандартных мифов и заблуждений, которые рассеиваются при обучении в школах для пациентов с сахарным диабетом.
Еще в 2005 году было принято руководство IDF по лечению СД типа 2, которое призвало начинать инсулинотерапию до прогрессирования осложнений сахарного диабета, при плохом контроле заболевания – уже на уровне HbA1c > 7%, при среднесуточной гликемии более 9 ммоль/л. Было рекомендовано также объяснять пациенту сразу после установления диагноза СД типа 2, что инсулин – один из доступных вариантов управления диабетом, а часто – необходимый метод терапии. В Швеции, например, уже не первый год следуют этой тактике. Около 75% пациентов со вторым типом СД получают инсулин и результат не заставил себя ждать: большинство из них – восемь из десяти – достигают уровня гликозилированного гемоглобина 7%. По данным эпидемиологических исследований в 18 регионах РФ, более половины из больных СД типа 2 имеют уровень HbA1c выше 8% и лишь в среднем 14% – получают инсулин в виде монотерапии или в комбинации со сахароснижающими таблетками.
Главным патогенетическим фактором в развитии и прогрессировании сосудистых осложнений, коронарного, церебрального атеросклероза, атеросклероза других сосудистых регионов у больных СД 2 типа является гипергликемия. В настоящее время жесткий контроль гликемии рассматривается как ведущая лечебная стратегия в профилактике развития и прогрессирования сосудистых осложнений. Имеющиеся в настоящий момент доказательства свидетельствуют о том, что постпрандиальное состояние – это фактор, способствующий развитию атеросклероза. При сахарном диабете 2 типа прандиальный период характеризуется быстрым и выраженным повышением глюкозы крови. Эпидемиологические и клинические исследования показали, что постпрандиальная гипергликемия является прямым и независимым фактором риска развития сердечно-сосудистых заболеваний. Многолетнее комплексное исследование NHANES (National Health and Nutrition Examination Surveys) в США показывает, что даже при удовлетворительной компенсации СД, по данным гликозилированного гемоглобина (НbА1с), часто встречается гипергликемия после еды. Европейское эпидемиологическое исследование DECODE (The Diabetes Epidemiology: Collaborative Analysis of Diagnostic Criteria in Europe, 2000) показало, что постпрандиальная гипергликемия более тесно коррелирует с увеличением общей смертности, чем тощаковая гипергликемия. Многочисленными исследованиями доказан возрастающий риск острых сосудистых нарушений на фоне постпрандиальной гипергликемии: значительно возрастает риск развития инфаркта миокарда и инсульта, которые обусловливают примерно 70% смертельных исходов у лиц, страдающих СД 2 типа. Этот доказанный и по-настоящему тревожный факт о разрушительном влиянии постпрандиальной гипергликемии в плане развития осложнений, стал существенным настолько, что Всемирная Федерация Диабета в сентябре 2007г. опубликовала специальные рекомендации по управлению постпрандиальной гипергликемией.
Таким образом, постпрандиальная гипергликемия становится обязательной частью стратегии по предотвращению развития и прогрессирования, в первую очередь, кардиоваскулярной патологии при сахарном диабете. Следует особо подчеркнуть, что важную роль в достижении постпрандиального гликемического контроля занимает инсулинотерапия.
Тесная связь между постпрандиальной гликемией и сердечно-сосудистой заболеваемостью и смертностью ставит перед клиницистами 2 задачи – обязательное мониторирование постпрандиальной гликемии (через 2 часа после еды) и использование с целью коррекции гликемии средств прандиальной регуляции. В последние годы показания к инсулинотерапии у больных СД 2 типа значительно расширились. В инсулинотерапии нуждаются около 50% больных СД 2 типа, в то время как инсулин в нашей стране получают не более 10-15% пациентов. В последнее время врачи все чаще и обоснованно применяют инсулинотерапию для снятия глюкозотоксичности и восстановления секреторной функции бета-клеток при умеренной гипергликемии.
К положительным эффектам инсулинотерапии у больных СД 2 типа следует отнести такие наиболее значимые, как:
– снижение гликемии натощак и постпрандиальной гликемии;
– снижение глюконеогенеза и продукции глюкозы печенью;
– стимуляция антиатерогенных изменений в профиле липопротеинов.
При описании современных режимов инсулинотерапии применяются следующие названия: «интенсивный, многоуровневый, постоянно меняющийся, функциональный, физиологический или базально-болюсный». СД – это хроническое заболевание с прогрессирующим течением, которое требует от больных изменения образа жизни и налагает ограничения на их ежедневную деятельность в связи с проводимой терапией и развитием осложнений. Эти факторы не могут не оказывать влияния на качество жизни пациентов. Поэтому при выборе лечения приоритет должен отдаваться таким препаратам инсулина и схемам терапии, которые не только способствуют достижению компенсации углеводного обмена, но и повышают удовлетворенность проводимой терапией и улучшают качество жизни пациентов. Интенсификация терапии возможна путем использования смесей НПХ инсулина и инсулина короткого действия (обычно 2 иньекции), однако наиболее физиологичным является контроль постпрандиальной гликемии. Одной из наиболее адекватных схем терапии являются иньекции аналогов инсулина короткого действия перед едой в сочетании с базальным инсулином.
С помощью генно-инженерной технологии были разработаны аналоги, моделируемые таким образом, чтобы они максимально соответствовали физиологическому профилю действия инсулина. Медицинская рациональность применения аналогов инсулина заключается в том, что они более близки к физиологическим параметрам динамики инсулина, что позволяет делать инъекции непосредственно во время приема пищи, а не за 20-40 минут до еды, наряду с улучшением постпрандиального гликемического контроля и в сочетании с низким риском развития поздней гипогликемии. Необходимо особо подчеркнуть, что в дополнение к известному делению инсулинов по началу и продолжительности действия – быстродействующий, короткодействующий, промежуточнодействующий, длительнодействующий, в настоящее время предлагается делить препараты инсулина в зависимости от физиологических принципов заместительной терапии:
– прандиальный инсулин;
– постабсорбционный инсулин.
Назначение пролонгированных аналогов инсулина оправдано как при СД 1 типа, так и при СД 2 типа. Основное отличие данных препаратов в отсутствии прироста массы тела на фоне проводимой терапии и снижении количества ночных гипогликемий. Немаловажной является необходимость введения данного аналога инсулина однократно в сутки.
Препарат ультрадлинного действия инсулин гларгин (Лантус, Санофи Авентис) зарегистрирован в Российской Федерации шесть лет назад. Гларгин был получен путем замены аспарагина в 21-м положении А-цепи на глицин, кроме этого были добавлены две молекулы аргинина в С-конец В-цепи в положении 31 и 32. Данные изменения привели к смещению изоэлектрической точки молекулы с рН 5,4 до 6,7, следовательно, уменьшилась растворимость препарата при физиологических значениях нейтральной среды подкожной клетчатки. Таким образом, гларгин полностью растворим в слабокислой среде, но плохо растворим в нейтральной среде подкожно-жировой клетчатки. После введения препарат вступает в реакцию нейтрализации с образованием микропреципитатов, из которых в дальнейшем происходит высвобождение гексамеров инсулина гларгина и их диссоциация с образованием димеров и мономеров инсулина. Это обеспечивает постепенный выход гормона в кровь и его циркуляцию в кровеносном русле в течение 24 ч, что позволяет вводить его 1 раз в сутки. Добавление небольшого количества цинка обеспечивает кристаллизацию инсулина гларгина в подкожной клетчатке, дополнительно удлиняя время абсорбции.
Все перечисленные особенности данного аналога инсулина обусловливают его плавный «беспиковый» профиль действия. Начало действия после подкожного введения – через 1 ч, устойчивая концентрация инсулина в крови достигается через 2-4 сут. после первого введения первой дозы. Независимо от времени введения лантуса (утром или вечером) и места введения (подкожная клетчатка руки, ноги или живота), средняя продолжительность действия составляет 24 ч, максимальная продолжительность – 29 ч. Аналог инсулина гларгин соответствует по эффективности воздействия физиологическому инсулину: стимулирует потребление глюкозы инсулинозависимыми периферическими тканями, особенно мышечной и жировой, ингибирует глюконеогенез и, таким образом, снижает содержание глюкозы крови. Кроме того, инсулин гларгин, подобно эндогенному инсулину, подавляет липолиз в адипоцитах и протеолиз, усиливая синтез белка.
В исследованиях фармакокинетики лантуса доказано практически беспиковое распределение препарата, что позволяет максимально точно имитировать «базальную» секрецию эндогенного инсулина в течение суток, значительно снижает риск гипогликемии и вариабельность концентрации глюкозы.
Говоря об усовершенствовании препаратов инсулина, целесообразно напомнить, что в идеале короткодействующий инсулин должен давать «живой» пик активности, сочетающийся с изменением уровня глюкозы в связи с приемом пищи и затем быстро исчезающий.
До недавнего времени самым эффективным прандиальным регулятором являлся инсулин короткого действия, подкожное введение которого перед принятием пищи позволяет предупредить резкий подъем уровня глюкозы. В настоящее время в связи с созданием инсулинов ультракороткого действия наступила новая эра – максимальной коррекции постпрандиальной гликемии. С позиции современных возможностей и перспективы на ближайшее время в качестве прандиальных инсулинов рекомендованы: инсулин лизпро (Хумалог), инсулин аспарт (Новорапид), инсулин глулизин (Апидра).
Инсулин глулизин (Апидра, Санофи Авентис) появился в практике здравоохранения в нашей стране относительно недавно, в связи с чем необходимо остановиться на его основных характеристиках.
Инсулин глулизин – это рекомбинантный быстро действующий аналог инсулина, который вырабатывается штаммом E. Coli K12 I35, экспрессирующими плазмиду рINT362d. Препарат был создан путем замены аспарагина в положении В3 человеческого инсулина на лизин и лизина в положении В29 глютаминовой кислотой (Lys (B3), Glu (B29) человеческий инсулин). Инсулин глулизин представляет собой стерильный прозрачный водный раствор, содержащий около 3,5 мг инсулина на мл, что соответствует 100 МЕ/мл человеческого инсулина.
Модификации химической структуры способствуют образованию стабильных мономеров, что обеспечивает быстрое всасывание препарата из подкожно-жировой клетчатки. Профиль фармакокинетики инсулина глулизин лучше имитирует физиологическую постпрандиальную секрецию инсулина по сравнению с человеческим инсулином короткого действия: более быстрое начало действия (через 5-15 минут), максимальный эффект (примерно через 60 минут) и более короткое время действия (около 4 часов). Это позволяет вводить инсулин глулизин непосредственно перед едой, что важно для всех пациентов с СД.
Важно отметить, что даже при введении больших доз инсулина глулизин действие его прекращается через 4,5 часа, что в значительной мере уменьшает риск гипогликемий в постабсорбтивном периоде и в ночное время.
Инсулин глулизин является мономерным препаратом, что обуславливает его более быстрое всасывание и достижение пика концентрации. Отличием глулизина от других аналогов инсулина ультракороткого действия является отсутствие цинка в качестве стабилизатора, способного снижать скорость действия препарата. Это позволяет лучше имитировать физиологическую секрецию инсулина после приема пищи и более эффективно контролировать постпрандиальную гликемию. Следует особенно отметить, что в отличие от инсулина лизпро быстрое начало действия инсулина глулизин не зависит от индекса массы тела и это особо значимо у пациентов с СД 2, подавляющее большинство которых имеет избыточный вес или ожирение.
По митогенной и метаболической активности глулизин не отличается от простого человеческого инсулина, что свидетельствует о возможности длительного безопасного его использования. В настоящее время глулизин проходит клинические испытания. Отмечено, что инсулин глулизин ассоциируется с более выраженным снижением уровня HbA1c по сравнению с простым человеческим инсулином у пациентов с сахарным диабетом 2 типа, обеспечивает эффективный гликемический контроль и хорошо переносится пациентами.
Таким образом, понимание относительного вклада гликемии натощак и постпрандиальной гликемии в общий контроль углеводного обмена позволит врачу более рационально выбирать схему инсулинотерапии, используя современные аналоги инсулина, которые обладают улучшенными фармакокинетическими и фармакодинамическими свойствами, дающими возможность максимально близко имитировать физиологическую секрецию инсулина и способствовать достижению компенсации углеводного обмена у пациентов с СД. Инсулин гларгин и инсулин глулизин являются оптимальной комбинацией для базис-болюсной терапии и применение доступных алгоритмов титрации (например, представленный в таблице 1) обоих препаратов облегчает перевод больных СД 2 типа на этот режим инсулинотерапии.
Таблица 1
Алгоритм титрации доз базального и прандиального инсулинов (заимствовано из S. Eldelman, G. Dailey et al. – A practical approach for implementation of a basal-prandial insulin therapy regimen in patients with type 2 diabetes)
| Уровни гликемии в течение 3 последовательных дней (тощаковая, препрандиальная или перед сном) | Коррекция дозы базального инсулина, Ед | Коррекция дозы прандиального инсулина, Ед |
| ³180 мг/дл (10 ммоль/л) | +8 | +3 |
| 160-180 мг/дл (8,9-10,0 ммоль/л) | +6 | +2 |
| 140-160 мг/дл (7,8-8,8 ммоль/л) | +4 | +2 |
| 120-140 мг/дл (6,8-7,7 ммоль/л) | +2 | +1 |
| 100-120 мг/дл (5,6-6,7ммоль/л) | +1 | без изменения |
| 80-100 мг/дл (4,5-5,5 ммоль/л) | без изменения | -1 |
| 60-80 мг/дл (3,3-4,4 ммоль/л) | -2 | -2 |
| <60 мг/дл (3,3 ммоль/л) | -4 | -4 |
| Комментарии | для коррекции тощаковой гликемии изменяется доза базального инсулина |
|
Родионова Т.И., Зарецкая И.В., Самитин В.В., Каргина Л.В.
Саратовский медицинский университет
Литература:
1. Анциферов М. Б. Применение аналогов инсулина (Лантус) иглулизин (Апидра) у больных сахарным диабетом: оптимальная комбинация для достижения целей лечения// Фарматека. 2007. Т. 157. № 3.
2. Шестакова М.В., Чугунова Л.А., Шамхалова М.Ш. Апидра – новый аналог инсулина для лечения сосудистых осложнений при сахарном диабете//Проблемы эндокринологии.2007.Т. 53. №3.С.35-38.
3. Bethel M. A., Feinglos M. N. Insulin analogues: new therapies for type 2 diabetes mellitus// Curr. Diab. Rep. 2002; 2: 403-408.
4. Fritsche A., Hoering H., Toegel E., Schweitzer M. HOE901/4001 Study Group. Treat-to-target with add-on basal insulin – can insulin glargin reduce the barrier to target attainment?// Diabetes. 2003; 52 (suppl.1): A119.
5. Malone J. L., Kerr L. F., Campaigne B. N. et al. For the Lispro Mixture-Glargine Study Group. Combined therapy with insulin Lispo Mix 75/25 plus metformin or inslulin glargine plus metformin: a 16-week, randomized, open-label, crossover study in patients with type 2 diabetes beginning insulin therapy// Clin. Ther. 2004; 26: 2034-2044.
6. Malone J. L., Bai S., Campaigne B. N. et al. Twice-daily pre-mixed insulin rather than basal insulin therapy alone results in better overall glycaemic control in patients with type 2 diabetes// Diabet.Med. 2005; 22: 374-381.
7. Rosenstock J., Schwarts S. L., Clark C. M. et al. Basal insulin therapy in type 2 diabetes: 28-week comparison of insulin glargin (HOE 901) and NPH insulin// Diabetes Care. 2001; 24: 631-636.
