Депонирование гликогена в печени при сахарном диабете
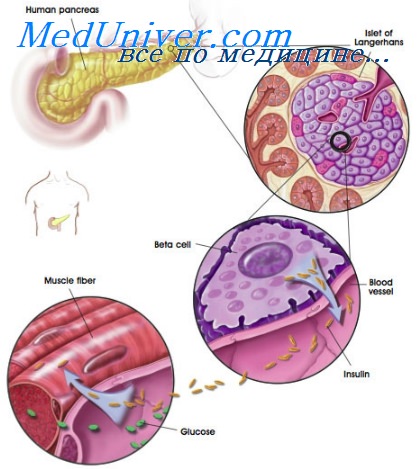
Гликоген — это форма накопления глюкозы в организме. Он не только обеспечивает запас энергии, но вносит вклад в синтез ряда гормонов. Храниться вещество либо в печени, либо в мышечной ткани, где концентрация гликогена ощутимо уменьшается только во время интенсивной физической нагрузки. Еще небольшое количество содержится в клетках почечной ткани, головного мозга и крови.

Что такое гликоген?
Гликоген — это полисахарид, образованный из остатков глюкозы, перерабатываемой организмом. Он же служит собой главным депо глюкозы в тканях. Из-за специфической химической структуры вещество называют «животным крахмалом». При снижении или полном отсутствии поступления глюкозы извне, запасов энергии хватит примерно на сутки. Распад гликогена до глюкозы происходит во время сна. Синтез его зависит от инсулина и концентрации глюкозы в плазме. Пока уровень показателей сахара не достигнет нормы, будет вырабатываться гликоген. Этот процесс зависит от слаженной работы нервной и эндокринной систем, так что сбои в их деятельности приведут к дефектам образования и распада гликогена, а также к неправильному питанию организма.
Вернуться к оглавлению
Зачем он нужен?
Главная функция гликогена — обеспечение организма энергией.
 Хранящийся в печени гликоген регулярно подвержен высвобождению и пополнению запасов.
Хранящийся в печени гликоген регулярно подвержен высвобождению и пополнению запасов.
Гликоген снабжает энергией все клетки организма. В случае нехватки сахара и энергии — ее источником послужит жир и белок. Сокращение глюкозы чревато снижением сопротивляемости иммунной системы. Сердце расходует приблизительно 25% топлива из глюкозы. Длительная нехватка гликогена способствует развитию булимии или анорексии, также сопровождается поражением сердечной мышцы, развитием дистрофии мышц. До 20% всей глюкозы потребляет мозг, обеспечивая ежедневную умственную деятельность. Возможны нарушения памяти, концентрации, зрения. При резком снижении концентрации гликогена, уровень серотонина также уменьшается, что провоцирует развитие депрессии.
Повышает риск развития ожирения организма и жировой трансформации внутренних органов избыток гликогена. Такое возможно, если количество поступающей глюкозы значительно превосходит расход энергии. Переизбыток вещества преобразовывается в жир и откладывается не только в подкожной клетчатке, но даже в органах человека. Это приводит к сгущению крови и нарушение доставки кислорода и питательных веществ к клеткам. Повышается риск поражения органов, воспалительных и онкологических процессов. Происходит значительное повышение массы, что сказывается на состоянии сосудов. Возможны развитие инфаркта, инсульта или сахарного диабета.
Вернуться к оглавлению
Что происходит с гликогеном при сахарном диабете?
 Гликоген является главным в формуле существования углеводов в организме человека.
Гликоген является главным в формуле существования углеводов в организме человека.
Сохраняется нехватка инсулина и излишек гликогена. Такой дисбаланс повышает распад жиров, снижает поглощение глюкозы, значительно увеличивает синтез триглицеридов. Свободные жирные кислоты захватываются печенью, усиливая распад гликогена. Эти факторы способствуют развитию жировой инфильтрации печени. Основой энергии служат уже не углеводы, а жиры, в меньшей степени белки. Из-за жировой инфильтрации печени, продукты их распада переходят в кровь. В большом количестве они изменяют кислотно-щелочной баланс в кислую сторону, что может привести к потере сознания и даже развитию комы. Защитные свойства организма также понижаются в связи с угнетением функций ретикуло-эндотелиальной системы. Интенсивное расщепление белков, мобилизованных из мышечной ткани, приводит к накоплению продуктов азотистого распада. В свою очередь, это негативно сказывается на работе почек.
Стеатонекроз часто формируется при диабете 2 типа, иногда до диагностирования нарушения толерантности к углеводам. Скопление коллагена в просвете между стенками кровеносных капилляров и клеток печени развивается при обоих типах. Нельзя исключить и возможность формирования цирроза печени. У пациентов, больных диабетом он встречается вдвое чаще, чем в популяции.
Вернуться к оглавлению
Методы решения
Снизить риск нежелательных осложнений поможет коррекция питания, снижения количества сладкого и мучного в ежедневном рационе, регулярные и адекватные физические нагрузки. Наилучшими источниками глюкозы считаются фрукты, в первую очередь финики и инжир, далее бобовые и цельнозерновые продукты. В случае наличия лишнего веса — похудейте, откажитесь от потребления алкогольных напитков. Коррекция образа жизни значительно снизит вероятность развития поражений печени, сахарного диабета и других заболеваний.
Влияние инсулина на обмен глюкозы в печени. Высвобождение глюкозы из печени
Одним из наиболее важных влияний инсулина является депонирование в печени всасываемой после приема пищи глюкозы в виде гликогена. В промежутках между приемами пищи, когда нет поступлений питательных веществ и концентрация глюкозы в крови начинает снижаться, параллельно быстро снижается секреция инсулина. Гликоген в печени начинает распадаться до глюкозы, которая высвобождается в кровь и препятствует падению концентрации глюкозы до слишком низкого уровня.
Механизм, с помощью которого инсулин обеспечивает поступление и депонирование глюкозы в печени, включает несколько почти одновременных этапов.
1. Инсулин инактивирует фосфорилазу печени— основной фермент, способствующий распаду гликогена печени до глюкозы. Это предупреждает распад гликогена, который в таком случае запасается в клетках печени.
2. Инсулин обеспечивает усиление поступления глюкозы из крови в клетки печени. Это достигается увеличением активности фермента глюкокиназы, являющейся одним из ферментов, инициирующих фосфорилирование глюкозы после ее диффузии в клетки печени. После фосфорилирования глюкоза временно остается как бы в ловушке в клетке печени, т.к. в такой форме она не может диффундировать обратно через клеточную мембрану.
3. Инсулин также увеличивает активность ферментов, обеспечивающих синтез гликогена, особенно гликогенсинтетазы, ответственной за полимеризацию моносахаридов — единиц, из которых образуется молекула гликогена.

Значение всех этих изменений заключается в увеличении содержания гликогена в печени. В целом содержание гликогена в печени при увеличении его синтеза может составить 5-6% массы печени, что соответствует приблизительно 100 г гликогена, составляющего депо гликогена в печени.
Глюкоза высвобождается из печени в промежутках между приемами пищи. Если уровень глюкозы в крови начинает снижаться до нижнего предела в промежутках между приемами пищи, это приведен к ряду изменений и послужит поводом для высвобождения глюкозы из печени в кровоток.
1. Снижение уровня глюкозы приводит к снижению секреции инсулина поджелудочной железой.
2. Отсутствие инсулина приведет к изменению направления реакций, нацеленных на создание запаса гликогена, главным образом к остановке дальнейшего синтеза гликогена в печени и предупреждению поступления глюкозы в печень из крови.
3. Отсутствие инсулина (параллельно с увеличением глюкагона, что будет рассмотрено далее) активирует фермент фосфорилазу, расщепляющую гликоген до глюкозофосфата.
4. Фермент глюкофосфатаза, ингибируемый инсулином, при отсутствии инсулина активируется и приводит к отщеплению фосфатного радикала от глюкозы, что позволяет свободной глюкозе вернуться в кровь.
Таким образом, печень забирает глюкозу из крови, когда в крови возникает ее избыток в связи с приемом пищи, и возвращает ее в кровь, когда концентрация глюкозы снижается в промежутках между приемами пищи. Обычно около 60% глюкозы пищи запасается таким способом в печени и в последующем возвращается в кровь.
Инсулин обеспечивает превращение избытка глюкозы в жирные кислоты и ингибирует глюконеогенез в печени.
Если поступление глюкозы превышает возможности запасания ее в виде гликогена или возможности ее локальных метаболических превращений в гепатоцитах, инсулин обеспечивает превращение избытка глюкозы в жирные кислоты. Жирные кислоты впоследствии в виде триглицеридов переводятся в липопротеины очень низкой плотности и в таком виде транспортируются кровью в жировую ткань, где депонируются в виде жира.
Инсулин также тормозит глюконеогенез. Это достигается снижением как количества, так и активности ферментов, необходимых для глюконеогенеза. Однако эти эффекты частично вызваны снижением высвобождения аминокислот из мышц и других внепеченочных тканей и вследствие этого — снижением необходимого для глюконеогенеза сырья. Это будет обсуждаться далее в связи с влиянием инсулина на обмен белка.
– Также рекомендуем “Инсулин и глюкоза мозга. Влияние инсулина на обмен жиров”
Оглавление темы “Функции и секреция инсулина”:
1. Адреногенитальный синдром. Выработка инсулина поджелудочной железой
2. Структура инсулина. Синтез инсулина
3. Физиология инсулина. Воздействие инсулина на клетку
4. Влияние инсулина на обмен углеводов. Обмен глюкозы под действием инсулина
5. Влияние инсулина на обмен глюкозы в печени. Высвобождение глюкозы из печени
6. Инсулин и глюкоза мозга. Влияние инсулина на обмен жиров
7. Причины кетоза и ацидоза. Влияние инсулина на обмен белка
8. Влияние инсулина на рост. Механизм секреции инсулина
9. Регуляция выделения инсулина. Стимуляция секреции инсулина
10. Влияние аминокислот и гормонов на секрецию инсулина. Инсулин в углеводно-жировом обмене
Инсулин и глюкагон, одновременно и противоположно действуя на обмен энергосубстратов (углеводов, белков и жиров), обеспечивают, с одной стороны, быстрое депонирование в организме энергосубстратов, поступающих в кровь после приема пищи; с другой стороны, после завершения процессов пищеварения (так называемое постабсорбционное состояние, начинающееся через 5—6 часов после еды) эта пара гормонов регулирует доставку энергосубстратов из депо к клеткам организма (табл.) и поддерживает гликемию на стабильном уровне, достаточном для снабжения клеток мозга глюкозой. Мозг потребляет до 60% глюкозы, продуцируемой в базальном состоянии.
Депо для энергосубстратов служат самые массивные в организме ткани — печеночная (запасы углеводов в виде гликогена), жировая (депонирование жира; наиболее пластичное и специализированное депо) и мышечная (запасы белка), которые являются органами-мишенями инсулина и потому называются инсулинозависимыми тканями. При этом мышцы и жировую ткань обычно объединяют в группу периферических инсулинозависимых тканей-депо, а печеночную, соответственно, считают центральной.
В так называемом абсорбтивном состоянии (в течение 5—6 часов с момента приема пищи) инсулин обеспечивает депонирование поступающих с пищей энергетических субстратов в инсулинозависимых тканях. Под действием инсулина стимулируется депонирование глюкозы в печени в виде гликогена, а в мышечной и жировой тканях активируется транспорт глюкозы через клеточную мембрану. Кроме того, инсулин подавляет катаболизм гликогена в печени, жира в адипоцитах и белка в мышечных тканях. Все это снижает постпрандиальную гликемию и способствует накоплению белков, жиров и гликогена в организме, которые затем расходуются в качестве энергосубстратов между приемами пищи и в процессе голодания.
Таблица
Физиологические согласованные эффекты пары гормонов инсулин/глюкагон на постпрандиальный и базальный метаболизм
Ткани
Секреция инсулина
стимулирована, а глюкагона подавлена
(постпрандиальное состояние)
Секреция инсулина
подавлена, а глюкагона стимулирована
(состояние натощак)
Печень
Глюкоза поглощается из крови
Гликоген синтезируется
Липогенез
Кетогенеза нет
Глюконеогенеза нет
Глюкоза продуцируется в кровь
Гликогенолиз
Липогенеза нет
Кетогенез
Глюконеогенез
Мышцы
Глюкоза поглощается из крови
Глюкоза окисляется в мышцах
Гликоген синтезируется
Синтез белка наблюдается
Поглощения глюкозы нет
Жирные кислоты, кетоны окисляются
Гликогенолиз
Протеолиз и выход в кровь аминокислот
Жировая ткань
Поглощение глюкозы из крови
Синтез липидов
Поглощение триглицеридов
Поглощения глюкозы нет
Липолиз и выход в кровь жирных кислот
Поглощения триглицеридов нет
В постабсорбтивном состоянии (через 5—6 часов после еды) и во время голодания концентрации инсулина и глюкозы крови снижаются до такого уровня, что, с одной стороны, инсулинозависимые ткани (депо энергосубстратов) прекращают поглощать глюкозу, а с другой стороны, снимается в них блокирующее действие инсулина на катаболизм гликогена (печень), жиров (адипоциты) и белков (мышцы). В результате распада в печени гликогена в кровь из печени поступает глюкоза, которая непосредственно используется тканями как готовый к утилизации энергосубстрат. Катаболизм жира в жировой ткани активизирует поступление в кровь жирных кислот и глицерина, которые не могут непосредственно использоваться в энергообмене, и потому печень преобразует жирные кислоты в более мелкие и утилизируемые клетками молекулы — кетоновые тела (печеночный кетогенез), а из глицерина печень синтезирует молекулы глюкозы (глюконеогенез). Кетоновые тела и глюкоза используются клетками организма как энергосубстраты при голодании. Аналогично и аминокислоты, образующиеся в процессе катаболизма белков, поступают из мышечных клеток в кровь и не могут использоваться клетками как энергосубстраты, и потому печень их трансформирует в глюкозу (глюконеогенез).
Таким образом, в отличие от других тканей-депо энергосубстратов печень в энергообмене выступает не только как орган, депонирующий глюкозу в виде гликогена, и как поставщик глюкозы из запасов гликогена, но и как своеобразный преобразователь продуктов катаболизма жиров (СЖК и глицерин) и белков (аминокислоты) в молекулы, пригодные для непосредственной утилизации клетками (кетоновые тела и глюкозу).
Следует заметить, что пул свободной глюкозы в организме (а именно в крови, межклеточном пространстве и внутри клеток) очень ограничен и составляет всего 15—20 г. Но и запасы гликогена в печени не превышают 130 г. В результате запасов глюкозы на метаболические нужды организма хватает не более чем на 8 часов. Отсюда очевидна важная роль печеночного глюконеогенеза в поддержании стабильного уровня глюкозы крови, особенно в период ночного голодания, натощак.
Органом-мишенью для глюкагона в процессе регуляции энергообмена является печень. Снижение гликемии до препрандиального и/или тощакового уровня стимулирует секрецию глюкагона, который, в свою очередь, стимулирует распад гликогена печени, что увеличивает продукцию глюкозы печенью. Кроме того, он стимулирует глюконеогенез и кетогенез, активируя продукцию глюкозы и кетоновых тел печенью, когда исчерпываются запасы в ней гликогена.
Содружественную и взаимопротивоположную секрецию инсулина и глюкагона регулирует гликемия — ее рост выше тощаковых значений стимулирует секрецию инсулина и подавляет секрецию глюкагона. И наоборот, понижение гликемии до тощаковых значений или ниже стимулирует секрецию глюкагона и подавляет секрецию инсулина. В результате повышение уровня инсулина после приема пищи стимулирует поглощение глюкозы из крови инсулинозависимыми тканями-депо, а содружественное снижение глюкагона подавляет распад гликогена в печени, и, соответственно, поступление глюкозы из печени в кровь снижается. Совместное действие инсулина и глюкагона, направленное на снижение постпрандиальной гликемии, приводит к тому, что при обычном смешанном питании гликемия после еды повышается очень незначительно и быстро, в течение часа, достигает тощаковых значений.
И наоборот, при перерыве в приеме пищи более 4—6 часов, например в ночное время, организму необходимо предотвращать снижение гликемии ниже критического уровня, нарушающего адекватное снабжение мозга (инсулиннезависимой ткани) глюкозой. Иначе нарушится его функционирование и разовьется гипогликемический синдром. Единственный поставщик в организме глюкозы во время голодания — печень. В первые часы голодания глюкоза образуется из запасов гликогена в печени (гликогенолиз), распад которого стимулирует глюкагон. После исчерпания запасов гликогена глюкоза синтезируется печенью из аминокислот и свободных жирных кислот крови (глюконеогенез), которые в повышенных количествах поступают в кровь из мышц и жировой ткани. Распад белка в мышцах и жира в жировой ткани стимулируется снижением концентрации в крови инсулина до тощаковых значений.
Метаболические нарушения при сахарном диабете (инсулиновой недостаточности) представляют собой выраженную степень голодания, когда секреция инсулина крайне снижена, а секреция глюкагона повышена. Но в отличие от физиологического голодания при сахарном диабете уровень дефицита инсулина настолько выражен, что это приводит к такому массивному поступлению в кровь энергосубстратов из депо (печень, мышцы и жировая ткань), что их не в состоянии полностью утилизировать ткани-потребители этих энергосубстратов. В итоге кровь наводняется энергосубстратами (глюкоза и кетоновые тела в первую очередь) до такой степени, что включаются механизмы их выведения из организма (глюкозурия, кетонурия, кетоны в выдыхаемом воздухе). И когда эти механизмы не компенсируют массивное поступление энергосубстратов в кровь, то развиваются патологические метаболические состояния, приводящие к смерти, — диабетический кетоацидоз, гиперосмолярность и т.п.
Возврат к списку
Инсулин и глюкагон, одновременно и противоположно действуя на обмен энергосубстратов (углеводов, белков и жиров), обеспечивают, с одной стороны, быстрое депонирование в организме энергосубстратов, поступающих в кровь после приема пищи; с другой стороны, после завершения процессов пищеварения (так называемое постабсорбционное состояние, начинающееся через 5—6 часов после еды) эта пара гормонов регулирует доставку энергосубстратов из депо к клеткам организма (табл.) и поддерживает гликемию на стабильном уровне, достаточном для снабжения клеток мозга глюкозой. Мозг потребляет до 60% глюкозы, продуцируемой в базальном состоянии.
Депо для энергосубстратов служат самые массивные в организме ткани — печеночная (запасы углеводов в виде гликогена), жировая (депонирование жира; наиболее пластичное и специализированное депо) и мышечная (запасы белка), которые являются органами-мишенями инсулина и потому называются инсулинозависимыми тканями. При этом мышцы и жировую ткань обычно объединяют в группу периферических инсулинозависимых тканей-депо, а печеночную, соответственно, считают центральной.
В так называемом абсорбтивном состоянии (в течение 5—6 часов с момента приема пищи) инсулин обеспечивает депонирование поступающих с пищей энергетических субстратов в инсулинозависимых тканях. Под действием инсулина стимулируется депонирование глюкозы в печени в виде гликогена, а в мышечной и жировой тканях активируется транспорт глюкозы через клеточную мембрану. Кроме того, инсулин подавляет катаболизм гликогена в печени, жира в адипоцитах и белка в мышечных тканях. Все это снижает постпрандиальную гликемию и способствует накоплению белков, жиров и гликогена в организме, которые затем расходуются в качестве энергосубстратов между приемами пищи и в процессе голодания.
Таблица
Физиологические согласованные эффекты пары гормонов инсулин/глюкагон на постпрандиальный и базальный метаболизм
Ткани | Секреция инсулина стимулирована, а глюкагона подавлена (постпрандиальное состояние) | Секреция инсулина подавлена, а глюкагона стимулирована (состояние натощак) |
Печень | Глюкоза поглощается из крови Гликоген синтезируется Липогенез Кетогенеза нет Глюконеогенеза нет | Глюкоза продуцируется в кровь Гликогенолиз Липогенеза нет Кетогенез Глюконеогенез |
Мышцы | Глюкоза поглощается из крови Глюкоза окисляется в мышцах Гликоген синтезируется Синтез белка наблюдается | Поглощения глюкозы нет Жирные кислоты, кетоны окисляются Гликогенолиз Протеолиз и выход в кровь аминокислот |
Жировая ткань | Поглощение глюкозы из крови Синтез липидов Поглощение триглицеридов | Поглощения глюкозы нет Липолиз и выход в кровь жирных кислот Поглощения триглицеридов нет |
В постабсорбтивном состоянии (через 5—6 часов после еды) и во время голодания концентрации инсулина и глюкозы крови снижаются до такого уровня, что, с одной стороны, инсулинозависимые ткани (депо энергосубстратов) прекращают поглощать глюкозу, а с другой стороны, снимается в них блокирующее действие инсулина на катаболизм гликогена (печень), жиров (адипоциты) и белков (мышцы). В результате распада в печени гликогена в кровь из печени поступает глюкоза, которая непосредственно используется тканями как готовый к утилизации энергосубстрат. Катаболизм жира в жировой ткани активизирует поступление в кровь жирных кислот и глицерина, которые не могут непосредственно использоваться в энергообмене, и потому печень преобразует жирные кислоты в более мелкие и утилизируемые клетками молекулы — кетоновые тела (печеночный кетогенез), а из глицерина печень синтезирует молекулы глюкозы (глюконеогенез). Кетоновые тела и глюкоза используются клетками организма как энергосубстраты при голодании. Аналогично и аминокислоты, образующиеся в процессе катаболизма белков, поступают из мышечных клеток в кровь и не могут использоваться клетками как энергосубстраты, и потому печень их трансформирует в глюкозу (глюконеогенез).
Таким образом, в отличие от других тканей-депо энергосубстратов печень в энергообмене выступает не только как орган, депонирующий глюкозу в виде гликогена, и как поставщик глюкозы из запасов гликогена, но и как своеобразный преобразователь продуктов катаболизма жиров (СЖК и глицерин) и белков (аминокислоты) в молекулы, пригодные для непосредственной утилизации клетками (кетоновые тела и глюкозу).
Следует заметить, что пул свободной глюкозы в организме (а именно в крови, межклеточном пространстве и внутри клеток) очень ограничен и составляет всего 15—20 г. Но и запасы гликогена в печени не превышают 130 г. В результате запасов глюкозы на метаболические нужды организма хватает не более чем на 8 часов. Отсюда очевидна важная роль печеночного глюконеогенеза в поддержании стабильного уровня глюкозы крови, особенно в период ночного голодания, натощак.
Органом-мишенью для глюкагона в процессе регуляции энергообмена является печень. Снижение гликемии до препрандиального и/или тощакового уровня стимулирует секрецию глюкагона, который, в свою очередь, стимулирует распад гликогена печени, что увеличивает продукцию глюкозы печенью. Кроме того, он стимулирует глюконеогенез и кетогенез, активируя продукцию глюкозы и кетоновых тел печенью, когда исчерпываются запасы в ней гликогена.
Содружественную и взаимопротивоположную секрецию инсулина и глюкагона регулирует гликемия — ее рост выше тощаковых значений стимулирует секрецию инсулина и подавляет секрецию глюкагона. И наоборот, понижение гликемии до тощаковых значений или ниже стимулирует секрецию глюкагона и подавляет секрецию инсулина. В результате повышение уровня инсулина после приема пищи стимулирует поглощение глюкозы из крови инсулинозависимыми тканями-депо, а содружественное снижение глюкагона подавляет распад гликогена в печени, и, соответственно, поступление глюкозы из печени в кровь снижается. Совместное действие инсулина и глюкагона, направленное на снижение постпрандиальной гликемии, приводит к тому, что при обычном смешанном питании гликемия после еды повышается очень незначительно и быстро, в течение часа, достигает тощаковых значений.
И наоборот, при перерыве в приеме пищи более 4—6 часов, например в ночное время, организму необходимо предотвращать снижение гликемии ниже критического уровня, нарушающего адекватное снабжение мозга (инсулиннезависимой ткани) глюкозой. Иначе нарушится его функционирование и разовьется гипогликемический синдром. Единственный поставщик в организме глюкозы во время голодания — печень. В первые часы голодания глюкоза образуется из запасов гликогена в печени (гликогенолиз), распад которого стимулирует глюкагон. После исчерпания запасов гликогена глюкоза синтезируется печенью из аминокислот и свободных жирных кислот крови (глюконеогенез), которые в повышенных количествах поступают в кровь из мышц и жировой ткани. Распад белка в мышцах и жира в жировой ткани стимулируется снижением концентрации в крови инсулина до тощаковых значений.
Метаболические нарушения при сахарном диабете (инсулиновой недостаточности) представляют собой выраженную степень голодания, когда секреция инсулина крайне снижена, а секреция глюкагона повышена. Но в отличие от физиологического голодания при сахарном диабете уровень дефицита инсулина настолько выражен, что это приводит к такому массивному поступлению в кровь энергосубстратов из депо (печень, мышцы и жировая ткань), что их не в состоянии полностью утилизировать ткани-потребители этих энергосубстратов. В итоге кровь наводняется энергосубстратами (глюкоза и кетоновые тела в первую очередь) до такой степени, что включаются механизмы их выведения из организма (глюкозурия, кетонурия, кетоны в выдыхаемом воздухе). И когда эти механизмы не компенсируют массивное поступление энергосубстратов в кровь, то развиваются патологические метаболические состояния, приводящие к смерти, — диабетический кетоацидоз, гиперосмолярность и т.п.
Возврат к списку
При возникновении сахарного диабета под ударом оказываются органы-мишени – печень, почки, головной мозг, что ведет к нарушению их функциональности. Печень – это фильтр организма, через нее проходит кровь, в ней распадается инсулин. У 95% диабетиков имеются различные отклонения в работе железы, что доказывает тесную взаимосвязь между гипергликемией и патологиями железы.
При СД наблюдаются расстройства метаболизма белков, аминокислот, в ходе липолиза тормозится инсулин, замедляется расщепление липидов, возрастает концентрация жирных кислот, что провоцирует выраженное воспаление.
Рассмотрим, какие происходят изменения в печени при разных типах диабета, самые распространенные заболевания железы у диабетиков.
Печень диабетиков
При нарушении утилизации глюкозы в первую очередь страдает печень. Диабет – это хроническая патология эндокринного характера, сопровождающаяся нарушением работы поджелудочной железы, а печень – фильтр, пропускающий кровь, разрушающий инсулин.
Патологические преобразования в печени
При СД у пациентов выявляется патологическое преобразование белкового метаболизма, аминокислот, происходят другие нарушения.
Когда организм начинает бороться, затормаживается инсулин в процессе липолиза.
Липиды расщепляются бесконтрольно. У больного формируется много свободных липидных кислот, что ведет к воспалению.
Этот негативный процесс в организме подтверждает, что сахарный диабет и печень тесно взаимосвязаны друг с другом.
Изменения при СД 1 и 2
В одних картинах поражение железы на фоне СД – это самостоятельное заболевание, а иногда следствие гепатоцеллюлярной карциномы (рака злокачественной природы).
При СД 1 орган увеличивается в размере, пальпация доставляет болезненные ощущения. У больного периодически проявляются симптомы как тошнота, рвота, боль в боку. Это обусловлено гепатомегалией, которая выступает следствием продолжительного ацидоза.
В гепатомегалии ведет высокая концентрация гликогена. Когда сахар выше нормы, введение инсулина еще больше увеличивает уровень гликогена, поэтому на начальных этапах терапии печень увеличивается. Воспаление может спровоцировать фиброзные изменения. В тканях протекают преобразования необратимой природы, снижается функциональность органа.
Если больной не лечится, отказывается от препаратов для понижения глюкозы (Метформин и др.), то гибнут гепатоциты, развивается цирроз, который характеризуется резистентностью к инсулину.
При СД 2 также выявляется гепатомегалия, края органа заостренные, болевой синдром на ранних стадиях отсутствует. Заболевание прогрессирует медленно. Увеличение железы обусловлено избыточным отложением липидов в печеночных клетках.
Часто нарушение утилизации сахара в крови начинается с ожирения, хотя нарушения функциональности поджелудочной железы может и не быть. Больные жалуются на слабость, хроническую утомляемость, сухость в ротовой полости, частые походы в туалет.
При декомпенсации СД 2 возникают заболевания, связанные с отклонением печеночных ферментов. Развивается воспалительный процесс, стеатоз, острая форма печеночной недостаточности, гепатоцеллюлярная карцинома.
В детском возрасте
Если ребенок страдает диабетом, то в 80% случаев диагностируют гепатомегалию, что обусловлено жировой инфильтрацией или чрезмерным отложением гликогена. Пункционная биопсия показывает, что в органе произошли незначительные липидные преобразования, но концентрация гликогена в разы выше нормы.
Иногда увеличение печени в размере приводит к осложнениям у детей. Это задержка роста, ожирение, стойкая гиперемия лица. Возможно развитие портальной гипертензии, увеличение селезенки; печеночная недостаточность не выявляется.
Показатели функциональности железы
Как влияет сахарный диабет на печень? На фоне компенсированного заболевания функциональность печени в норме (чаще всего). Иногда диагностируют у пациента отклонения в работе железы, но они не всегда связаны с высоким уровнем сахара, имеют другие причины развития.
При возникновении кетоацидоза растет содержание билирубина. При компенсированном СД билирубин в пределах нормы.
У многих диабетиков проявляется жировой гепатоз печени, определяются изменения показателей – активность трансаминаз, уровень щелочной фосфатазы, ГГТП.
Выраженность увеличения печени, базирующегося на возрастании гликогена при СД 1 либо жировых преобразованиях при СД 2, не взаимосвязана с функциональными печеночными показателями.
Жировое перерождение и СД
Печень при сахарном диабете – орган-мишень. Она хранит и перерабатывает сахар, выступает хранилищем для глюкозы, поддерживает требуемое содержание сахара в организме.
Железа и глюкоза
При потреблении пищи железа запасает сахар в виде гликогена, чтобы использовать в тех случаях, когда это потребуется организму. Высокий уровень гормона инсулина и глюкагона во время приема пищи способствует трансформации сахара в гликоген. Организм запрограммирован таким образом, что начинает вырабатывать глюкозу при ее снижении в крови.
Поэтому когда человек не употребляет пищу (например, ночью), то организм справляется самостоятельно, начинает продуцировать глюкозу сам. Вследствие гликогенолиза осуществляется преобразование гликогена в сахар.
Когда для выработки достаточного количества глюкозы не хватает гликогена, то организм все равно старается снабжать глюкозой органы, которым она необходима. Одновременно с этим процессом печень синтезирует «альтернативное топливо». Это кетоны, которые производятся на основе липидов.
Сигналом для формирования кетонов выступает низкая концентрация инсулина. Кетоны сжигаются, чтобы сэкономить резервный запас глюкозы для тех органов, которые больше всего нуждаются (мозг).
Нередко высокое содержание сахара утром у диабетиков второго типа – это итог интенсивного глюконеогенеза за ночь. Высокий уровень кетонов – малораспространенная, однако опасная проблема, требующая помощи медицинского специалиста.
Жировой гепатоз как фактор риска
Клинические исследования показывают, что жировой гепатоз бывает независимым фактором риска при диабете 2 типа. Ученые обнаружили, что у пациентов с жировой болезнью железы увеличивается риск нарушения утилизации сахара.
Жировой гепатоз можно определить посредством ультразвукового исследования. Он может предсказывать раннее развитие СД вне зависимости от содержания инсулина в организме.
Иногда жировая болезнь характеризуется бессимптомным течением, но в некоторых случаях развивается стремительно, что чревато печеночной недостаточностью. Гепатоз нередко ассоциируют с алкогольным заболеванием печени, но может быть другая этиология.
Влияние на инсулинорезистентность
Исследователи рассмотрели соотношение жировых преобразований в печени с вероятностью возникновения СД у людей. В начале исследования и спустя 5 лет врачи измерили уровень инсулина, глюкозы и функциональные показатели печени у группы добровольцев.
В начале исследования только у 27% диагностировали жировую болезнь. У 60% было ожирение, но без гепатоза. У 50% с жировой инфильтрацией выявили повышение инсулина. В последующем у 1% без гепатоза появился диабет, и у 4% с гепатозом.
Так, жировая болезнь увеличивает вероятность развития СД 2 типа. Поэтому пациентам с таким диагнозом рекомендуется соблюдать диету, постоянно контролировать показатели глюкозы, ограничить потребление легкоусвояемых углеводов, сахара, наносящих существенный вред организму.
СД и циррозное поражение
Цирроз печени при диабете – частое явление. СД – это патология, при которой нарушается функциональность поджелудочной железы – орган регулирует обмен и расщепление глюкозы.
Поэтому печень и диабет связаны, поскольку заболевание повышает риск развития цирроза.
Спровоцировать возникновение цирроза могут другие причины:
- Неправильное питание.
- Злоупотребление алкогольной продукцией.
- Ожирение.
- Другие функциональные нарушения железы.
На фоне СД поджелудочная и печень работают с повышенной нагрузкой. Со временем функциональность снижается, потому что истощаются ресурсы. Доминирующий разрушающий фактор – глюкоза, которая в организме до конца не перерабатывается. А непереработанные углеводы трансформируются в липиды, цикл повторяется снова и снова.
Чрезмерное содержание липидов провоцирует жировую инфильтрацию. Железа проходит такие стадии:
- Стеатоз.
- Стеатогепатит (воспаление в железе вследствие жирового перерождения).
- Фиброзные преобразования.
- Циррозное поражение.
Вся эта цепочка выявляется, когда отсутствует адекватное лечение СД. Надо убирать провоцирующий фактор – диабет. Для этого назначают правильное питание, исключают потребление сахара (можно заменить фруктозой без риска декомпенсации заболевания), физическую активность, прием лекарств, понижающих сахар.
На фоне цирроза у больного незначительно увеличивается температура тела (держится в пределах субфебрилитета), наблюдается желтушность кожи различной степени выраженности, гепатомегалия, сосудистые звездочки.
Первый тип
Когда начато своевременное лечение, риски небольшие. Но на ранних стадиях (когда только назначили терапию), проявляется гепатомегалия, имеет свойство усугубляться. Это обусловлено скоплением гликогена, его концентрация растет на первых порах применения инсулина. После все нормализуется.
Когда СД не поддается терапии, либо пациент сознательно игнорирует назначения доктора, гепатоциты разрушаются, разрастаются соединительные ткани, наблюдается цирроз.
Второй тип
При диабете 2 типа цирроз – следствие скопления липидов. При правильном и адекватном лечении негативные последствия в виде циррозного поражения сводятся к нулю. Поэтому пациент должен соблюдать ежедневную профилактику, состоящую в диете, спорте, постоянном контроле сахара. Обязательно надо принимать сахароснижающие таблетки.
Заболевания печени у диабетиков
СД – серьезная болезнь, поскольку протекает в хронической форме, грозит осложнениями со стороны всех органов и систем.
Диабет находится на шестом месте по причине смертности, и обуславливает около 17% летальных исходов у лиц старше 25-летнего возраста.
Одной из причин высокого уровня смертности являются недуги печени, вследствие которых нарушается обмен белков, аминокислот, липидов и пр. веществ в печеночных клетках.
Гепатоцеллюлярная карцинома
Это печеночно-клеточный рак, который отличается стремительным течением, быстрым прогрессированием. Прогноз плохой. Распространенность ГК среди пациентов с СД в 4 раза выше, чем у лиц с другими хроническими патологиями.
Патологический процесс, который ведет к ГК, происходит в такой последовательности:
- Инсулинорезистентность.
- Увеличенный липолиз.
- Скопление жиров в печеночных клетках.
- Поражение гепатоцитов.
- Фиброз и клеточная пролиферация.
- Злокачественное поражение.
Клиника заболевания характеризуется стремительным ухудшением самочувствия больного. У него резко снижается масса тела, проявляется вялость, слабость. В начале развития симптомами предвестниками выступают: дискомфорт в животе, периодическая боль в области правого подреберья. Болевой синдром усиливается постепенно, причиной этому является растяжение капсулы печени.
Быстро увеличивается печень в размере, при пальпации нижний край органа расположен около пупка. Заподозрить рак можно во время пальпации – пальпируемое содержимое неотделимо, подвижно. Это характерные признаки карциномы.
Поздние симптомы связаны с возникшими осложнениями – скопление жидкости в брюшной полости, пожелтение кожного покрова, белков глаз, появление видимых вен на животе.
ГК – прогрессирующее заболевание с негативным прогнозом. Он базируется на степени дифференциации раковых клеток, обусловлен вариантом течения, своевременностью выявления болезни.
Острая форма печеночной недостаточности
Заболевание диагностируют у ¼ диабетиков. Сахарный диабет – не единственный фактор риска, к другим относят медикаментозные препараты, фиброз, цирроз.
Под острой печеночной недостаточностью врачи подразумевают комплекс симптомов, который развивается при преобразованиях паренхимы с нарушением ее функциональности.
У диабетиков проявляется клиника:
- Энцефалопатия печеночной формы. Она сопровождается нарушением сна, эмоциональной нестабильностью, слабостью.
- Диспепсические нарушения (тошнота, рвота, понос).
- Отечность конечностей.
- Выраженное пожелтение кожного покрова.
- Лихорадочное состояние.
- Нарушения со стороны нервной системы – головокружения, головная боль, замедление речи, галлюцинации.
При отсутствии лечения наступает печеночная кома. Ее предвестниками является специфический сладковатый запах из ротовой полости, сильная боль в области правого подреберья, уменьшение железы в размере.
Вирусный гепатит C
По сравнению с общей популяцией распространение вирусной патологии среди диабетиков 1 и 2 типа выше. На фоне вирусного гепатита чаще возникает СД 2.
В большинстве картин ВГС протекает бессимптомно, желтуха отсутствует, вследствие чего болезнь диагностируют поздно, когда у пациента развилось циррозное поражение либо злокачественная гепатоцеллюлярная карцинома.
Период инкубации варьируется от 2 до 24 недель. Иногда инкубационный период 26 недель. Острая фаза часто протекает бессимптомно, из-за чего болезнь переходит в хроническую форму.
Клинически заболевание проявляется симптомами:
- Слабость, апатия.
- Ухудшение аппетита.
- Тяжесть в эпигастральной области.
- Тошнота, рвота.
- Нарушение работы пищеварительного тракта.
- Лихорадочное состояние (редко).
- Температура поднимается до 37-38 градусов, стойко держится.
Интенсивность той или иной симптоматики обусловлена концентрацией вируса в крови больного, общего иммунного статуса. Чаще клиника незначительна, поэтому пациенты не придают ей большого значения. ВГС распространен среди пациентов с диабетом, поэтому обосновано всем диабетикам с увеличенной концентрацией АЛТ назначать исследование на вирус гепатита C.
