Дислипидемия при сахарном диабете 2 типа что это
Нормы показателей липидов и липопротеинов крови зависят от индивидуального сердечно-сосудистого риска человека:
ТГ у всех должны быть < 1,7 ммоль/л, ЛВП у мужчин > 1,0 ммоль/л, а у женщин > 1,2 ммоль/л.
Осложнения ДЛ связаны с развитием атеросклероза. Считается, что его первичные проявления в виде липидных полосок у значимой части населения формируются ещё в подростковом и молодом возрасте. В дальнейшем прогноз зависит от активности атерогенеза и целостности атеросклеротических бляшек. При отсутствии тромботической деструкции этих бляшек и гемодинамически не значимом атеросклерозе качество и продолжительность жизни не изменятся.
Если атеросклероз приобретёт стенозирующий характер (обычно это происходит при сужении сосуда более чем на 75%), то появляются клинические проявления в той области, которую кровоснабжают эта артерия: ишемия головного мозга, миокарда, нижних конечностей и т. д.
Если же произойдёт разрыв атеросклеротической бляшки, то сформируется тромб или тромбоэмболия с возможным развитием инфаркта миокарда или мозгового инсульта.
Диагностика начинается со сбора анамнеза (истории болезни) и выяснения жалоб. Если у кровных родственников отмечалась ранняя смерть от сердечно-сосудистых заболеваний или сердечно-сосудистые события, необходимо проверить липидный спектр пациента. Жалобы при ДЛ появляются на клинических стадиях атеросклероза и говорят о далеко зашедшем заболевании.
При подозрении на семейно-генетическую ДЛ целесообразно проведение генетического анализа крови для выявления генов, отвечающих за развитие наследственной ДЛ, в том числе и у близких родственников пациента.
В клинической практике ДЛ диагностируют лабораторным способом. О заболевании свидетельствует превышение референсных значений в повторных анализах крови. Для определения показателей липидов и липопротеидов крови используется ряд формул:
- формула Фридвальда (верна, пока уровень ТГ не выше 4,5 ммольл);
- формула Климова или коэффициент (индекс) атерогенности;
- соотношение атерогенных и антиатерогенных апобелков.
В последние годы широко используется такой показатель, как холестерин-не-липопротеины высокой плотности (ХС-не-ЛПВП), который определяется по формуле: ХС − ЛВП.
Важно выявлять сопутствующие заболевания ДЛ, такие как сахарный диабет, ожирение, метаболический синдром и другие эндокринные дисфункции.
При правильной интерпретации лабораторных показателей диагностика ДЛ чаще всего не вызывает трудности. Сложнее проводить дифференциальную диагностику между различными ДЛ (первичная, вторичная, приобретённая, семейная).
Лечение ДЛ начинаются с немедикаментозных мероприятий, таких как:
- рационализация питания;
- оптимизация массы и параметров тела;
- повышение физической активности;
- отказ от хронических интоксикаций.[8]
При недостаточной эффективности немедикаментозных мероприятий показано назначение лекарственных средств гиполипидемического и антисклеротического действия, подобранных пациенту с учётом индивидуального общего сердечно-сосудистого риска.
В клинической практике используется последние генерации фибратов:
- ципрофибрат («Липанор») по 100 мг 1-2 раза в сутки;
- фенофибрат («Липантил-М») по 200 мг в сутки;
- новая лекарственная форма фенофибрата («Трайкор») по 145 мг в сутки.
Препараты никотиновой кислоты в клинической практике применяют редко из-за большого количества нежелательных явлений и отсутствия положительного влияния на прогноз. Секвестранты желчных кислот также оказывают незначительное клиническое воздействие.
Омега-3 ПНЖК представлены в России единственным рецептурным препаратом этой группы – «Омакором». В 1 капсуле препарата содержится 90% незаменимых омега-3 ПНЖК в виде эйкозопентаеновой и докозагексаеновой кислот. «Омакор» способен незначительно снижать ТГ и ЛОНП.
В нашей стране зарегистрирован один ингибитор, поглощающий ХС в кишечнике – «Эзетимиб» («Эзетрол»). Механизм его действия заключается в снижении всасывания экзогенного холестерина из кишечника, что может снизить концентрацию ЛНП в крови дополнительно на 15-20%. Положительное влияние на прогноз этих препаратов крайне мало, однако, учитывая их безопасность, они всё шире применяются для снижения ЛНП в случае недостижения целевых показателей при статинотерапии или непереносимости статинов.[8][14]
Основными препаратами, снижающим концентрацию липидов, ХС и липопротеидов, способствующих развитию атеросклероза, являются статины. Они блокируют ферменты, участвующие в синтезе ХС в клетках печени, тем самым вызывая стимуляцию внутрипечёночного образования рецепторов к ЛПН. Это, в свою очередь, значительно снижает ЛНП в крови (на 50-60%). Препараты хорошо переносятся и положительно влияют на прогноз, т.е. снижают число инфарктов миокарда, ишемических мозговых инсультов, сердечно-сосудистую и общую смертность.
Статины обладают дополнительными положительными эффектами – стабилизация атеросклеротических бляшек и регресс атеросклероза.
Практическое значение имеют симвастатин («Зокор»), аторвастатин («Липримар»), розувастатин («Крестор») и питавастатин («Ливазо»). Эти препараты, а также большое количество дженерических статинов зарегистрированы в России.
Статинотерапия для первичной и вторичной профилактики проводится в следующих дозах:
- симвастатин по 10-40 мг в сутки;
- аторвастатин по 10-80 мг в сутки;
- розувастатин по 5-40 мг в сутки;
- питавастатин по 1-4 мг в сутки.
В 2015 году были зарегистрированы два препарата новой группы – алирокумаб и эволокумаб. Они предназначены для лечения семейно-генетической и смешанной ДЛ. Исследования показали достоверное значительное снижение ЛПНП в крови (на 60-70%) и их стабильный низкий уровень на протяжении длительного времени при хорошей переносимости. Эволокумаб применяют по 420 мг 1 раз в месяц, алирокумаб – по 75 мг 1 раз в две недели в подкожных инъекция шприц-ручкой. Недостатки этой группы медикаментов – высокая стоимость терапии по сравнению со статинами и другими средствами.
Комбинированная терапия дислипидемии решает задачи, которые не под силу монотерапии. Каждый препарат, снижающий концентрацию фракций липидов, влияет на определённый элемент метаболизма липидов и липопротеидов:
- статины и комбинация статинов с «Эзетролом» преимущественно снижают ЛНП, незначительно влияют на содержание ТГ и умеренно повышают концентрацию ЛВП;
- фибраты снижают уровень ТГ и повышают ЛВП, почти не оказывая влияния на ЛНП;
- никотиновые кислоты умеренно действуют на все звенья метаболизма липидов, но их применение ограничено в связи с высокой частотой побочных эффектов.
В России с 2008 года зарегистрирован комбинированный препарат «Инеджи», содержащий фиксированные дозы симвастатина и эзетимиба.
К комбинации статинов с фибратами всё чаще прибегают при лечении пациентов с сахарным диабетом 2 типа и с метаболическим синдромом при повышенном содержании ТГ в крови. Статины в такой комбинации эффективно предупреждают развитие макрососудистых осложнений (инфаркт миокарда, стенокардия), а фибраты способствуют предупреждению диабетической микроангиопатии.
Всё чаще статины сочетают с «Омакором» и кумабами.[7][14][15]
Прогноз ДЛ зависит от формы и выраженности синдрома, степени развития атеросклероза и наличия атеросклероз зависимых заболеваний.
Профилактика ДЛ основывается на поведенческих мероприятиях.
Рациональное питание способно снизить ЛНП лишь до 20%, однако отмечается влияние диеты на ТГ и ЛПОН. Кроме того, здоровое питание является выраженным фактором снижения общей смертности.
Количество калорий, потребляемых с пищей, должно способствовать поддержанию нормального веса тела. В связи с этим рекомендуется ограничить потребление животных жиров (не более 10%), а общее количество жира не должно превышать 20-30% от всего суточного каллоража. Ежедневное поступление ХС с пищей не должно превышать 300 мг у лиц без ДЛ и атеросклероза, а при наличии этих состояний – не более 200 мг.
Необходимо сокращать потребление насыщенных жиров и не преувеличивать важность ограничения некоторых жирных продуктов, например яиц, поскольку они служат ценным источником многих полезных веществ. Особо атерогенные насыщенные жиры – это трансжиры, содержащиеся в твёрдых маргаринах и полуфабрикатах.[9][13]
Фрукты и овощи (не считая картофель) следует потреблять не менее 400-500 г в день. Употребление мясных продуктов, субпродуктов и красного мяса следует ограничить. Лучше использовать в пищу больше других белковых продуктов: бобовые, рыба или птица. Каждый день нужно употреблять молочные продукты с низким содержанием жира и соли (кефир, кислое молоко, сыр, йогурт).
В ежедневной пище необходимы простые сахара, но их доля не должна превышать 10% от общей калорийности рациона. Общее количество потребляемой соли, включая соль, содержащуюся в готовых продуктах, не должно превышать 5 г в сутки, особенно это важно для людей с артериальной гипертензией.
Глубоководную рыбу северных морей (сель, сардины, скумбрия, лосось) полезно употреблять не реже 2-3 раз в неделю. Это связано с высоким содержанием в этих сортах ω-З ПНЖК, способствующих профилактике атеросклероза. Растительные стеролы/станолы содержатся в семенах растений, орехах и растительных маслах. В дозах около 2 г в сутки они не позволяют ХС всасываться в кишечнике.[2][4]
Снижение избыточного веса – обязательное условие профилактики ДЛ и сердечно-сосудистых осложнений. Снижение массы тела достигается назначением низкокалорийной диеты и регулярными адекватными физическими нагрузками. Для антропометрической оценки следует использовать показатель индекс массы тела (ИМТ) = вес в кг/рост м2. Нормальный ИМТ – 18,5-25 кг/м2. Для оценки типа ожирения используют измерение окружности талии (ОТ). Норма ОТ у мужчин – не более 94 см, у женщин – не более 80 см. ОТ свыше 102 см у мужчин и 88 см у женщин – показатель абдоминального ожирения, что ассоциируется с повышенным риском сердечно-сосудистых осложнений.[15]
Всем пациентам с ДЛ, избыточной массой тела и другими факторами риска рекомендуется повысить повседневную физическую активность с учётом возраста, тренированности и имеющихся заболеваний. Наиболее физиологичное, безопасное и доступное для всех аэробное физическое упражнение – ходьба. Ею рекомендуется заниматься 5-6 раз в неделю не менее 30-45 минут с достижением пульса 60-75% от максимального для человека. Максимальная частота сердцебиения рассчитывается по формуле: 220 – возраст (лет). Людям с ИБС и другими заболеваниями сердечно-сосудистой системы следует разрабатывать индивидуальный режим тренировок, учитывая показатели нагрузочного теста (велоэргометр или тредмил).[2][3]
Физические тренировки – важная составляющая профилактики ДЛ. Они снижают частоту сердцебиения и артериальное давление, позволяют адаптироваться к условиям ишемии, стабилизируют гормональный фон и оксигенацию тканей. Более эффективны аэробные, динамические, адекватные по интенсивности нагрузки циклического типа – ходьба, туризм, плавание, прогулки на лыжах и велосипеде.
Важно отказаться от курения в любой форме, в том числе от пассивного. Алгоритм программы отказа от курения состоит из нескольких принципов:
- выявление курильщиков;
- оценка выраженности привычки и готовности избавиться от неё;
- объяснение вреда курения и рекомендация отказа от него;
- при необходимости – врачебная помощь, включающая комплексную терапию;
- регулярное наблюдение врачом пациента-курильщика.
Наиболее эффективным медикаментом для отказа от табакокурения считается варениклин («Чампикс»). Он является блокатором никотиновых рецепторов головного мозга, в результате чего подавляется тяга к курению, снижается удовольствие от процесса и уменьшаются абстинентные проявления.
Ряд исследований показал, что умеренное потребление алкоголя может положительно воздействовать на ДЛ. Безопасным для здоровья считается употребление не более 150 мл алкоголя в неделю для мужчин и 100 мл для женщин при условии суточного употребления не более 20 г для мужчин и 15 г для женщин. Однако любые дозы алкоголя не рекомендованы людям с артериальной гипертензией, гипертриглицеридемией, заболеваниями гепато-биллиарной и панкреатической зоны, подагрой и ожирением. Злоупотребление алкоголем при статинотерапии может привести к миопатии и рабдомиолизу.[6]
Превентивная статинотерапия также является действенным направлением профилактики ДЛ. Для этого чаще используют низкие дозы современных статинов:
- симвастатин 10-20 мг в сутки;
- аторвастатин 10-20 мг в сутки;
- розувастатин 5-10 мг в сутки;
- питавастатин 1-2 мг в сутки.
- Арабидзе Г.Г. Атеросклероз и факторы риска. Клиническое значение аполипопротеинов в развитии ИБС / Г.Г. Арабидзе, К.И. Теблоев. – М.: Литтерра, 2008. – 242 c.
- Береславская Е.Б. Атеросклероз. Современный взгляд на лечение и профилактику . – СПб.: ИГ «Весь», 2005. – 128 с.
- Быков А.Т. Восстановительная медицина и экология человека. – М.: ГЭОТАР-Медиа, 2009. – 683 с.
- Быков А.Т. Оптимизация профилактических мероприятий у пациентов с факторами риска сердечно-сосудистых заболеваний / А.Т. Быков, А.В. Чернышёв // Вопросы курортологии, физиотерапии и лечебной физической культуры. – 2012. – № 2. – С. 3-6.
- Быков А.Т., Чернышёв А.В., Хутиев Т.В. и др. Восстановительное лечение больных с кардиологической и кардиометаболической патологией // Вестник восстановительной медицины. – 2009. – № 5. – С. 56-60.
- Городецкий В.Б. Атеросклероз. Профилактика, диагностика и лечение / А.В. Городецкий, В.Б. Шульц. – М.: Эксмо, 2008. – 256 с.
- Аронов Д.М., Ахмеджанов Н.М., Балахонова Т.В. и др. Национальные клинические рекомендации по диагностике и коррекции нарушений липидного обмена с целью профилактики и лечения атеросклероза // Кардиоваскулярная терапия и профилактика. – 2009. – Т. 8. – № 6. – 82 с.
- Нестеров Ю.И. Атеросклероз. Диагностика, лечение, профилактика. – М.: Феникс, 2007. – 256 с.
- Вартазарян М.А., Быков А.Т., Чернышёв А.В., Лобасов Р.В. Оптимизация физических методов первичной профилактики заболеваний, ассоциированных с атеросклерозом заболеваний // Курортная медицина. – 2015. – № 3. – С. 55-58.
- Вартазарян М.А., Быков А.Т., Чернышёв А.В., Ходасевич Л.С. Оптимизация алгоритма выявления и дифференцированной немедикаментозной коррекции факторов риска и доклинических стадий атеросклероза в первичном звене здравоохранения на курорте заболеваний. – 2017. – № 3. – С. 4-11.
- Разумов А.Н. Научные организационные основы восстановительной медицины: учебник по восстановительной медицине / А. Разумов, И. Бобровницкий, А. Василенко. – М., 2009. – 640 с.
- Чернышёв А.В. Сравнительный анализ эффективности традиционного и оптимизированного комплекса немедикаментозной терапии больных с изолированной и сочетанной патологией сердечно-сосудистой системы и обмена веществ // Journal of Preventive Medicine, USA. – 2014; 2(1): 1-4.
- Чернышёв А.В. Профилактика и немедикаментозная терапия сердечно-сосудистой патологии // LAPLAMBERT Academic Publishing. Germany. Saarbrucken. – 2014. – 378 с.
- Manoharan G., Ntalianis A., Muller O. et al. Severity of coronary arterial stenoses responsible for acute coronary syndromes // Am J Cardiol. – 2009.
- Jellinger P.S., Handelsman Y., Rosenblit P.D. et al. American Association of Clinical Endocrinologists and American College of Endocrinology. Guidelines for management of dyslipidemia and prevention of cardiovascular disease // Endocr Pract. – 2017. – № 2. – С. 1-87.
 Нарушения липидного обмена диагностируются у большинства пациентов с сахарным диабетом 2 типа (СД2) [1]. Повышенный уровень триглицеридов (ТГ) плазмы крови ассоциируется с увеличенным содержанием липопротеинов низкой плотности (ЛПНП) и снижением концентрации липопротеинов высокой плотности (ЛПВП) [2, 3].
Нарушения липидного обмена диагностируются у большинства пациентов с сахарным диабетом 2 типа (СД2) [1]. Повышенный уровень триглицеридов (ТГ) плазмы крови ассоциируется с увеличенным содержанием липопротеинов низкой плотности (ЛПНП) и снижением концентрации липопротеинов высокой плотности (ЛПВП) [2, 3].
↯ Больше статей в журнале «Управление качеством в здравоохранении» Активировать доступ
Повышение уровня ТГ, как правило, обнаруживаемое при СД2, обусловлено низкой чувствительностью висцеральной жировой ткани к антилиполитическому действию инсулина, повышением интенсивности липолиза, поступлением большого количества свободных жирных кислот в кровоток, интенсификацией печенью синтеза ТГ и липопротеинов очень низкой плотности (ЛПОНП). Фракция мелких плотных частиц ЛПНП, которые в большом количестве продуцируются при гипертриглицеридемии, обладает повышенной атерогенностью вследствие высокой способности к окислению [4].
В настоящее время во всем мире используется стратегия лечения СД2, предложенная Национальной Образовательной программой по диабету АВС. При лечении пациентов с СД2 необходим комплексный подход: контроль гликемии («А» – HbA1c), артериального давления («В» – blood pressure), а также уровня липидов крови («С» – cholesterol) [5].
✔ Как получить информированное согласие пациента на медпомощь, читайте в рекомендации Системы Главный врач.
Для коррекции дислипидемии при СД2 преимущественно используются препараты двух групп: статины и фибраты. Результаты крупных плацебо-контролируемых исследований, включавших группы больных с СД2 [Cholesterol and Recurrent Events Study (CARE), Scandiian Simvain Survival Study (4S) и Long-term Intervention of Pravain on Ischaemic Disease (LIPID)], показывают, что использование статинов позволяет снизить уровень ХС ЛПНП на 28-36% и число сердечнососудистых событий в исследуемых группах на 25-55% [6]. Фибраты снижают уровень ТГ и ЛПОНП на 20-50% и повышают уровень ЛПВП на 10-20%, а также способствуют увеличению размеров частиц ЛПНП [7]. В одном из самых крупных исследований по оценке эффектов фибратов у пациентов с СД [Fenofibrate Intervention and Event Lowering in Diabetes (FIELD)] было получено существенное снижение частоты развития микрои макроваскулярных осложнений СД, вероятно, за счет плейотропных эффектов фенофибрата [8].
В свете изложенного и статины, и фибраты позиционируются как неотъемлемые составные компоненты комбинированной терапии СД, а сам СД – как показание для назначения этих препаратов [9-12]. В рабо те были использованы микронизированный фенофибрат третьего поколения производства Solvay Pharma (трайкор, 145 мг/сут.) и аторвастатин фирмы КРКА (аторис, 20 мг/сут.).
Цель исследования – сравнительная оценка эффективности гиполипидемической терапии фенофибратом, аторвастатином или их комбинацией на фоне сахароснижающей терапии метформином у пациентов с СД2.
Как реализовать право пациента на выбор врача и медорганизации, читайте в Системе Главный врач.
Материалы и методы исследования
Под наблюдением находились подписавшие информированное согласие на исследование 84 пациента с СД2 в возрасте от 45 до 66 лет, в том числе 75 женщин (89,3%). Компенсация СД (HbA1c от 6,3 до 7,2%) достигалась назначением метформина в индивидуально подобранных дозах, которые не менялись в течение всего срока наблюдения. Пациенты были распределены на 3 сопоставимые группы, отличавшиеся тем, что на фоне адекватной гипогликемической терапии метформином для коррекции липидного обмена использовались аторвастатин (контрольная группа), фенофибрат (1 группа) и комбинация этих препаратов (2 группа). Общая характеристика пациентов, участвовавших в исследовании, представлена в таблице 1.
У всех пациентов отмечалось ожирение (ИМТ = 33,5±0,51 кг/м2), в основном висцерального характера, о чем свидетельствовал показатель ОТ (104,3±0,37 см). При этом показатель ОТ равнялся 102,1±0,31 см у женщин, а у мужчин – 112,5±3,1 см. В начале исследования пациенты характеризовались неудовлетворительной компенсацией углеводного обмена: наблюдалось повышение ГН до 8,9±0,31 ммоль/л и ППГ – до 12,7±0,57 ммоль/л, уровня HbAlc до 8,4±0,11%. Кроме того, показатели липидного профиля (ХС, ЛПНП, ЛПОНП и ТГ) и МК превышали нормативные величины (табл. 1).
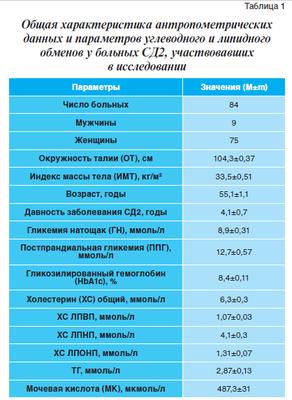
Критериями исключения из исследования служили: застойная сердечная недостаточность, тяжелые нарушения сердечного ритма, клинически значимые нарушения функции печени и почек, заболевания мышц, патология щитовидной железы, злоупотребление алкоголем, онкологические заболевания.
Длительность динамического наблюдения составила 6 месяцев. Полное клиническое и лабораторное обследование проводили перед началом терапии, через 3 (результаты не представлены) и 6 месяцев. Стандартное клиническое скрининговое обследование включало определение роста и массы тела, определение клинических и биохимических показателей крови (уровень глюкозы крови, гликированный гемоглобин, креатинин, печеночные ферменты), уровень липидов и липопротеинов плазмы крови, а также мочевой кислоты – МК). Все биохимические показатели определяли общепринятыми методами в КДЛ ОКБ №2.
Известный риск усиления токсического воздействия на мышечные волокна и развитие миопатии при совместном использовании статинов и фибратов обусловил проведение скринингового контроля на протяжении всего исследования. Переносимость и безопасность гиполипидемической терапии оценивали по частоте возникновения побочных эффектов и их тяжести. Критерием прекращения терапии служило более чем двукратное повышение уровня креатинфосфокиназы (КФК), а также печеночных ферментов (АСТ и/или АЛТ).
Как информировать пациента о состоянии здоровья, читайте в Системе Главный врач.
Статистическую обработку полученных данных проводили с использованием пакета статистических программ istica 6.0. Все данные анализировали методом описательной статистики. Для оценки статистической значимости различий использовали дисперсионный анализ, непараметрический критерий Вилкоксона и критерий 2 Манна – Уитни для оценки статистической значимости различий между двумя независимыми группами. Различия считали статистически значимыми при p<0,05.
Результаты исследования
Как свидетельствуют результаты проведенного исследования, представленные в таблице 2, исходные уровни липидов и липопротеинов плазмы крови, а также мочевой кислоты во всех сравниваемых группах были существенно выше нормативных значений и статистически значимо не различались между собой. К концу исследования в контрольной группе на фоне приема аторвастатина было отмечено статистически достоверное снижение показателей общего ХС (на 10%), ЛПНП (на 20%), ЛПОНП (на 15%) и повышение уровня ЛПВП (на 13%). При этом показатели триглицеридемии, снизившись по абсолютным значениям, остались в рамках недостоверных изменений. Что же касается показателей урикемии, то они остались без каких-либо изменений как у женщин, так и у мужчин.
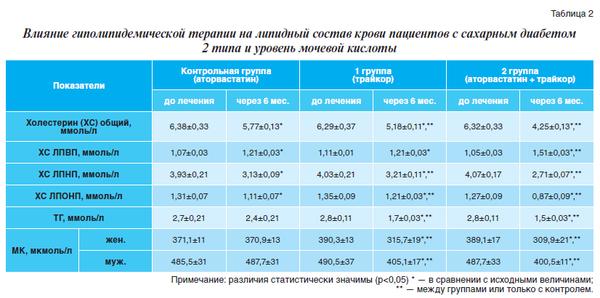
На фоне приема фенофибрата наблюдались аналогичные биохимические изменения: произошло статистически значимое снижение показателей общего ХС, ЛПНП, ЛПОНП и повышение уровня ЛПВП в среднем на 18, 21, 10 и 9% соответственно. При этом различия были достоверны не только с исходными показателями, но и показателями, полученными в конце исследования в контрольной группе, за исключением уровня ЛПВП. То есть более выраженного влияния на этот параметр у фенофибрата в сравнении с аторвастатином не обнаружено. Ожидаемым оказалось влияние фенофибрата на ТГ: статистически достоверное снижение уровня ТГ было отмечено как в сравнении с исходным его уровнем, так и с результатами, полученными при использовании моновариантного лечения аторвастатином.
Следует отметить, что динамика содержания ТГ в сыворотке крови характеризовалась статистически значимым снижением уже к третьему месяцу лечения (более чем на 28%; p<0,05). Подтвердился также известный факт о влиянии фенофибрата на уровень мочевой кислоты. Названный показатель статистически достоверно отличался в конце исследования от исходного уровня и показателей, полученных в контрольной группе с аторвастатином, на 19% у женщин и на 17% у мужчин.
Учитывая известные отличия в результирующем эффекте применения изучаемых препаратов, интересным представлялась оценка результатов их совместного использования (группа 2). Как свидетельствуют полученные результаты, произошло некоторое усиление синтеза антиатерогенных ЛПВП, достигнутый уровень которых статистически достоверно превышал как исходные показатели, так и результаты, полученные при моновариантном использовании как фенофибрата, так и аторвастатина (в среднем на 25% в обоих случаях).
Показатели общего ХС, ЛПНП, ЛПОНП, а также ТГ отличались статистически достоверным снижением на значительно большую величину в сравнении с контрольной и 1 группой пациентов (на 33%, 33%, 31% и 46% соответственно), свидетельствуя о совокупном взаимоусиливающем эффекте комбинации препаратов в сравнении с их индивидуальными потенциями. В отношении МК можно констатировать следующее: при использовании комбинации препаратов усиления эффекта не происходит, в апробированной паре антиуратной активностью обладает исключительно фенофибрат.
Как Росздравнадзор проверит соблюдение клинических рекомендаций, читайте в Системе Главный врач.
Важным аспектом комбинированного использования гиполипидемических препаратов является его безопасность для пациентов и хорошая переносимость. Проводимый в ходе всего исследования скрининг показал, что переносимость лечения была хорошей. Диспепсия, боли в эпигастрии отмечались у 2 пациентов в контрольной группе, у 1 пациента в 1-й группе и у 2 – во 2-й группе. Эти явления купировались самостоятельно в течение нескольких дней приема препаратов. Нежелательные явления, такие как боли в икроножных мышцах, повышение уровня креатинина плазмы, превышение верхних границ нормы показателей аспарагиновой и аланиновой аминотрансфераз, а также уровня креатинфосфокиназы в 2 и более раза, в нашем исследовании не были зафиксированы ни у одного пациента.
Обсуждение
Клиническая эффективность фибратов оценивалась неоднократно, в том числе у пациентов с СД. Например, в исследовании HHS (Helsinki Heart Study) показано, что коррекция дислипидемии на фоне терапии гемфиброзилом позволяет существенно снизить риск возникнове ния ИБС у пациентов с СД, особенно это касалось пациентов с повышенным уровнем ТГ [13]. В исследованиях по вторичной профилактике атеросклероза с использованием фибратов VA-HIT (Veteran Administration – HDLCholesterol Intervention Trial), BIP (Bezafibrate Infarction Prevention), DAIS (DIabetes Atherosclerosis Regression Study) у пациентов с коронарным синдромом и высоким уровнем ТГ констатирована нормализация липидного состава, замедление прогрессирования атеросклероза, достоверное снижение количества сердечно-сосудистых событий [14-15].
Кроме антиатерогенных эффектов, связанных с модификацией липидного состава, производные фиброевой кислоты оказывают также различные плейотропные эффекты. В нашем случае это антиподагрический эффект, заключающийся в нормализации уровня МК у больных СД2. Это снижение на фоне и монотерапии фенофибратом, и комбинации его с аторвастатином колебалось в пределах 17-46%. Аналогичная динамика уровня МК описана в исследовании эффективности фенофибрата у пациентов с дислипидемией [16]. Известно также, что фенофибрат замедляет темпы прогрессирования поражения почек при подагре. Механизм его действия связан с уменьшением отложения липидов в тканях почек, угнетением пролиферации мезангиальных клеток, высвобождением факторов роста и секреции коллагена IV типа.
В настоящее время доказана роль гиперурикемии в качестве независимого предиктора сердечнососудистых осложнений у больных ИБС, АГ, с хронической и острой сердечной недостаточностью и метаболическим синдромом [17]. Важно отметить, что применение фенофибрата обеспечивает достоверное снижение частоты развития не только макро-, но и микрососудистых осложнений СД, которые также имеют важное значение в патогенезе сердечно-сосудистых осложнений при СД [18].
Как врачу отказаться от пациента, читайте в Системе Главный врач.
Таким образом, проведенное нами исследование показало, что терапия фенофибратом типичного для СД варианта дислипидемии с повышенным содержанием в плазме крови ТГ более эффективна, чем терапия статинами, в плане снижения уровней общего ХС, ТГ, ЛПНП, ЛПОНП. Параллельное снижение показателей гиперурикемии делает назначение фенофибрата при таком варианте дислипидемии более целесообразным, чем аторвастатина. Комбинированная терапия двумя гиполипидемическими препаратами позволяет добиться синергичного эффекта, что позволяет надеяться на оптимизацию прогноза у курируемых пациентов.
Заключение
Тактика интенсифицированной терапии больных СД2 в настоящее время предполагает раннее и агрессивное начало медикаментозной терапии для достижения адекватного контроля заболевания. Определенные ограничения на осуществление такого лечения накладывает целый ряд дополнительных условий: возраст пациента, наличие сопутствующих факторов риска, сердечнососудистой патологии и т. п. Важным аспектом развития инвалидизирующих осложнений СД являются сопутствующее нарушение липидного обмена и прогрессирование атеросклероза, в связи с чем адекватная гиполипидемическая терапия составляет неотъемлемую часть процесса управления СД. Включение в комплексную терапию СД2 фенофибрата (трайкора), как показало проведенное исследование и как свидетельствуют многочисленные литературные данные, существенно увеличивает эффективность этого управления.
Литература
- Kannel W. B., McGее D. L. Diabetes and glucose tolerance as risk factors for cardiovascular disease: the Framingam Study // Diabetes Care. – 1979. – Vol. 2. – P. 120-126.
- Capaldo B., Di Bonito P., Iaccarino M. et al. Cardiovascular characteristics in subjects with increasing levels of abnormal glucose regulation: The Strong Heart Study // Diabetes Care. – 2013. – Vol. 36. – №4. – P. 992-997.
- Chapman M. J., Bruckert E. The aterogenic role of triglycerides and small, dense low density lipoproteins: impact of ciprofibrate therapy // Atherosclerosis. – 1996. – Vol. 124. – №4. – P. 921-928.
- Tan C. E., Chew L. S., Chio L. F. et al. Cardiovascular risk factors and LDL subfraction profile in Type 2 diabetes mellitus subjects with good glycaemic control // Diabetes Res. Clin. Pract. – 2001. – Vol. 51. – №1. – P. 107-114.
- National Diabetes Education Program. Control the ABCs of Diabetes. – 2002. – 2 p.
- Baigent C., Keech A., Kearney Р. M. et al. Efficacy and safety of cholesterol-lowering treatment: prospective analysis of data from 90,056 participants in 14 randomised trials of ins // Lancet. – 2005. – Vol. 366. – P. 1267-1278.
- Brown W. V., Dujovne С., Farquhar J. W. et al. Effects of fenofibrate on plasma lipids. Double-blind, multicenter study in patients with type НА or НВ hyperlipidemia // Arteriosclerosis. – 1986. – Vol. 6. – №2. – P. 670-678.
- Keech A., Simes R. J., Barter P. Effects of long term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial // Lancet. – 2005. – Vol. 366. – P. 1849-1861.
- Яфасов К. М., Дублянская Н. В. Дислипидемия при сахарном диабете II типа: патогенез и лечение // Кардиология. – 2001. – №9. – С. 74-77.
- Athyros V. G., Tziomalos K., Karagiannis A. et al. Lipidlowering agents and new onset diabetes mellitus // Expert Opin. Pharmacother. – 2010. – Vol. 11. – P. 1965-1970.
- Wild S. H., Byrne C. D. Коррекция липидного профиля в снижении кардиоваскулярного риска у пациентов с метаболическим синдромом или сахарным диабетом 2 типа // Практична ангiологiя. – 2006. – №2 (03). – С. 57-60.
- Ruggenenti P., Cattaneo D., Rota S. et al. Effects of combined ezetimibe and simvain therapy as compared to simvain alone in patients with type 2 diabetes: a prospective, randomized, double blind, clinical trial // Diabetes Care. – 2010. – Vol. 133. – P. 1954-1956.
- Frick M. Н., Elo O., Haapa K. et al. Helsinki Heart Study: primary-prevention trial with gemfibrozil in middle-aged men with dyslipidemia. Safety of treatment, changes in risk factors, and incidence of coronary heart disease // NEJM. – 1987. – Vol. 20. – P. 1237-1245.
- Rubins H. B., Robins S. J., Collins D. et al. for the Veterans Affaires High – Density Lipoprotein Cholesterol Intervention Trial Study Group. Gemfibrozil for the Secondary prevention of coronary heart disease in men with low levels of high density lipoprotein cholesterol // N. Engl. J. Med. – 1999. – Vol. 341. – P. 410-418.
- Goldbourt U., Brunner D., Behar S., Reicher S. H. Baseline characteristics of patients, participating in the Bezafibrate Infarction Prevention (BIP) Study // Eur. Heart. J. – 1998. – Vol. 19. – №1. – P. 42-47.
- dela Serna G., Cadarso C. Fenofibratedecreasesplasma fibrinogen, improves lipid profile, and reduces uricemia // Clin. Pharmacol. Ther. – 1999. – Vol. 66 – №2. – P. 166-172.
- Culleton B. F., Larson M.-G., Kannel W. B., Levy D. Serum Uric Acid and Risk for Cardiovascular Disease and Death: the Framingham Heart Study // Ann. Intern. Med. – 1999. – Vol. 131. – №1. – P. 7-13.
- Keech A., Simes R. J., Barter P. Effects of longterm fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial // Lancet. – 2005. – Vol. 366. – P. 1849-1861.
Материал проверен экспертами Актион Медицина
