Глибенкламид в лечении сахарного диабета 2 типа
Цель исследования: изучение влияния микронизированных форм глибенкламида на вариабельность гликемии и неврологические изменения у пациентов с сахарным диабетом (СД) 2 типа и диабетической нейропатией (ДН).
Материал и методы. Обследовано 16 больных СД 2 типа и ДН, которым проводилось лечение микронизированными формами глибенкламида (1,75 и 3,5 мг) в суточной дозе 7,0–10,5 мг, препаратами альфа-липоевой кислоты и витаминов группы B.
Изучались вариабельность гликемии методом восьмиточечного СКГ с расчетом SD и CV, динамика HbA1c, ОХС, ХС ЛПНП, ХС ЛПВП, ТГ и ИА. Оценка позитивной и негативной неврологической симптоматики проводилась по TSS, NIS-LL с исследованием температурной чувствительности, ВАШ, опроснику Мак Гилла, по результатам ЭНМГ n. tibialis и n. peroneus с определением амплитуды М-ответа, СРВ и РЛ.
Результаты. У больных СД 2 типа, страдающих ДН, на фоне приема микронизированных форм глибенкламида зафиксировано снижение уровня HbA1c, глюкозы перед ужином, вариабельности гликемии и ИА. Через 12 недель терапии по NIS-LL отмечены улучшение вибрационной чувствительности и снижение общей оценки неврологических изменений, тенденция к повышению тактильной чувствительности, по TSS – уменьшение онемения в голенях и стопах, общей оценки симптомов ДН, тенденция к уменьшению жжения, по опроснику Мак Гилла – снижение суммарной оценки боли, по сенсорной и эвалюативной шкалам – тенденция к уменьшению РИБ, по ВАШ – улучшение состояния. При ЭНМГ выявлено увеличение амплитуды М-ответа n. peroneus (левый), тенденция к уменьшению РЛ n. tibialis (левый) и увеличению СРВ n. tibialis (правый).
При корреляционном анализе установлена прямая связь между показателями HbA1c и CV, общей оценкой по NIS-LL, обратная связь HbA1c с СРВ, а также CV с показателями амплитуды М-ответа, SD с суммарной оценкой выраженности боли по опроснику Мак Гилла.
Заключение. Применение микронизированных форм глибенкламида способствует снижению вариабельности гликемии и компенсации углеводного обмена, а также улучшению показателей неврологического статуса пациентов с ДН.

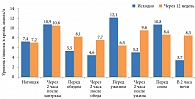
Рис. 1. Влияние терапии микронизированными формами глибенкламида на динамику гликемии у больных СД 2 типа и ДН по данным восьмиточечного гликемического контроля
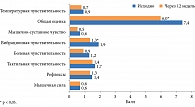
Рис. 2. Динамика неврологических проявлений ДН по NIS-LL и температурной чувствительности
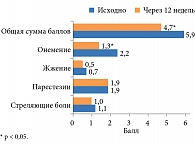
Рис. 3. Изменение клинических симптомов ДН по TSS у больных СД 2 типа
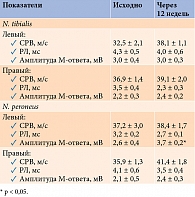
Таблица 1. Динамика показателей ЭНМГ n. tibialis и n. peroneus у больных СД 2 типа и ДН
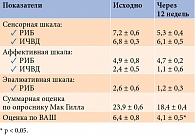
Таблица 2. Изменение выраженности боли при ДН, балл
Сахарный диабет (СД) 2 типа – хроническое прогрессирующее заболевание. По прогнозам экспертов Международной федерации диабета (International Diabetes Federation – IDF), к 2040 г. в мире количество больных может увеличиться до 642 млн. В России в 2015 г. по показателю «обращаемость в лечебные учреждения» таких пациентов было 4,1 млн, при этом с СД 2 типа – 3,7 млн. Однако фактическое число больных, по результатам эпидемиологических исследований Эндокринологического научного центра, достигает 9–10 млн – 7% населения [1, 2].
Ведущее место в структуре осложнений СД занимает диабетическая дистальная нейропатия, субклиническая и клиническая формы поражения периферических нервов. Она является предиктором развития синдрома диабетической стопы, прогрессирование которого нередко приводит к нетравматической ампутации. Согласно данным исследования UKPDS, при выявлении СД 2 типа у 14–20% пациентов уже отмечается диабетическая нейропатия (ДН), ее распространенность увеличивается с увеличением длительности и тяжести заболевания [3].
Основными метаболическими факторами развития диабетической дистальной сенсомоторной нейропатии считаются гипергликемия и вариабельность гликемии, окислительный стресс, неферментативное гликозилирование белков, а также системное воспаление с повышением уровня С-реактивного белка и провоспалительных цитокинов. Вследствие этого нарушаются внутриклеточная осморегуляция, эндоневральный кровоток, проводимость по нервным волокнам и цитотоксический эффект конечных продуктов гликозилирования (КПГ). Последние, взаимодействуя с атерогенными фракциями липидного спектра, влияют на липидный обмен и активируют процессы перекисного окисления липидов [4, 5].
Наиболее часто при СД 2 типа наблюдается симметричная дистальная нейропатия – 80% случаев. Распространенность болевой формы ДН варьирует от 8 до 26% в зависимости от критериев оценки болевого синдрома [5]. Хроническая боль обусловливает снижение качества жизни пациентов [6]. Ремиссия боли ассоциируется с небольшой ее длительностью, предшествующим снижением массы тела и менее тяжелыми формами потери чувствительности.
Компенсация СД способствует снижению риска развития и прогрессирования его осложнений.
В настоящее время подходы к лечению СД значительно изменились. Так, согласно консенсусу Российской ассоциации эндокринологов, приоритетным считается достижение индивидуального гликемического контроля – в зависимости от возраста, ожидаемой продолжительности жизни, наличия сердечно-сосудистых осложнений и риска гипогликемии [1].
Более трех десятилетий при СД используются производные сульфонилмочевины. Среди препаратов данного класса золотым стандартом пероральной сахароснижающей терапии СД 2 типа признан глибенкламид как в виде монотерапии, так и комбинированной. Глибенкламид способствует закрытию аденозинтрифосфат-зависимых К+-каналов, повышению содержания внутриклеточного Са2+ и секреции инсулина бета-клетками. Это приводит к восстановлению первой фазы секреции инсулина и снижению постпрандиальной гликемии [7].
Особенностью лекарственных форм глибенкламида считается постепенное нарастание сахароснижающего эффекта, что достигается благодаря медленной абсорбции и низкой биодоступности. Однако в постабсорбционном периоде повышается риск развития гипогликемии, особенно при приеме больших доз [8]. Микронизированная форма глибенкламида позволяет повысить биодоступность и длительно поддерживать терапевтическую концентрацию вещества в крови при приеме более низких доз. Так, биодоступность обычного глибенкламида в дозе 5 мг составляет 29–69%, его микронизированной формы – приблизительно 100% [9].
Микронизированная форма глибенкламида по 1,75 и 3,5 мг хорошо известна с 1985 г. Пик ее сахароснижающего действия практически совпадает с фазой постабсорбционной гипергликемии, что способствует снижению риска развития гипогликемических состояний между приемами пищи [10].
На данный момент вопрос о плейотропных эффектах микронизированной формы глибенкламида изучен недостаточно. В этой связи представляется актуальным исследовать роль такой терапии в профилактике прогрессирования ДН.
Цель исследования
Целью настоящего исследования стало изучение влияния микронизированных форм глибенкламида на вариабельность гликемии и неврологические изменения у пациентов с СД 2 типа и ДН.
Материал и методы
В эндокринологическом отделении Рязанской областной клинической больницы проведено открытое сравнительное исследование с участием 16 пациентов (7 мужчин и 9 женщин). Длительность СД 2 типа – 9,2 ± 3,6 года, ДН – 7,4 ± 3,1 года, средний возраст больных – 56,4 ± 4,2 года, индекс массы тела – 27,9 ± 3,6 кг/м2. В 37,5% случаев диагностирована диабетическая ретинопатия, 43,8% – диабетическая нефропатия, 81,3% – артериальная гипертензия.
Сахароснижающая терапия проводилась согласно принципам стратификации с применением микронизированных форм глибенкламида в дозах 1,75 и 3,5 мг, суточная доза – 7,0–10,5 мг.
В качестве дополнительной патогенетической терапии назначались препараты альфа-липоевой кислоты (Октолипен, Тиоктацид, Тиогамма, Берлитион) по 600 мг/сут в/в капельно и витаминов группы B (Комбилипен, Мильгамма) по 2 мл/сут в/м в течение двух недель, далее – пероральные препараты альфа-липоевой кислоты по 600 мг/сут и жирорастворимых форм тиаминсодержащих витаминов (Комбилипен табс, Мильгамма композитум, Бенфогамма) в течение 12 недель.
Изучалась динамика параметров углеводного обмена: гликированный гемоглобин (HbA1c) и вариабельность гликемии. Первый показатель определялся с помощью автоматического анализатора NycoCard Reader II. Второй – оценивался по восьми точкам самоконтроля гликемии (СКГ) с расчетом стандартного отклонения (standard deviation – SD) и коэффициента вариабельности (coefficient of variation – CV).
Показатели липидного обмена: общий холестерин (ОХС), холестерин липопротеинов высокой плотности (ХС ЛПВП), триглицериды (ТГ) с расчетом холестерина липопротеинов низкой плотности (ХС ЛПНП) и индекса атерогенности (ИА) – определяли ферментативным методом с использованием биохимического анализатора Olimpus 400 (Япония) в биохимической лаборатории Рязанской областной клинической больницы.
Исследование неврологического статуса проводилось в кабинете диабетической стопы. Для оценки позитивной неврологической симптоматики применяли TSS (Total Symptom Score), вибрационной, тактильной, болевой чувствительности, сухожильных рефлексов, мышечной силы в нижних конечностях – NIS-LL (Neuropathy Impairment Score – Lower Limb), температурной – комплексное устройство Twin-Tip (Германия). Для определения выраженности болевого синдрома и его интенсивности использовали опросник Мак Гилла c расчетом индекса числа выбранных дескрипторов (ИЧВД) и рангового индекса боли (РИБ) и десятибалльную Визуальную аналоговую шкалу (ВАШ). Проводилась также стимуляционная электронейромиография (ЭНМГ) nervus tibialis и nervus peroneus с помощью анализатора «Синапсис» (Россия) с определением амплитуды М-ответа, скорости распространения возбуждения (СРВ) и резидуальной латентности (РЛ).
Все пациенты обследовались дважды: исходно и через 12 недель.
Для статистической обработки данных использована программа Statistica 10. Данные представлены в виде M ± m. Для установления связи между показателями использовали t-критерий Стьюдента. Нормальность распределения значений проверялась с помощью критерия Колмогорова – Смирнова. Связь между различными показателями устанавливали с помощью корреляции Спирмена. Статистически значимыми считали различия при р
Все больные подписали информированное согласие на участие в исследовании, форма утверждена этическим комитетом Рязанского государственного медицинского университета им. академика И.П. Павлова (протокол № 5 от 07.12.2012).
Результаты
Через 12 недель терапии у больных СД 2 типа и ДН отмечено снижение HbA1c с 8,6 ± 0,4 до 7,4 ± 0,3% (p
Исходно у пациентов была диагностирована дислипидемия с повышением атерогенных фракций липидного спектра. Через 12 недель ИА снизился с 4,1 ± 0,3 до 3,3 ± 0,2 (p
При анализе неврологического статуса по NIS-LL у больных СД 2 типа через 12 недель наблюдалось улучшение вибрационной чувствительности и снижение общей оценки неврологических изменений (рис. 2). Кроме того, выявлена тенденция к повышению тактильной чувствительности.
Исходно при ЭНМГ-обследовании n. tibialis и n. peroneus зарегистрировано снижение СРВ, амплитуды М-ответа и увеличение РЛ. Через 12 недель наблюдалось увеличение амплитуды М-ответа n. peroneus (левый), тенденция к уменьшению РЛ n. tibialis (левый) и увеличению СРВ n. tibialis (правый) (табл. 1).
На клинической стадии ДН через 12 недель по TSS уменьшилось онемение в голенях и стопах и общая оценка симптомов, наметилась тенденция к снижению жжения (рис. 3).
Анализ ответов пациентов по опроснику Мак Гилла в конце наблюдения показал снижение суммарной оценки боли. Отмечена также тенденция к уменьшению РИБ сенсорной шкалы, РИБ эвалюативной шкалы (табл. 2). Выявлено улучшение по ВАШ.
При проведении корреляционного анализа у больных СД 2 типа и ДН обнаружена прямая связь между показателями HbA1c и коэффициентом вариабельности гликемии (r = 0,32, p = 0,016), общей оценкой симптомов по NIS-LL (r = 0,57, p = 0,039), обратная связь между уровнем HbA1c и СРВ (r = -0,41, p = 0,02), CV и показателями амплитуды М-ответа (r = -0,36, p = 0,015), SD гликемии и суммарной оценкой по опроснику Мак Гилла (r = 0,41, p = 0,037).
Вывод
Полученные результаты позволяют сделать следующие выводы.
- У больных СД 2 типа и ДН терапия микронизированными формами глибенкламида через 12 недель привела к улучшению параметров углеводного обмена и снижению CV, SD. Индивидуального целевого уровня гликемии – HbA1c
- Выявлено улучшение показателей неврологического статуса: снижение суммы баллов, повышение вибрационной чувствительности по NIS-LL, уменьшение онемения и суммарной оценки по TSS, суммарной оценки боли по опроснику Мак Гилла, увеличение амплитуды М-ответа n. peroneus (левый).
- Проведенное исследование подтверждает обоснованность и эффективность применения микронизированных форм глибенкламида у больных СД 2 типа и дистальной диабетической нейропатией.
Информация о финансировании и конфликте интересов
Авторы декларируют отсутствие потенциальных и иных конфликтов интересов, связанных с публикацией настоящей статьи.
Исследование и публикация работы проведены без внешнего финансирования
В статье подробно описаны механизмы развития сахарного диабета (СД) 2 типа: инсулинорезистентность и снижение функции бета-клеток поджелудочной железы, а также мишени для действия пероральных сахароснижающих препаратов. Исходя из патогенеза заболевания и многолетнего опыта применения сахароснижающих препаратов, «золотым стандартом» в лечении СД 2 типа считается глибенкламид, который обладает наиболее выраженным сахароснижающим действием и самой высокой степенью аффинности к рецепторам бета-клеток по сравнению с другими препаратами сульфонилмочевины. В последние годы в арсенале врачей появилась новая, высокоэффективная микронизированная форма глибенкламида (Манинил® 1,75 и 3,5 мг), которая имеет практически 100%-ную биодоступность и пик сахароснижающего действия, совпадающий с постабсорбционной гипергликемией, что обеспечивает значительное снижение риска гипогликемических состояний.
Рис. 1. Концентрация глюкозы и инсулина в плазме крови после нагрузки глюкозой (75 г) у здоровых добровольцев
Рис. 2. Выбор целевого уровня HbA1c у больных СД 2 типа
Роль бета-клеток в развитии сахарного диабета
В 1995 г. были опубликованы результаты Британского проспективного исследования сахарного диабета (United Kingdom Prospective Diabetes Study – UKPDS), проводившегося в течение 6 лет. Пациентам с сахарным диабетом (СД) 2 типа была назначена терапия разными сахароснижающими препаратами с целью достижения удовлетворительного гликемического контроля для предотвращения или уменьшения выраженности осложнений диабета [1]. В отчете помимо результатов, касающихся снижения распространенности осложнений, были данные, которые оказали существенное влияние на понимание патофизиологии СД 2 типа. Исследование UKPDS с помощью индекса HOMA (Homeostasis Model Assessment – оценка гомеостатической модели) – суррогатной оценки функции бета-клеток на основе измерений гликемии натощак и концентрации инсулина в крови натощак – впервые показало значительное снижение функции бета-клеток уже к моменту постановки диагноза СД 2 типа [2]. Измерив индекс HOMA, исследователи пришли к следующему выводу: секреция инсулина у больных СД 2 типа постепенно угасает в отличие от таковой у пациентов без СД или пациентов с нарушенной толерантностью к глюкозе. Было также показано, что на фоне лечения СД через некоторое время возникает необходимость интенсификации терапии. Все вышесказанное позволило сделать вывод о постепенном нарастании гипергликемии, связанном со снижением функции бета-клеток.
Индекс HOMA также использовался для оценки изменений функции бета-клеток у пациентов с СД 2 типа в исследовании исходов сахарного диабета в динамике (A Diabetes Outcome Progression Trial – ADOPT) [3, 4]. Пациентам проводилась монотерапия росиглитазоном, метформином или глибенкламидом. Основной вывод исследования ADOPT заключался в следующем: несмотря на то что пациенты длительно получали указанные препараты, это не предотвратило снижение функции бета-клеток. Данные исследования ADOPT согласуются с результатами исследования UKPDS: если в начале лечения отмечалось улучшение гликемического контроля, то в дальнейшем уровень гликированного гемоглобина (HbA1c) в крови постепенно увеличивался и возникала необходимость интенсификации терапии.
Снижение функции бета-клеток только один обязательный фактор, участвующий в патогенезе СД 2 типа. Вторым обязательным фактором является инсулинорезистентность. Соотношение этих факторов патогенеза СД 2 типа различно как в отдельных популяциях, так и у конкретных больных одной популяции. До конца не удается определить, какой из них первичный. Например, у индейцев племени пима инсулинорезистентность предшествует развитию СД. Так, в результате проведения глюкозотолерантного теста при нормальных показателях глюкозы у них уже была выявлена гиперинсулинемия [5]. Однако у родственников пациентов с СД 2 типа отмечается повышение уровня инсулина в ответ на нагрузку глюкозой, что явно свидетельствует об имеющейся сниженной чувствительности к инсулину тканей печени и скелетных мышц. Из сказанного следует, что инсулинорезистентность – своего рода экзамен для бета-клеток. Из-за неспособности бета-клеток преодолеть растущую инсулинорезистентность и развиваются проявления СД 2 типа.
Интересные данные приведены в статье G.M. Reaven (2009) [4], в которой доказательно опровергается возможность использования индекса HOMA для оценки функции бета-клеток у больных СД, так как ставится под сомнение предположение о том, что концентрация глюкозы в плазме в определенный момент времени является единственным фактором, от которого зависит уровень инсулина плазмы. Это согласуется с данными о том, как по-разному откликается бета-клетка выработкой инсулина на пероральную нагрузку глюкозой (75 г) у 100 здоровых добровольцев (рис. 1) [2, 6].
Таким образом, функциональные возможности бета-клеток индивидуальны и зависят от степени инсулинорезистентности.
Причины дисфункции бета-клеток
Дисфункция бета-клеток является результатом действия нескольких факторов. Первый фактор – липотоксичность.
Очень часто у больных СД наблюдается абдоминальный тип ожирения, который нередко сопровождается дислипидемией, сердечно-сосудистыми нарушениями, артериальной гипертензией. При абдоминальном типе ожирения в крови повышается уровень андрогенов (у женщин) и кортизола при снижении уровня секс-стероидсвязывающего глобулина. В абдоминальных жировых клетках скорость липолиза значительно выше, чем в подкожных адипоцитах, и свободные жирные кислоты (СЖК), которые высвобождаются при липолизе, по системе воротной вены с избытком поступают в печень. В результате повышается синтез липопротеинов и активируются процессы атерогенеза [7].
Свободные жирные кислоты оказывают ингибирующее влияние на окисление глюкозы (цикл Рэндла) и участвуют в поддержании и усилении состояния инсулинорезистентности. Так, инфузия липидов здоровым добровольцам привела в течение 48 часов к инсулинорезистентности, хронической гипергликемии, которая сопровождалась гиперинсулинемией [7, 8, 9, 10]. В исследовании крыс с диабетом и ожирением (Zucker diabetic fatty rat) показано, что значительное повышение в плазме крови концентрации жирных кислот и триглицеридов в преддиабетический период сочетается с резким увеличением содержания триглицеридов в бета-клетках островков поджелудочной железы. Такое влияние триглицеридов на бета-клетки названо липотоксичностью [11]. Интересно, что диета с ограничением жиров, назначенная указанным животным, снижает гиперлипидемию, гипертриглицеридемию и накопление липидов в островках поджелудочной железы, что в конечном итоге приводит к улучшению функции бета-клеток. Липотоксичность, или длительное влияние повышенных концентраций СЖК на работу бета-клеток, опосредуется нарушением регуляции индуцируемой NO-синтазы и повышенным образованием NO, а также усилением процессов оксидации и цитотоксичности. Кроме того, аккумуляция жирных кислот в бета-клетках приводит к ускорению их апоптоза [12]. В итоге снижаются функциональные свойства бета-клеток, что и наблюдается при СД 2 типа.
Второй фактор – глюкозотоксичность. Высокий уровень глюкозы оказывает токсическое действие на все ткани, особенно на нервную ткань и эндотелий. Механизмы патологического влияния глюкозы на клетку хорошо изучены – это и избыточная продукция свободнорадикальных соединений, и процессы гликирования, и высокая активность протеинкиназы С [13].
При СД 2 типа нарушается пульсовая секреция инсулина, снижается или нивелируется первая фаза секреции инсулина, нарушается превращение проинсулина в инсулин. В результате у больных увеличивается количество проинсулина в крови. Гипергликемия снижает секреторную функцию бета-клеток и значительно уменьшает способность оставшихся бета-клеток отвечать на стимуляцию секрецией инсулина. Однако нарушения секреции инсулина полностью обратимы при нормализации уровня глюкозы крови [14].
Нужно также упомянуть о роли амилина и его влиянии на функцию бета-клеток. Исследования показали, что амилин выполняет регуляторную роль в секреции инсулина. Повышенный синтез внутриклеточного амилина (амилоида), наблюдаемый при СД 2 типа, приводит к гибели бета-клеток посредством апоптоза или некроза, а отложение амилина как раз и отражает эти процессы [15].
Современная концепция лечения сахарного диабета
Лечение больных СД направлено прежде всего на достижение компенсации углеводного обмена, поэтому должно включать диету, физические нагрузки, прием лекарственных препаратов, обучение больного и самоконтроль [8, 11, 16].
В последние годы подход к достижению компенсации СД изменился. Если раньше российские врачи несмотря ни на что стремились к нормальным показателям глюкозы крови и HbA1c, то сейчас, прежде чем начать лечение, они оценивают возраст пациента, возможность развития гипогликемических состояний, степень выраженности осложнений СД и проверяют наличие сопутствующих заболеваний (рис. 2) [17].
Поскольку при СД 2 типа нарушение углеводного обмена сочетается с выраженными изменениями липидного обмена, при рассмотрении вариантов компенсации метаболических нарушений следует учитывать и его показатели.
Адекватность терапии СД остается на сегодняшний день чрезвычайно актуальным вопросом, так как установлено, что гипергликемия является пусковым механизмом многих патогенетических процессов, способствующих развитию сосудистых осложнений, а строгой компенсацией диабета в течение длительного времени удается предотвратить развитие поздних осложнений заболевания.
Препараты первого выбора
Препараты сульфонилмочевины (ПСМ) представляют одну их основных групп лекарств, применяемых для лечения СД 2 типа. Они относятся к секретогенам инсулина, и их основное сахароснижающее действие связано со стимуляцией образования и высвобождения инсулина из бета-клеток. Эти препараты связываются с соответствующими рецепторами, локализованными на мембранах бета-клеток, изменяя активность К-аденозинтрифосфатазы, и таким образом способствуют закрытию К-каналов. В итоге в клетке изменяется отношение аденозинтрифосфат/аденозиндифосфат (АТФ/АДФ), что приводит к деполяризации клеточной мембраны и открытию Са-каналов. Повышение уровня Са в цитоплазме бета-клеток способствует экзоцитозу секреторных гранул и выбросу инсулина из клетки.
Все ПСМ имеют недостатки, поэтому в ряде случаев с помощью терапии препаратами этого класса не удается добиться стойкой компенсации диабета и нормализации показателей углеводного обмена. Например, пик действия любого ПСМ и постабсорбционное повышение уровня гликемии не совпадают по времени. Это приводит, с одной стороны, к недостаточному снижению уровня глюкозы в крови, а с другой – к развитию гипогликемии в следующие после приема пищи часы. Кроме того, длительное применение ПСМ истощает функции бета-клеток островков Лангерганса, что в свою очередь ухудшает компенсацию СД.
Указанные нежелательные эффекты стимулировали работу ученых по созданию группы ПСМ с качественно новыми фармакокинетическими свойствами, появившимися благодаря микронизированной форме препарата. Например, микронизированная форма глибенкламида (1,75 и 3,5 мг) имеет почти 100%-ную биодоступность и практически совпадающий с постабсорбционной гипергликемией пик сахароснижающего эффекта.
Глибенкламид обладает наиболее выраженным сахароснижающим действием среди всей группы ПСМ и в этой связи по праву считается «золотым стандартом». У глибенкламида самая высокая степень аффинности к рецепторам бета-клеток по сравнению с другими ПСМ. И все синтезированные до настоящего времени сахароснижающие препараты по эффективности действия на доклинических и клинических стадиях исследований сравнивают по силе сахароснижающего действия именно с глибенкламидом [3].
Изучение молекулярных механизмов действия ПСМ позволило обнаружить различные белковые и сигнальные молекулы, участвующие в процессах высвобождения инсулина бета-клеткой. АТФ-чувствительные каналы представляют собой два белка – рецептор 1 к сульфонилмочевине (SUR1) и трансмембранный специфический белок KIR6.2, которые экспрессируются вместе. Клонированы три изоформы рецептора: SUR1 – высокоаффинный рецептор и SUR2 и SUR3 – низкоаффинные рецепторы. К-каналы разных тканей состоят из разных субъединиц. Так, в бета-клетках островков поджелудочной железы они представлены трансмембранным комплексом SUR1/KIR6.2, в сердечной мышце – SUR2/KIR6.2, в гладкомышечных клетках сосудов – SUR2В/KIR6.1. Следовательно, разные ПСМ способны связываться с разными субъединицами (SUR1, SUR2, SUR3) и имеют разную степень аффинности [18]. Ключом к пониманию механизмов действия ПСМ явились исследования, в которых было показано, что ПСМ комплексируются с определенными участками трансмембранных комплексов. При взаимодействии ПСМ с комплексом внутри него происходят конформационные перемещения и нарушается взаимодействие определенных участков, что приводит к закрытию К-каналов. Данный механизм требует интактности всех компонентов комплекса. Таким образом, связывание глибенкламида с SUR1 определенно вызывает скрытое уменьшение прочности комплекса SUR1/KIR6.2.
Секреция инсулина возможна при открытом (хотя бы частично) трансмембранном специфическом белке KIR6.2. Если пациенты имеют мутации гена KIR6.2 в островках поджелудочной железы, что обусловливает слабую связь с SUR1, развивается гиперинсулинемия [19]. Наличие мутаций определенных генов может объяснять гетерогенное течение СД 2 типа и неудовлетворительный ответ или истощение бета-клеток на применение ПСМ [20]. И наоборот, определенные мутации генов трансмембранного комплекса объясняют удовлетворительный или неудовлетворительный ответ пациентов на лечение глибенкламидом.
Генетические исследования «поломок» трансмембранных белков свидетельствуют о том, что ПСМ могут корректировать некоторые из них. К сожалению, в рутинной практике пока нет возможности проводить генетическое типирование больных СД 2 типа, ведь по его результатам стало бы гораздо легче подбирать терапию ПСМ. Но мы надеемся, что в ближайшем будущем такая возможность появится.
Манинил
Наиболее эффективным препаратом группы ПСМ является глибенкламид (Манинил®, Берлин Хеми/А. Менарини). Манинил® применяется для лечения СД уже более 50 лет, а в нашей стране – более 30 лет.
Препарат выпускается в таблетках по 5, 3,5 и 1,75 мг. Последние две дозировки представляют микронизированную форму препарата с почти 100%-ной биодоступностью, что позволяет создать достаточную концентрацию вещества в крови и выраженный сахароснижающий эффект. Суточная доза глибенкламида – 14–20 мг. Микронизированные формы препарата принимаются за 5–7 минут до еды. Пик действия Манинила® совпадает с постабсорбционной гипергликемией, поэтому опасность гипогликемических состояний минимальна.
Биологический период полураспада составляет 5 часов, длительность гипогликемического действия – около 24 часов. Трансформация глибенкламида происходит в печени путем образования двух метаболитов, обладающих лишь незначительной сахароснижающей активностью. Один из метаболитов экскретируется с мочой, другой – через желудочно-кишечный тракт.
На сегодняшний день Манинил® остается наиболее востребованным среди всех ПСМ. Это показало анкетирование врачей, проведенное сотрудниками компании «Берлин-Хеми/А. Менарини» практически во всех регионах России. Большинство респондентов (65,4%) начинают лечение с минимальной дозы (1,75 мг), ожидая более выраженный сахароснижающий эффект от приема данного препарата, чем от приема других ПСМ. В качестве показания к назначению Манинила® врачи называют гликемию – как тощаковую, так и постпрандиальную. Гипогликемические состояния, которые отмечают при приеме Манинила®, большинство врачей (70%) связывают с неправильным титрованием дозы и неинформированностью больных о необходимости приема пищи после приема препарата.
Пример из клинической практики. Две пациентки принимают препарат Манинил® в течение многих лет. Одной пациентке 72 года, страдает СД 2 типа с 64 лет и имеет ожирение абдоминального типа (индекс массы тела (ИМТ) 32,8 кг/м2). В начале заболевания был назначен метформин. В связи с диспепсическими явлениями препарат отменили и назначили Манинил® в дозе 1,75 мг по 1/2 таблетки 2 раза в день. Уровень глюкозы в течение короткого времени нормализовался – натощак до 6,0 ммоль/л, в течение дня до 8–9 ммоль/л – и остается таким уже 8 лет при неизменных ИМТ и дозе препарата. Его отмена привела к повышению гликемии. Другая пациентка болеет СД 2 типа с 52 лет (также на фоне ожирения, ИМТ 33,6 кг/м2), получает терапию Манинилом в дозе 1,75 мг 2 раза в день около 7 лет. Показатели гликемии у больной в пределах нормы. Перевод на сахароснижающие препараты других групп приводит к декомпенсации углеводного обмена.
Без сомнения, эти пациентки имеют сходные патологические нарушения функционирования бета-клеток, которые на момент обследования полностью компенсируются препаратом Манинил®.
Вывод
При назначении ПСМ необходимо знать о фармакокинетике и фармакодинамике всех препаратов этой группы. Врач-эндокринолог, подбирая ПСМ, должен взвесить все за и против: оценить длительность СД, динамику массы тела, тяжесть течения, функцию почек, опасность гипогликемических состояний и возможность осложнений – и только потом назначить препарат больному.
В последние годы в арсенале врачей появилась новая, высокоэффективная микронизированная форма глибенкламида (Манинил® 1,75 и 3,5 мг), которая имеет практически 100%-ную биодоступность и пик сахароснижающего действия, совпадающий с постабсорбционной гипергликемией, что обеспечивает значительное снижение риска гипогликемических состояний.
