Инсулиноподобный фактор роста при диабете

Как любой родитель “сладкого” ребенка, я обязан вникать в нюансы компенсации. И я это делаю старательно. Общаясь с другими родителями, мы часто говорим о неуправляемых подъёмах глюкозы в крови ночью. Но почему они происходят и насколько они “неуправляемы”, я хочу рассказать и изложить свою точку зрения в данной статье.
Наиболее распространённая ситуация, когда подъём сахара происходит в первой половине ночи. Иногда бывают незначительные временные смещения. Этот фактор достаточно известен и давно описан, например, в книге Р. Ханаса “Диабет 1-го типа у детей, подростков и молодых людей.” Связано данное явление с крайне положительным и необходимым для детей и подростков процессом – ростом организма. Это очень здорово, когда дети растут. В случае с нашими “сладкими”, этот процесс оборачивается высокими “сахарами”. Происходит это потому, что гормон роста, называемый соматотропин (СТГ, соматотропный гормон, соматотропин, гормон роста) может вырабатываться несколько раз в течение суток, но самый высокий пик его выработки проявляется ночью, примерно через час-два после засыпания. И, как говорят родители, у которых это явление носит острый характер: “Коли-не коли инсулин – как в воду”. И это правда. Соматотропин является контраинсулярным гормоном, и он не даёт усваиваться инсулину в организме. Необдуманная инсулинотерапия (“скалывание” высоких сахаров) в такой момент не просто не принесетт никакого результата, но и, достаточно часто, может вызвать ровно обратный и ненужный результат – гипогликемию. Происходит это потому, что после подъёма уровня глюкозы в крови из-за действия соматотропина, через некоторое время всё само собой идёт на спад. “Сахара”, конечно, не становятся идеальными, но снижение, практически всегда, присутствует, потому что работает инсулин “продлённого” действия. И, если “скалывание” происходит именно в процессе спада выработки соматотропина, то динамика снижения резко увеличивается, и мы получаем гипогликемию. Вот такая “качель” посреди ночи. И мы получаем “американские горки”. Легли с СК 7 ммолей, в 2 часа ночи – 13 ммолей, к 4 часам опустились к 8 ммолям и в 5.30 ночи к нам “приехала” “утренняя заря”. Встаём с СК 12 ммолей и с грустью запиваем чашечкой чая своё бессилие. Знакомо?
Эти процессы описаны. Ничего нового. С вопросом “Кто виноват?” – мы разобрались. Остался вопрос “Что делать?”. И, как мне кажется, ответ на этот вопрос зреет уже очень давно. Но я не нашёл, по крайней мере “сходу”, ни одного прямого исследования, изучающего устранение этой проблемы. А проблема есть и она более существенна, чем просто “высокие сахара”, и я вам расскажу почему.
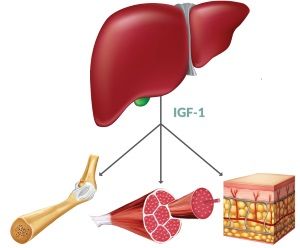 Дело в том, что у самототропина есть хороший “напарник/посредник”, который устраняет его (СТГ) негативные последствия. Зовут этого “друга” инсулиноподобный фактор роста (ИФР-1, соматомедин С, англ. IGF1). Механизм действия/взаимодействия описывать достаточно утомительно. Справочного материала в интернете достаточно. А вот основные функции мы рассмотрим. ИФР-1 участвует в процессах роста, именно от его наличия зависит: рост костей и суставов; рост мышечной массы; способствует росту клеток кожи и клеток системы пищеварения; развитию полового созревания и др. Соответственно его дефицит приводит ровно к обратным эффектам. Например, в исследовании, проведённом на базе эндокринологического отделения СПбГПМА в 2012 году на 59 детях в возрасте от 4 до 17 лет, со стажем заболевания от 3 до 17 лет, было выявлено: “… снижение концентрации ИФР-1 у 93% детей с задержкой роста, и у 56% детей с нормальным ростом…” При чём сопутствующими последствиям стал стеатоз печени – 74%. Дефицит ИФР-1 в данном случае не зависел от возраста и стажа. И, опять же, объяснимо. ИФР-1 образуется при участии гормона роста, о котором говорилось выше – самототропина и инсулина! А его, как правило, у нас в дефиците, учитывая среднестатистический HbA1 у детей и подростков. То есть, если не хватает инсулина, то образуется дефицит ИФР-1, а значит этот дефицит имеется фактически у каждого “сладкого”. К чему это может привести (и приводит) я вкратце описал выше. Но эта история о важности ИФР-1 и о том, у кого и каким образом образовался дефицит. Связь же с диабетом 1 типа гораздо глубже.
Дело в том, что у самототропина есть хороший “напарник/посредник”, который устраняет его (СТГ) негативные последствия. Зовут этого “друга” инсулиноподобный фактор роста (ИФР-1, соматомедин С, англ. IGF1). Механизм действия/взаимодействия описывать достаточно утомительно. Справочного материала в интернете достаточно. А вот основные функции мы рассмотрим. ИФР-1 участвует в процессах роста, именно от его наличия зависит: рост костей и суставов; рост мышечной массы; способствует росту клеток кожи и клеток системы пищеварения; развитию полового созревания и др. Соответственно его дефицит приводит ровно к обратным эффектам. Например, в исследовании, проведённом на базе эндокринологического отделения СПбГПМА в 2012 году на 59 детях в возрасте от 4 до 17 лет, со стажем заболевания от 3 до 17 лет, было выявлено: “… снижение концентрации ИФР-1 у 93% детей с задержкой роста, и у 56% детей с нормальным ростом…” При чём сопутствующими последствиям стал стеатоз печени – 74%. Дефицит ИФР-1 в данном случае не зависел от возраста и стажа. И, опять же, объяснимо. ИФР-1 образуется при участии гормона роста, о котором говорилось выше – самототропина и инсулина! А его, как правило, у нас в дефиците, учитывая среднестатистический HbA1 у детей и подростков. То есть, если не хватает инсулина, то образуется дефицит ИФР-1, а значит этот дефицит имеется фактически у каждого “сладкого”. К чему это может привести (и приводит) я вкратце описал выше. Но эта история о важности ИФР-1 и о том, у кого и каким образом образовался дефицит. Связь же с диабетом 1 типа гораздо глубже.
ИФР-1 и диабет 1 типа.
В работе наших учёных А.Г. Геннадиник, А.А. Нелаева “Роль инсулиноподобного фактора роста-I в метаболизме, регуляции клеточного обновления и процессах старения” прямо указано: “… ИФР-I имеет инсулиноподобное действие. Синтез ИРФ-I в печени увеличивается под действием СТГ (соматотропин, соматотропный гормон роста – авт.) и инсулина. Повышенный уровень инсулина через механизм гипогликемии способствует повышению СТГ, обладающего контраинсулярным действием. СТГ, в свою очередь, стимулирует продукцию ИФР-I, отменяющего гипергликемическое действие гормона роста. У больных диабетом наблюдается разобщение действия СТГ и ИФР-I. При сахарном диабете 1 типа (СД1) ИФР-I снижен из-за дефицита инсулина, а СТГ относительно повышен, на фоне снижения соматостатина. Так как рост-стимулирующий эффект СТГ опосредуется ИФР-I, больные СД1 отстают в физическом и половом развитии.” Иначе говоря, если бы ИФР-1 был в норме, то он улучшал бы “впитываемость” инсулина. Но, к сожалению, резкое снижение ИФР-1 при манифестации, несмотря на временную передышку “медового месяца”, которая возможно достигается благодаря восстановлению ИФР-1 (идёт компенсация “внешним” инсулином), не приводит к должному результату. В выводах исследования “Инсулиноподобный фактор роста – 1 при диагностике и в последующие годы у подростков с диабетом 1 типа”, опубликованном 18 марта 2018 года, указано: “…наши результаты показывают, что, у впервые диагностированных подростков с диабетом 1 типа и нарушенным обменом веществ, выявляется низкий уровень ИФР-1. Он быстро улучшается при лечении инсулином, но позже имеет тенденцию к снижению одновременно со снижением секреции эндогенного (“своего”-авт.) инсулина.”
Зная про данные эффекты, оказываемые компенсацией ИФР-1, почему же полученные знания, не применяют на практике? Я, друзья, пока не готов на это ответить. Но отмечу, общаясь с диабетиками, например, из США, в терапии они применяют совершенно официально то, что у нас не применяется. И ИФР-1 они применяют успешно для компенсации гликемии. Более того, есть достаточно много исследований о положительных результатах (на PubMed’е чуть более 4000 исследований о связи ИФР-1 и диабета) при использовании в лечении СД. Но, в основном, эти исследования относятся к диабету 2 типа и о снижении инсулинорезистентности. Тем не менее, есть исследование и о применении компенсации ИФР-1 “… в лечении диабета, особенно если он начался до полового созревания.” /Bonday C et al. Clinical Uses of Insulin-like Growth Factor I. Ann Int Med 1994; 120(7):593- 601/ Думаю, никто просто не брался для детального проведения анализа и внедрения в клиническую практику.
Но, исходя из вышеизложенного, выводы достаточно простые:
1. С большей степенью вероятности практически у каждого “сладкого” имеется дефицит ИФР-1.
2. Дефицит ИФР-1 – это не очень хорошо.
3. Один из показателей крайне низкого ИФР-1 – сильный пик СК в 1-2 ночи.
4. … вывод напрашивается сам, но я его вам не озвучу. Ну или так и будете продолжать вставать с высокими сахарами.
Хороших сахаров вам, мои друзья!
Читайте блог Артура Аксенова на ЖЖ: “Лучи Надежды”
Источник
ИФР-1 и его сигнальные каскады в ЦНС
Инсулиноподобный фактор роста-1 (ИФР-1), называемый также соматомедином С, как и инсулин, относится к пептидам инсулинового семейства, представляет собой одиночную полипептидную цепь, включающую 70 аминокислотных остатков и три внутренних дисульфидных связи. ИФР-1 в основном синтезируется в печени и мышцах, но также может экспрессироваться в некоторых отделах мозга, хотя и в сравнительно небольших количествах.
Иммунореактивность к ИФР-1 обнаружена в астроцитах фронтальной коры и гиппокампа, в клетках Пуркинье мозжечка. Поскольку периферический инсулиноподобный фактор роста-1, подобно инсулину, способен преодолевать гематоэнцефалический барьер (ГЭБ), то весьма сложно определить какую роль в центральных эффектах ИФР-1 играет его периферический пул, а какой вклад в них вносит ИФР-1, синтезируемый непосредственно в ЦНС.
Инсулиноподобный фактор роста-1 является важнейшим регулятором функций мозга, контролирует нейротрофические процессы и нейрогенез, является важнейшим нейропротектором, осуществляет центральную регуляцию периферического метаболизма. На это указывают многочисленные данные о том, что в ЦНС присутствуют все основные звенья ИФР-1-сигнальной системы, а нарушения в ней приводят к развитию нейродегенеративных, нейроэндокринных и метаболических заболеваний, включая сахарный диабет (СД) 2-го типа и болезнь Альцгеймера (СД 3-го типа).
Рецепторы ИФР-1, так же как и инсулиновый рецептор (ИР), широко распространены в мозге (табл. 2). Наиболее высокий уровень их экспрессии отмечается в обонятельной луковице, паравентрикулярных ядрах гипоталамуса, таламусе, гиппокампе, что сходно с распределением в мозге ИР. При этом в сосудистом сплетении, мозжечке, энторинальной области коры и миндалевидном теле число рецепторов инсулиноподобного фактора роста-1 в несколько раз превышает число ИР.
Асимметрия в распределении рецепторов ИФР-1 в левой и правой областях гиппокампа у крыс в первые недели жизни играет важную роль в развитии когнитивных функций и формировании поведенческих реакций, а нарушение такого распределения приводит к ряду психических заболеваний. Система ИФР-1-рецептор в мозге отвечает за рост и развитие мозга, выживаемость нейронов, синтез миелиновых оболочек, функционирование астроцитов, рост сосудов, возбудимость нейронов, олигодендрогенез. Оказывая регуляторное влияние на гипоталамические нейроны, ИФР-1 контролирует основные звенья эндокринной системы организма, и эти его эффекты в значительной степени усиливаются и модулируются инсулином.
Таблица 2. Распределение рецепторов ИФР-1 в мозге
Как и в случае инсулинового рецептора, активация рецептора инсулиноподобного фактора роста-1 гормоном приводит к аутофосфорилированию тирозинкиназного домена рецептора, что индуцирует взаимодействие фосфорилированных по тирозину сайтов с трансдукторными IRS-белками и адапторным SHC-белком (рис. 5). Фосфорилированные формы IRS-белков взаимодействуют с SH2-доменами регуляторной p85-субъединицы PI3K, вызывая высвобождение и последующую активацию каталитической субъединицы PI3K, что приводит к фосфорилированию AKT-киназы и стимуляции широкого спектра зависимых от нее эффекторных белков и транскрипционных факторов.
Активация AKT-киназы приводит к повышению синтеза белка и опосредует антиапоптотические эффекты ИФР-1, вызывая ингибирование активности GSK3P и каспазы-9. Установлено, что AKT-киназа фофорилирует и, таким образом, активирует цАМФ-зависимый транскрипционный фактор CREB и регуляторные белки Bcl-2 и BCL-XL, которые осуществляют ингибирование проапоптотического транскрипционного фактора BAD и каспазы-9, сответственно.
Регуляция роста аксонов и регенеративных процессов в нейронах, а также значительное усиление синтеза белка осуществляется в результате вызываемого AKT-киназой фосфорилирования комплекса mTORC1, основным функциональным компонентом которого является серин/треониновая протеинкиназа mTOR. Наряду с этим, индуцируемая ИФР-1 активация AKT-киназы вызывает фосфорилирование и ингибирование активности транскрипционных факторов Forkhead-семейства (FoxO), контролирующих широкий спектр внутриклеточных процессов, как тех из них, которые приводят к повышению выживаемости клеток, так и ведущих к активации апоптоза.
Активация факторов Forkhead-семейства в мозге приводит к запуску апоптотических процессов вследствие индукции промотора апоптоза FasL (apoptosis-stimulating fragment ligand) и фактора Bim (Bcl-2 interacting mediator of death).
Негативная регуляция 3-фосфоинозитидного пути реализуется вследствие фосфорилирования IRS-белков по остатку серина, что приводит к нарушению их взаимодействия с рецептором инсулиноподобного фактора роста-1, инактивации IRS-белка и его дальнейшей деградации в протеосомах. В молекулах IRS-1 и IRS-2 локализовано много сайтов, мишеней для различных серин/треониновых протеинкиназ, активность которых зависит как от ИФР-1, так и от других сигнальных молекул. Вследствие этого, фосфорилирование IRS-белков представляет собой один из ключевых механизмов регуляции активности каскада ИФР-1/рецептор ИФР-1/IRS-белок и является важнейшим фактором развития резистентности к инсулиноподобному фактору роста-1.
Другой сигнальный каскад, активируемый ИФР-1, реализуется через посредство взаимодействия активированного гормоном рецептора ИФР-1 с SHC-белками, которые функционально связаны с Ras-белками, инициирующими запуск каскада митогенактивируемых протеинкиназ (МАПК) — Raf-1-киназы, MEK- и ERK-киназ, которые ингибируют апоптоз и повышают выживаемость нейронов, ингибируя активность каспазы-9 и ядерного фактора NF-kB, а также ослабляя окислительный стресс и подавляя воспалительные процессы в мозге (рис. 5).
Важную роль в функционировании этого каскада играет адапторный GRB-2-белок, который образует комплекс с SHC-белком и опосредует активацию малых ГТФ-связывающих белков Ras-семейства. Содержание комплекса SHC/GRB-2 положительно коррелирует со степенью активации Ras-белков, Raf-1-киназы и ERK-киназ. Активированная форма ERK фосфорилирует большое число транскрипционных факторов, которые вовлечены в регуляцию клеточного роста и митогенез. Следует отметить, что активация каскада МАПК играет более важную роль в ИФР-1-сигнальных путях, чем в инсулиновой сигнальной системе, хотя, строго говоря, это в значительной степени зависит от типа клеток и их метаболического статуса.
Рисунок 5. Сигнальные каскады, регулируемые инсулиноподобным фактором роста-1
ИФР-1 сигнальная система мозга в условиях сахарного диабета 2-го типа и метаболических расстройств
В отличие от СД 1-го типа, когда в мозге отмечается дефицит инсулина и ИФР-1, при сахарном диабете 2-го типа и метаболическом синдроме (
МС) существенных изменений концентрации инсулиноподобного фактора роста-1 в ЦНС не выявлено. Снижение концентрации биодоступного (свободного) ИФР-1 на периферии отмечено при длительно текущих тяжелых формах СД 2-го типа и в условиях неадекватного гликемического контроля, Причиной этого является не столько снижение общего ИФР-1, сколько значительное повышение концентрации ИФР-связывающего белка 1-го типа (ИФРСБ-1).
Интересно проследить динамику изменения концентрации ИФРСБ-1 на разных стадиях развития инсулиновой резистентности и связанных с этим метаболических расстройств. Так у пациентов с ожирением, у которых отмечали лишь незначительное снижение чувствительности тканей к инсулину, уровень общего инсулиноподобного фактора роста-1 заметно не менялся, в то время как концентрация свободного ИФР-1 начинала повышаться вследствие снижения уровня ИФРСБ-1. В дальнейшем при прогрессировании инсулиновой резистентности и развитии СД 2-го типа уровень ИФРСБ-1 начинал повышаться, что приводило теперь уже к снижению концентрации свободного ИФР-1.
Причиной такого снижения может быть повышение уровня другого ИФР-связывающего белка — ИФРСБ-3, на что указывает отчетливо выраженное снижение соотношения ИФР-1/ИФРСБ-3 у пациентов с сахарным диабетом 2-го типа. Одной из причин повышения уровня различных изоформ ИФРСБ является усиление их неэнзиматического гликозилирования в условиях умеренной гипергликемии, характерной для СД 2-го типа и МС.
Повышение уровня ИФРСБ-1 в условиях предиабета положительно коррелирует с развитием инсулиновой резистентности в ЦНС и периферических тканях и может быть использовано в качестве чувствительного маркера для идентификации пациентов с нарушенной толерантностью к глюкозе и сниженной инсулиновой чувствительностью, предшествующих развитию явного СД 2-го типа.
Повышение концентрации общего пула ИФРСБ является одной из причин неврологических нарушений и нейродегенеративных изменений, возникающих в условиях предиабета и сахарного диабета 2-го типа, тем более что снижение соотношения ИФР-1/ИФРСБ характерно для болезни Альцгеймера и сосудистой деменции, которые часто встречаются у диабетических пациентов. Таким образом, снижение концентрации свободного инсулиноподобного фактора роста-1 в условиях предиабета и раннего СД 2-го типа на периферии может быть одним из факторов, вызывающих ослабление функциональной активности ИФР-1-зависимых сигнальных путей в мозге.
В то же время общепринятой является точка зрения, что основной причиной снижения активности ИФР-1 сигнальной системы в мозге при СД 2-го типа и МС, как и в случае инсулиновой сигнальной системы, являются нарушения функциональной активности рецептора инсулиноподобного фактора роста-1, IRS-белков и компонентов 3-фосфоинозитидного пути, а также повышение активности негативных регуляторов ИФР-1 сигналинга, в первую очередь протеинтирозинфосфатазы PTP1B. Следует, однако, отметить, что сведения о снижении уровня и функциональной активности рецепторов ИФР-1 в условиях метаболических расстройств немногочислены.
Так в мозге грызунов с негенетическими моделями предиабета и сахарного диабета 2-го типа, которые вызывали высокожировой диетой и длительным потреблением глюкозы или фруктозы, было обнаружено отчетливо выраженное снижение экспрессии и функциональной активности рецепторов инсулиноподобного фактора роста-1. Поскольку достоверные изменения экспрессии и связывающих характеристик ИР в ЦНС при этом отсутствовали, то был сделан вывод, что причиной многих метаболических дисфункций, наблюдаемых у животных с негенетическими моделями СД 2-го типа, может быть ослабление активности ИФР-1 сигнальной системы мозга.
Значительно больше данных имеется в отношении ослабления активности пострецепторных компонентов ИФР-1 сигнального пути. Однако, поскольку эти же компоненты (IRS-белки, PI3K, AKT-киназа) вовлечены в функционирование инсулиновой и лептиновой систем мозга, то трудно дифференцировать, на какие сигнальные каскады в наибольшей степени влияет снижение их активности. Нарушения в ИФР-1-зависимых сигнальных каскадах мозга вовлечены в этиологию и патогенез нейродегенеративных заболеваний.
Так показано, что в мозге пациентов с болезнью Альцгеймера существенно снижена экспрессия и функциональная активность рецептора инсулиноподобного фактора роста-1, IRS-1 и IRS-2, PI3K, AKT-киназы, причем степень такого снижения положительно коррелирует с выраженностью нейродегенеративных изменений. Это приводит к нарушению метаболизма Р-амилоидного пептида и формированию амилоидных бляшек в ЦНС, а также к развитию центральной инсулиновой резистентности, характерной для болезни Альцгеймера (СД 3-го типа).
Подходы к коррекции ИФР-1 сигналинга в ЦНС при сахарном диабете 2-го типа и метаболическом синдроме в значительной степени сходны с таковыми, которые используются для повышения функциональной активности инсулиновой сигнальной системы. Наибольший интерес здесь представляют селективные ингибиторы фосфатазы PTP1B, которые в одинаковой степени усиливают как инсулиновые, так и ИФР-1 сигнальные пути. В условиях нарушения инсулинового сигналинга интрацеребральное введение инсулиноподобного фактора роста-1 способно восстанавливать метаболические процессы в мозге, но такие данные получены только для животных со стрептозотоциновой моделью СД 1-го типа.
Эффективная доза ИФР-1 в сравнении с инсулином существенно ниже, примерно на порядок, причем эффект ИФР-1 заметно усиливается при его совместном использовании с инсулином. Это связано с синергичностью действия инсулина и инсулиноподобный фактор роста-1 на активность 3-фосфоиноизитидных путей в нейрональных клетках. Основываясь на этих данных можно сделать вывод о целесообразности совместного введения инсулина и ИФР-1 для повышения центральной и периферической инсулиновой чувствительности в условиях СД 2-го типа и МС. Однако для этого необходимы исследования на экспериментальных моделях этих заболеваний.
Определенную долю пессимизма здесь вносят недавние данные, полученные при изучении влияния интрацеребрально вводимого ИФР-1 на консолидацию памяти у здоровых крыс. Так билатеральное введение инсулиноподобного фактора роста-1 в дорсальный гиппокамп существенно не влияло на зависимую от гиппокампальных нейронов память у крыс, в то время как инъекции инсулина в этом отношении были весьма эффективными. Здесь, однако, необходимо учитывать, что гиперактивация ИФР-1 сигнального каскада в мозге здоровых крыс при центральном введении гормона может скорее негативно, чем позитивно влиять на их когнитивные функции.
Более адекватными в этом отношении были бы исследования на животных со сниженным уровнем центрального ИФР-1 или резистентностью к нему нейрональных клеток, а также с метаболическими расстройствами и нейродегенеративными изменениями в ЦНС с характерными для них нарушениями инсулиноподобного фактора роста-1 сигналинга.
А.О. Шпаков, К.В. Деркач
Source: medbe.ru
Источник
