Инсулиновая помпа у детей с диабетом
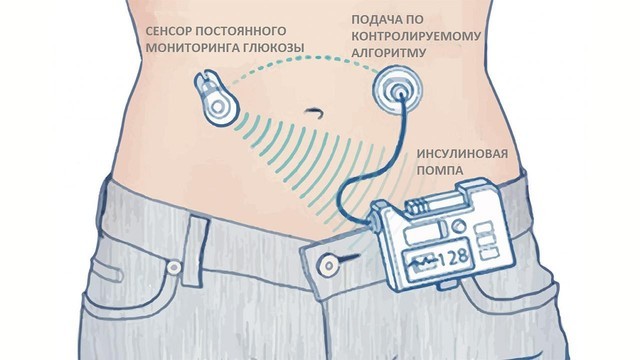
Что это такое?
Строго говоря, это устройства для постоянного подкожного введения инсулина, в том числе с постоянным и непрерывным мониторингом гликемии в реальном времени.
Инсулиновая помпа выглядит как небольшая коробочка – пудреница. Но только устроена помпа сложнее, это скорее маленький компьютер. Но помпа не решит все проблемы человека с диабетом, потому что пользоваться прибором нужно учиться.
Современные помпы состоят из нескольких блоков, первый из которых ― это монитор глюкозы. Под кожу имплантируется сенсор с иглой (очень маленькой), которая несколько сотен раз измеряет уровень сахара крови в течение длительного времени. Затем эти данные можно вывести на компьютер и посмотреть, что происходит в организме.
В сам корпус инсулиновой помпы устанавливается флакон с инсулином и через канюлю (тупоносую иглу), инсулин может поступать человеку внутрь, под кожу. В таких приборах применяют инсулин только короткого действия. Заряжать новые порции инсулина нужно с помощью готовых картриджей. Их можно либо менять целиком, либо перезаряжать. Начинать с помпы людям, у которых сахарный диабет обнаружили недавно, не рекомендуется. К новому состоянию организма следует привыкнуть и научиться контролировать уровень глюкозы в крови другими методами.
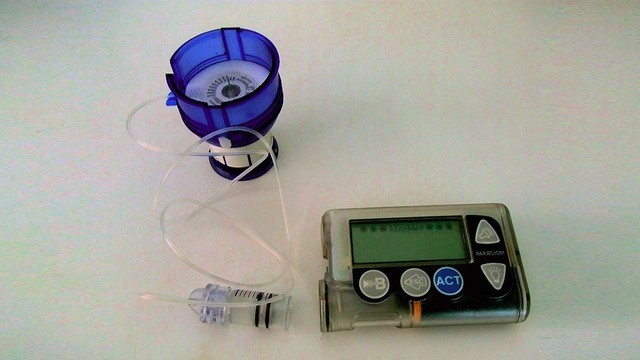 Рисунок 1. Примерно так может выглядеть комплектация инсулиновой помпы. Источник: СС0 Public Domain
Рисунок 1. Примерно так может выглядеть комплектация инсулиновой помпы. Источник: СС0 Public Domain
Помпу можно (и нужно) программировать – для этого и нужно проходить обучение. Так, можно запланировать марафон и заранее внести нужные данные о подаче инсулина в помпу. И точно так же запланировать следующий после марафона день – отдыха. Это важно уметь делать потому, что при разном уровне нагрузки человеку потребуется разное количество инсулина, причем важно правильно рассчитать время. Можно даже запрограммировать так, чтобы в первой половине дня инсулина вводилось меньше, а во вторую – больше.
Сейчас ведутся разработки такой помпы, которая бы сама смогла измерять уровень сахара в крови и сама бы могла вводить нужное количество инсулина. То есть такая помпа могла стать искусственной поджелудочной железой.
Кому показано применение инсулиновой помпы?
В целом, всем людям с сахарным диабетом можно использовать это устройство. Также, людям с диабетом 1-го типа рекомендуют назначить режим постоянной подкожной инфузии инсулина, например, после пересадки почки. Конечно, при отсутствии противопоказаний (об этом ниже). Это повышает шансы более благоприятного исхода после операции.
А вот беременным применение помповой инсулинотерапии показано только после обучения. Перевод с инъекций на инсулиновую помпу должен быть осуществлен не позднее 12-13 недели беременности. Но помпа всегда необходима тем женщинам, у кого был диагностирован гестационный диабет. Несмотря на то, что это состояние после родов скорее всего пройдет само, контролировать его во время беременности все равно важно.
Какие противопоказания?
Согласно федеральным клиническим рекомендациям, к помповой инсулинотерапии есть относительные и абсолютные противопоказания.
Относительные (временные)
- Явный психоэмоциональный стресс. В таком состоянии человек не сможет уделить достаточно внимания обучению принципам работы с инсулиновой помпой. Если врач обнаружит симптомы серьезного эмоционального напряжения или стресса, то перевод на помпу будет отложен.
- Острое соматическое (не психическое) заболевание или обострение хронического. Так как организм в этот момент находится не совсем в стабильном состоянии, осуществлять тонкую настройку прибора нецелесообразно.
- Впервые диагностированный сахарный диабет 1-го типа. Это ограничение временно потому, что для начала врачи рекомендуют пациентам научиться считать инсулин и использовать его другими методами. А когда уже будет некоторый опыт жизни с этим заболеванием – можно перейти на помпу.
Абсолютные
- Нежелание или неспособность человека пользоваться помпой правильно и с безопасностью для себя.
- Обучению препятствует наличие психического заболевания или другого состояния, которое потенциально может привести к неправильному обращению с прибором. В эту категорию попадают наркозависимость и алкоголизм.
- Сниженное зрение – настолько, что человек не может гарантировать точное взаимодействие с интерфейсами прибора. В том числе и из-за диабетической ретинопатии.
 Рисунок 2. Как работает помпа. Источник: СС0 Public Domain
Рисунок 2. Как работает помпа. Источник: СС0 Public Domain
Но если человек хочет и может адекватно контролировать свою инсулинотерапию, выражает готовность научиться пользоваться помпой – тогда проблем не будет. Большим плюсом будет знания и навыки подсчета углеводов. Преимуществом будет ведение здорового образа жизни и занятия спортом.
Сколько стоит инсулиновая помпа?
Порядка 150-200 тысяч рублей. И это не считая расходных материалов – кассеты с инсулином, которые нужно менять по мере их истощения. Однако в России инсулиновую помпу можно получить по полису.
Как получить инсулиновую помпу бесплатно?
В России по закону любой человек с сахарным диабетом может рассчитывать на получение инсулиновой помпы по программе обязательного медицинского страхования при наличии медицинских показаний.
Имплантация инсулиновой помпы входит в перечень услуг, составляющих высокотехнологичную медицинскую помощь.
Для того, чтобы инсулиновую помпу имплантировали бесплатно, попробуйте связаться с региональным отделением Минздрава, либо обратитесь в государственный медицинский центр. Обычно в такие центры можно обратиться по направлению из поликлиники. Затем придется пройти обучение, либо показать, что необходимые навыки для адекватного обращения с прибором имеются. Почти со 100% вероятностью проблем с получением инсулиновой помпы по ОМС не возникнет.
Заключение
При сахарном диабете не обязательно всю оставшуюся жизнь делать уколы. Инсулиновая помпа – более удобный и современный вариант для контроля сахара в крови. В России этот прибор можно получить бесплатно, достаточно полиса ОМС. В любом городе можно узнать в центральной больнице, куда обратиться, чтобы получить инсулиновую помпу. Если нет серьезных противопоказаний – а их не так много, вопрос решается достаточно просто.
Источники
- Burakowska K., Górka P., Penner GB. Effects of canola meal inclusion rate in starter mixtures for Holstein heifer calves on dry matter intake, average daily gain, ruminal fermentation, plasma bolites, and total-tract digestibility. // J Dairy Sci – 2021 – Vol – NNULL – p.; PMID:33896627
- Mowitz M., Ulriksdotter J., Bruze M., Svedman C. In Response to the Letter to the Editor on Minimizing Adverse Skin Reactions to Wearable Continuous Glucose Monitoring Sensors. // J Diabetes Sci Technol – 2021 – Vol – NNULL – p.19322968211008241; PMID:33880949
- Haak T., Herrmann E., Lippmann-Grob B., Tombek A., Hermanns N., Krichbaum M. The Effect of Prandial Insulin Applied for Fat Protein Units on Postprandial Glucose Excursions in Type 1 Diabetes Patients with Insulin Pump Therapy: Results of a Randomized, Controlled, Cross-Over Study. // Exp Clin Endocrinol Diabetes – 2021 – Vol – NNULL – p.; PMID:33878763
- Wang J., Zhang L., Wang X., Dong J., Chen X., Yang S. Application of Nano-Insulin Pump in Children with Diabetic Ketoacidosis. // J Nanosci Nanotechnol – 2021 – Vol21 – N10 – p.5051-5056; PMID:33875090
- Sandhu S., Wang T., Prajapati D. Acute esophageal necrosis complicated by refractory stricture formation. // JGH Open – 2021 – Vol5 – N4 – p.528-530; PMID:33869789
- Finsterer J. Lifestyle Changes Normalize Serum Lactate Levels in an m.3243A>G Carrier. // Am J Case Rep – 2021 – Vol22 – NNULL – p.e930175; PMID:33867519
- Gaudillère M., Pollin-Javon C., Brunot S., Fimbel SV., Thivolet C. Effects of remote care of patients with poorly controlled type 1 diabetes included in an experimental telemonitoring programme. // Diabetes b – 2021 – Vol – NNULL – p.101251; PMID:33862199
- Alonso GT., Ebekozien O., Gallagher MP., Rompicherla S., Lyons SK., Choudhary A., Majidi S., Pinnaro CT., Balachandar S., Gangat M., Curda Roberts AJ., Marks BE., Creo A., Sanchez J., Seeherunvong T., Jimenez-Vega J., Patel NS., Wood JR., Gabriel L., Sumpter KM., Wilkes M., Rapaport R., Cymbaluk A., Wong JC., Sanda S., Albanese-O’neill A. Diabetic ketoacidosis drives COVID-19 hospitalizations in children with type 1 diabetes. // J Diabetes – 2021 – Vol – NNULL – p.; PMID:33855813
- Fredette ME., Zonfrillo MR., Park S., Quintos JB., Gruppuso PA., Topor LS. Self-reported insulin pump prescribing practices in pediatric type 1 diabetes. // Pediatr Diabetes – 2021 – Vol – NNULL – p.; PMID:33855806
- Rubin-Falcone H., Fox I., Hirschfeld E., Ang L., Pop-Busui R., Lee JM., Wiens J. Association Between Management of Continuous Subcutaneous Basal Insulin Administration and HbA1C. // J Diabetes Sci Technol – 2021 – Vol – NNULL – p.19322968211004171; PMID:33853374
Сахарный диабет 1-го типа (СД 1-го типа) остается одним из наиболее распространенных эндокринных заболеваний в детском возрасте [1, 2]. Достижение стойкой компенсации при данной патологии является залогом снижения частоты осложнений и увеличения продолжительности жизни, что возможно только при проведении адекватной заместительной инсулинотерапии [1, 3].
Цель: оценить роль помповой инсулинотерапии в достижении компенсации СД 1-го типа у детей разного возраста.
Материалы и методы
Исследуемая группа – пациенты с СД 1-го типа (n = 36) в возрасте от 5 до 18 лет (средний возраст 13,3 ± 3,04 года), получающие непрерывную подкожную инфузию инсулина (НПИИ) посредством инсулинового дозатора – помпы. В соответствии с критериями включения данную группу составили пациенты с длительностью болезни от одного года до 10 лет (5,4 ± 3,4 года) и продолжительностью помповой инсулинотерапии от 3 месяцев до 2,5 лет (в среднем 1,2 ± 0,7 лет). В качестве инсулинового дозатора пациентам была установлена помпа Accu-Сhek spirit (Roche Diagnostics GmbH, Германия). Перевод пациентов на помповую инсулинотерапию осуществлялся в стационарных условиях. Постановке помпы в каждом случае предшествовало индивидуальное трехдневное обучение пациента и/или его родителей управлению носимым дозатором. С переходом на новый режим инсулинотерапии комбинация инсулинов у всех пациентов была заменена на постоянную подкожную инфузию исключительно инсулинами ультракороткого действия (в концентрации 100 МЕ/мл): у 24 человек (66,7%) использовался НовоРапид™ (Novo Nordisk, Дания), у 12 человек (33,3%) – Хумалог™ (Eli Lilly, США).
Анализ эффективности помповой инсулинотерапии был проведен с использованием данных клинико-метаболического контроля: оценивались показатели суточной гликемии, HbA1c, частота гипогликемических и кетоацидотических состояний; дневников самоконтроля пациентов; опросников (особенности режимов работы инсулинового дозатора, уровень социальной адаптации пациентов).
Статистическая обработка результатов проводилась с помощью программы istica 6,0. Количественные показатели представляли в виде M + s (средняя арифметическая, стандартное отклонение). Сравнение двух количественных показателей в разных группах осуществляли при помощи критерия Манна-Уитни. Различия считали статистически значимыми при p < 0,05.
Результаты и обсуждение
Основным показанием для начала НПИИ у пациентов исследуемой группы послужила метаболическая нестабильность. На фоне интенсифицированной инсулинотерапии 75% обследованных пациентов находились в состоянии декомпенсации обменных процессов. В целом уровень гликированного гемоглобина составил 9,1 ± 2,6%. У 5 детей (16,7%) была выявлена высокая чувствительность к инсулину (потребность в инсулине составила ≤ 0,4 Ед/кг/сут). Гипогликемические реакции (ежедневные дневные и частые, до 3-4 раз в неделю, ночные эпизоды) стали причиной изменения способа инсулинотерапии у троих пациентов. У 17 человек НПИИ стала необходима по причине регулярных спортивных занятий с интенсивными физическими нагрузками.
По достижении целевых показателей гликемии нами была проведена оценка вариабельности режимов подачи инсулина в зависимости от возраста, в связи с чем все пациенты были разделены на три группы: первую составили дети дошкольного и младшего школьного возраста (n = 6), вторую – пациенты школьного возраста (n = 10), третью – подростки 13-18 лет (n = 20). Демографические характеристики пациентов представлены в таблице.

В первой группе показатели гликемии (пре- и постпрандиальные) в течение суток (по данным дневников самоконтроля) составили: min – 3,8 ± 0,25 ммоль/л, max – 9,0 ± 1,0 ммоль/л. Во второй и третьей возрастных группах этот же показатель варьировал от 3,8 ± 0,89 до 12,2 ± 3,5 ммоль/л.
У детей младшего возраста соотношение болюсной и базальной доз инсулина в течение суток составило 3:1, что свидетельствует о низкой потребности в фоновой подаче инсулина. Подтверждением этого является наличие в профилях двух пациентов временных интервалов продолжительностью 1-2 часа с нулевой подачей инсулина. В данной возрастной группе среднесуточная базальная скорость введения 0,14 ± 0,04 Ед/час (2,85 ± 0,35 Ед/сут). Воссоздать подобный фоновый уровень инсулинемии путем многократных инъекций инсулина у этих детей было достаточно сложно и требовало проведения более частого самоконтроля гликемии и дополнительных приемов пищи перед сном во избежание гипогликемических состояний в ночные и ранние утренние часы. Периоды препубертата и начала пубертата, характеризующиеся выбросом в кровь большого количества контринсулярных гормонов, у большинства пациентов с сахарным диабетом, использующих традиционную инсулинотерапию, сопряжены с выраженными колебаниями гликемии в течение суток [1, 3]. Как показал проведенный анализ, применение помповой инсулинотерапии с преобладанием базальной подачи над болюсной на 5-8% позволило пациентам 2-й возрастной группы значительно уменьшить амплитуду колебаний гликемии вне приемов пищи, а также избежать «феномена утренней зари». У 83% подростков болюсный режим подачи преобладает над базальным в 1,5 раза, что обусловлено, с одной стороны, возросшей физиологической потребностью в пищевом инсулине, с другой стороны – изменением пищевого режима с ежедневными дополнительными приемами пищи.
Программирование базального профиля у каждого пациента было проведено по стандартной схеме путем комбинации нескольких часовых интервалов согласно суточным изменениям чувствительности к инсулину [4]. У детей младшего возраста число таких интервалов не превышало трех, и скорость введения базального инсулина в течение суток изменялась незначительно: от 0,1 до 0,2 Ед/ч. У детей школьного возраста и подростков потребность в фоновой подаче инсулина оказалась более вариабельной. В средней возрастной группе количество интервалов базальной подачи увеличилось от 3 до 8 раз, при этом разница между минимальными и максимальными показателями базальной дозы в среднем составила 0,35 ± 0,23 Ед/час (от 0,1 до 0,8 Ед/час). В третьей возрастной группе сохранялся восьмискоростной профиль введения инсулина, имеющий двухволновый характер распределения (со снижением чувствительности к инсулину в утренние (2.00-8.00) и вечерние (17.00-21.00) часы; различия между минимальными и максимальными показателями базальной подачи в среднем составили 0,5 ± 0,29 Ед/ч.
Анализ графиков распределения фоновой подачи в течение суток показал, что в дневное время (7.00-22.00) пациентам во всех возрастных группах требовалось на 20% больше инсулина, чем в ночные часы (22.00-7.00), что отражено на рис. 1.

Возможность регулировать базальную инсулинемию в течение суток позволила пациентам значительно расширить режим физической активности. Из общего числа пациентов 17 человек (47,2%) возобновили занятия в различных спортивных (настольный теннис, плавание, стендовая стрельба, биатлон, волейбол) и танцевальных секциях. 90% учащихся, использующих инсулиновую помпу, получили возможность заниматься в основных группах на уроках физической культуры. С целью профилактики гипогликемии на время спортивных занятий 20 человек (55%) применяли функцию временного отключения, остальные пациенты на этот период задавали временную базальную скорость со снижением подачи инсулина на 30-80% от исходной.
Расчет болюсных доз у каждого пациента проводился индивидуально с учетом количества потребляемых углеводов (ХЕ), потребности в инсулине на 1 ХЕ, коэффициента чувствительности к инсулину (SF). В старшей возрастной группе «доза пищевого инсулина» в среднем составила: на завтрак – 1,6 ± 0,4 Ед/1 ХЕ, на обед – 1,5 ± 0,5 Ед/1 ХЕ, на ужин – 1,3 ± 0,5 Ед/1 ХЕ. В средней возрастной группе на основные приемы пищи требовалось меньше инсулина: в утренние часы – 0,9 ± 0,5 Ед/1 ХЕ, в дневное время – 0,76 ± 0,4 Ед/1 ХЕ, вечером – 0,7 ± 0,29 Ед/1 ХЕ. У детей младшего возраста также было выявлено некоторое повышение потребности в «пищевом инсулине» в первой половине дня (0,8-1,2 Ед/1 ХЕ) по сравнению с вечерним временем суток (0,3-0,8 Ед/1 ХЕ). Подобное распределение болюсной подачи в течение дня сопоставимо с физиологическим (прандиальным) ритмом секреции инсулина.
Анализ данных дневников самоконтроля свидетельствует о соблюдении (на фоне НПИИ) большинством пациентов принципов рационального питания. Однако трое подростков после смены способа доставки инсулина осознанно отказалась от каких-либо ограничений в питании вообще, мотивируя это изменением образа жизни и возможностью быстро нормализовать уровень гликемии за счет безболезненного введения дополнительного болюсного инсулина.
Для обеспечения болюсной подачи инсулина 85% пациентов постоянно пользовались только стандартным/нормальным болюсом. Другие модификации болюсной подачи применялись реже: «квадратным» болюсом пользовались только 5 человек (из них только один ежедневно, остальные с частотой 1-2 раза/мес); «многоволновым» вариантом – 3 человека (ежедневно использовала одна пятилетняя пациентка, с частотой 3-4 раза в неделю – двое подростков).
Таким образом, проведенный анализ показал, что дополнительными возможностями помпы, помимо стандартных, пользовались не более 30% пациентов. При этом самостоятельное управление помпой, включая замену инфузионной системы, осуществляли только представители старшей возрастной группы (83%), остальным пациентам регулярно оказывали помощь родители (в основном матери).
Использование минимального набора функций инсулинового дозатора обусловлено чаще всего незнанием пользователей всех функциональных возможностей устройства, а также опасением (в основном родителей) возникновения состояния декомпенсации. Проявления кетоацидотических состояний с частотой до 2-3 раз за период применения помповой инсулинотерапии отмечались у 7 пациентов (19,4%); обращает на себя внимание, что в проведении интенсивной терапии в условиях стационара по тяжести состояния нуждались только трое из них. В половине случаев причинами декомпенсации послужили дефекты установки инфузионной системы/канюли: загиб иглы, несвоевременная замена системы с превышением допустимого времени эксплуатации, окклюзия катетера. Остальные эпизоды кетоацидоза были обусловлены присоединением интеркуррентных (чаще респираторных) заболеваний.
Для корректировки актуальной гипергликемии (перед едой или в течение дня вне связи с приемом пищи) каждому пациенту в соответствии с Правилом 1800 был рассчитан коэффициент чувствительности к инсулину (SF). У пациентов старшей и средней возрастных групп данный показатель в течение суток оставался практически неизменным и в среднем составил 3,28 ± 1,81 и 6,75 ± 3,38 ммоль/л соответственно. При этом у пациентов, регулярно занимающихся спортом, значение коэффициента чувствительности к инсулину в 2,5 раза превосходило аналогичный показатель у их нетренированных сверстников (p = 0,023).
У детей младшей возрастной группы ввиду большей чувствительности тканей к инсулину SF в течение суток варьировал от 7,5 ± 3,7 ммоль/л в первой половине дня до 8,6 ± 2,5 ммоль/л в вечерние и ночные часы. Используя для коррекции гликемии малый шаг введения дозы инсулина (0,1 Ед), эта категория пациентов перестала быть угрожаемой по развитию тяжелых гипогликемий.
Тяжелая гипогликемия была зафиксировано однократно у одной пациентки 6 лет в начале применения НПИИ. Частота легких гипогликемических реакций (нейрогликопенических проявлений) по причине незапланированных физических нагрузок низкой степени интенсивности в целом по группе снизилась на 30% и составила 1,7 эпизодов/1 пациента/нед.
НПИИ позволяет пациентам быстро реагировать на изменение уровня гликемии и удерживать его в пределах целевых значений, о чем свидетельствуют динамические изменения показателя HbA1c (рис. 2).

За первые 3 месяца применения инсулиновой помпы показатель гликированного гемоглобина снизился на 17% от исходного уровня (с 9,2% до 7,6%, p = 0,03). В течение последующих 15 месяцев при проведении контрольных исследований у 76,5% пациентов данный показатель соответствовал уровню компенсации углеводного обмена (в среднем 7,4 ± 1,1%). Повышение показателя HbA1с в следующей контрольной точке исследования (18 месяцев) до 8,3% вероятнее всего обусловлено снижением степени контроля над своим заболеванием.
Выводы
- Применение помповой инсулинотерапии в исследуемой группе привело к улучшению клинико-метаболических показателей. Уровень гликированного гемоглобина снизился 9,2% до 7,6%.
- При моделировании индивидуальных схем НПИИ необходимо учитывать возраст пациента. У детей школьного возраста преобладает базовая доза инсулина, у дошкольников и подростков – болюсная.
- Использование инсулинового дозатора детьми с высокой чувствительностью к инсулину позволяет снизить риск развития гипогликемии на 30%.
- Данный режим инсулинотерапии предоставляет большую свободу выбора физической активности; упрощает контроль над течением диабета детям и подросткам, активно занимающимся спортом.
- Стандартного трехдневного обучения недостаточно для освоения всего набора функций помпы, что требует дополнительного обучения пользователей и разработки специализированной программы для детей и подростков, находящихся на помповой инсулинотерапии.
Литература
- Дедов И. И. Сахарный диабет у детей и подростков. М.: Универсум Паблишинг, 2002. 392 с.
- Инсулиновая помпа в лечении сахарного диабета у детей и подростков: Методическое пособие для врачей / Под ред. И. И. Дедова. М., 2008. 39 с.
- Danne Т., Aman J., Schober E. et al. A comparison of postprandial and preprandial administration of insulin aspart in children and adolescents with type 1 diabetes // Diabetes Care. 2003. Vol. 26. Suppl. 8. P. 2359-2364.
- Philip M., Battelino T., Rodriguez H. et. al. Use of insulin pump therapy in the pediatric-age group: consensus ement from the European Society for the Paedietric Endocrinology, the Lawson Wilkins Paedietric Endocrine Society, and the International Society for Paedietric and Adolescent Diabetes, endorsed by American Diabetes Association and European Association for the Study of Diabetes (Consensus ement) // Diabetes Care. 2007. № 30 (6). P. 1653-1662.
Н. В. Болотова, доктор медицинских наук, профессор
О. В. Компаниец
Н. Ю. Филина, кандидат медицинских наук
В. К. Поляков, кандидат медицинских наук, доцент
Н. В. Николаева, кандидат медицинских наук
Саратовский ГМУ им. В. И. Разумовского, Саратов
Контактная информация об авторах для переписки: ovkompaniets@rambler.ru
