Экспериментальная модель сахарного диабета 2 типа
М.Н. Макарова, доктор медицинских наук, директор НПО «Дом Фармации», В.Г. Макаров, доктор медицинских наук, профессор, зам. директора НПО «Дом Фармации» НПО «Дом Фармации», 188663, Российская Федерация, Ленинградская обл., Всеволожский район, г.п. Кузьмоловский, ул. Заводская, д. 3, к. 245 E-mail: [email protected]
Рост заболеваемости сахарным диабетом (СД), преимущественно 2-го типа (СД2), опасного хроническими осложнениями, обусловленными гипергликемией (диабетическая нефропатия, диабетическая ретинопатия, диабетическая стопа, диабетическая нейропатия, атеросклероз и др.), диктует необходимость проведения широких доклинических исследований для поиска эффективных мер профилактики и лечения. Для этого требуются экспериментальные модели на животных, наиболее чувствительных к развитию СД, адекватные методы индуцирования СД и выбор критериев оценки. Как показал анализ современной литературы, для моделирования СД2 лучше всего подходят грызуны (преимущественно мыши, в том числе диких пород), а также мини-свиньи. Наиболее близкими по этиологии и механизмам развития к СД2 у человека являются диет-индуцированные модели, среди которых наиболее эффективны высокоуглеводные рационы, дополнительно обогащенные сахарозой или фруктозой. Для ускорения развития диет-индуцированного СД2 рекомендуется использовать небольшие, индивидуально подобранные дозы стрептозотоцина, позволяющие не разрушать полностью β-клетки поджелудочной железы, как это имеет место при СД типа 1. Основными критериями развития СД и эффективности исследуемых лечебно-профилактических мероприятий являются содержание глюкозы, инсулина и гликозилированного гемоглобина плазмы крови, количество β-клеток в островках поджелудочной железы, площадь распределения сахарной кривой, индекс инсулинорезистентности, а также результаты гистологии и гистохимии поджелудочной железы и других органов.
Введение
Несмотря на значительный прогресс в лечении сахарного диабета (СД), в последние 2 десятилетия отмечается
непрекращающийся рост заболеваемости СД как во всем мире, так и в Российской Федерации, причем рост
происходит в основном за счет больных, страдающих СД типа 2 (СД2). Так, например, если общее число
больных СД в РФ на конец 2016 г. составляло 4,348 млн человек (2,97% населения РФ), то больных СД2 среди них
было чуть больше 4 млн (92%), СД типа 1 (СД1) – 255 тыс. (6%), и на другие типы СД приходилось всего
75 тыс. (около 2%) [1]. Основные причины ухудшения качества жизни, инвалидизации и смертности больных СД:
хронические осложнения, обусловленные гипергликемией (диабетическая нефропатия, диабетическая ретинопатия,
диабетическая стопа, диабетическая нейропатия, атеросклероз и др.) [2].
В целях совершенствования профилактики и лечения осложнений СД постоянно изучаются различные аспекты
патофизиологии СД, механизмы антидиабетического действия новых лекарственных средств. Для этого необходимы широкие
доклинические исследования с использованием экспериментальных моделей на животных: подбор наиболее
чувствительных к развитию СД видов животных, эффективных методов индуцирования СД, адекватных показателей
характеристики СД. В настоящее время создано много моделей экспериментального СД, однако для моделирования СД2
подходят далеко не все из них.
Характеристика сахарного диабета
СД – хроническое неинфекционное заболевание, темпы распространения которого за последние 2 десятилетия
приобрели масштаб эпидемии [1]. СД характеризуется абсолютным или относительным дефицитом гормона инсулина
и последующим нарушением обмена веществ, прежде всего – углеводного. Под абсолютным дефицитом
инсулина понимают недостаточное образование этого гормона в поджелудочной железе (преимущественно СД1), под
относительным дефицитом – нарушение действия инсулина на клетки организма при количественно достаточном
его образовании в поджелудочной железе (инсулинорезистентность, характерная для СД2) [2]. В патогенезе
инсулинорезистентности важное значение придается ожирению, которым страдают большинство больных СД2.
Для СД характерны острые и хронические осложнения. Острые осложнения – гипогликемические
и гипергликемические состояния (кетоацидоз) – хорошо поддаются коррекции современными
противодиабетическими средствами, хотя при этом необходим постоянный контроль за содержанием глюкозы крови.
В настоящее время наиболее серьезной проблемой являются хронические (поздние) осложнения СД, которые служат
основными причинами ухудшения качества жизни, инвалидизации и смертности больных. В основе поздних
осложнений лежит хроническая гипергликемия, сопровождающаяся поражением мелких кровеносных сосудов –
микроангиопатии (нефропатия, ретинопатия, диабетическая стопа и др.) и крупных кровеносных
сосудов – макроангиопатии, а также поражением периферической нервной системы –
нейропатии.
В основе диабетических поражений крупных сосудов (макроангиопатий) лежит атеросклероз, риск развития которого
при СД2 возрастает в несколько раз. В свою очередь, диабетические поражения мелких сосудов, а также
характерные для СД2нарушения липидного обмена, тоже играют важную роль в механизмах развития макроангиопатий.
У больных СД значительно чаще и тяжелее протекает артериальная гипертензия, в том числе вторичная
артериальная гипертензия, обусловленная поражением почек (диабетической нефропатией).
Рационы питания, используемые для индукции СД
Большинство существующих в настоящее время экспериментальных моделей СД (хирургическая, химическая, эндокринная,
иммунная, генетическая) не подходят для изучения СД2. Так как в этиологии СД2 (так же, как и ожирения)
у человека основное значение имеет избыточное по калорийности питание, наиболее адекватными представляются
диет-индуцированные модели на различных видах животных. Рацион питания оказывает существенное влияние на развитие
СД2. Так, например, у мышей C57BL/6 для развития ожирения и СД2 требуется высокожировой рацион (ВЖР) (60%
жира) питания
(табл. 1), причем более быстрый и выраженный эффект достигается при добавлении в него
большого количества сахарозы или фруктозы [3]. У крыс линии Wistar для индукции инсулинорезистентности
использовали высокофруктозный рацион (35–60% ккал за счет фруктозы) [4, 5]. Для индукции СД2
у мини-свиней также рекомендуется ВЖР с добавлением большего количества сахарозы (см. табл. 1) [6].
В свою очередь, у предрасположенных к ожирению мышей ли-
нии NZO ожирение и СД развиваются
как при 40%, так и при 15% жира в рационе питания, в то время как рацион с высоким содержанием
клетчатки значительно тормозит у них развитие ожирения и СД [7]. Однако у таких генетически
модифицированных линий мышей, как ApoE-/-, LDLr-/-, LDLr-/-ApoB100/100, СД вообще не развивается даже на
высококалорийных рационах [3].
Виды животных, используемые для индукции сахарного диабета
Для моделирования СД2 в основном применяются грызуны (мыши и крысы, реже – морские свинки,
песчанки и дегу) и нечеловекообразные обезьяны [11, 12]. В настоящее время все шире начинают
использоваться мини-свиньи [13].
Модели сахарного диабета на грызунах
В экспериментальных моделях СД2 используются как генетически модифицированные (инбредные) животные [(мыши db/db,
мыши NZO (New Zealand Obese), мыши TH (TALLYHO/Jng), крысы Zucker Diabetic Fatty (ZDF) и др.)], так
и аутбредные (мыши линий C57BL/6 и BALB/c, крысы линии Wistar и др.) [4, 11, 14–16].
По мнению R. Kluge et al. [7], инбредные мыши имеют сходный с человеком патогенез развития, связанный
с ожирением. Поэтому они идеально подходят для исследования проявлений СД2 у человека. Однако генетическая
однородность инбредных линий является не только преимуществом, но и ограничивает потенциал их применения. Так
как особи конкретной инбредной линии мышей генетически идентичны, то маловероятно, что у одной линии
представлены все патогенетические механизмы такого комплексного заболевания, как СД2. Поэтому для всесторонней
оценки механизмов как самого СД2, так и изучаемых препаратов, требуются исследования на нескольких линиях
инбредных мышей для получения полной картины [7].
Разные линии инбредных мышей, используемых для моделирования СД2, существенно различаются между собой. Так, если
самой яркой характеристикой мышей NZO является выраженное ожирение (масса тела у них к 3 мес достигает 45
г, а в дальнейшем может достигать 100 г и более), то мыши линии TH к 3 мес весят 35 г, в то
время как контрольные линии диких мышей C57BL/6 – 27 г [7, 16]. Практически все исследователи отмечают,
что молодые мыши возрастом до 4 нед, независимо от пола, толерантны к введению глюкозы, однако после полового
созревания (раньше – у самцов и чуть позже – у самок) у них развивается
нарушение толерантности к нагрузке глюкозой [16]. Нарушение толерантности к глюкозе у животных
сопровождается гиперсекрецией инсулина (гиперинсулинемией) с последующим развитием инсулинорезистентности:
средний уровень инсулина в плазме крови (не натощак) достигает 6±1 нг/мл – у самок
и 8±1 нг/мл – у самцов мышей линии TH, в то время как у мышей линии C57BL/6 он
составляет всего 0,4±0,1 нг/мл – у самок и 0,6±0,2 нг/мл –
у 6-недельных самцов [16].
Модели сахарного диабета на кроликах
У кроликов сложно вызвать СД, так как в их рацион питания, наряду с высоким содержанием жира
и сахарозы, должно входить довольно много клетчатки (см. табл. 1), которая предупреждает развитие
инсулинорезистентности и гипергликемии. Это подтверждается многими исследователями, показавшими незначительные
изменения содержания глюкозы и инсулина в сыворотке крови, даже при длительном применении (28 нед)
рационов с высоким содержанием жира и углеводов (табл. 2) [9, 17]. Однако через 36 нед индекс
инсулинорезистентности начинает существенно превышать таковой у контрольных животных (см. табл. 2) [9].

Модели сахарного диабета на крупных животных
В настоящее время, по мнению большинства ученых, наиболее подходящие модели для изучения СД2 –
мини-свиньи, которые гораздо ближе к человеку, чем грызуны [13]. У мини-свиней с диет-индуцированным
ожирением большинство симптомов, ассоциированных с метаболическим синдромом, в том числе
и инсулинорезистентность и нарушение толерантности к глюкозе, развиваются в течение 5–6
мес после начала кормления рационом с высоким содержанием сахара и жира. Однако для развития явной
гипергликемии, характерной для СД2, требуется несколько лет. Поэтому для ускорения индукции СД2, мини-свиньям
с уже развившимся ожирением подбирают небольшие индивидуальные дозы стрептозотоцина, который выборочно
повреждает часть инсулинсинтезирующих β-клеток поджелудочной железы, способствуя более раннему развитию
гипергликемии. При этом доза стрептозотоцина должна быть такой, чтобы вырабатывалось достаточно инсулина для
поддержания избыточной массы тела. При правильном подборе дозы стрептозотоцина секреция инсулина может быть
ограничена на таком уровне, чтобы на фоне развития гипергликемии оставалось ингибирование липолиза без
дополнительного введения инсулина [13].
Показатели для оценки развития сахарного диабета у разных видов животных
О развитии СД2 в условиях эксперимента судят в первую очередь по содержанию в плазме крови
глюкозы натощак, инсулина и гликозилированного гемоглобина, по результатам теста на толерантность
к глюкозе после ее введения через рот или внутриперитонеально, а также гистологии и гистохимии
поджелудочной железы [6, 8, 10, 17, 18]. Кроме того, оценивают количество β-клеток в островках
поджелудочной железы, определяют площадь распределения сахарной кривой и рассчитывают различные индексы (индекс
инсулинорезистентности, индекс массы тела и др.). Косвенные показатели: масса тела и другие
антропометрические данные, содержание триглицеридов, холестерина и его фракций, маркеры воспаления
(интерлейкин-6, фактор некроза опухоли и т.п.) и др. [8, 10, 11, 17, 19]. Некоторые из указанных
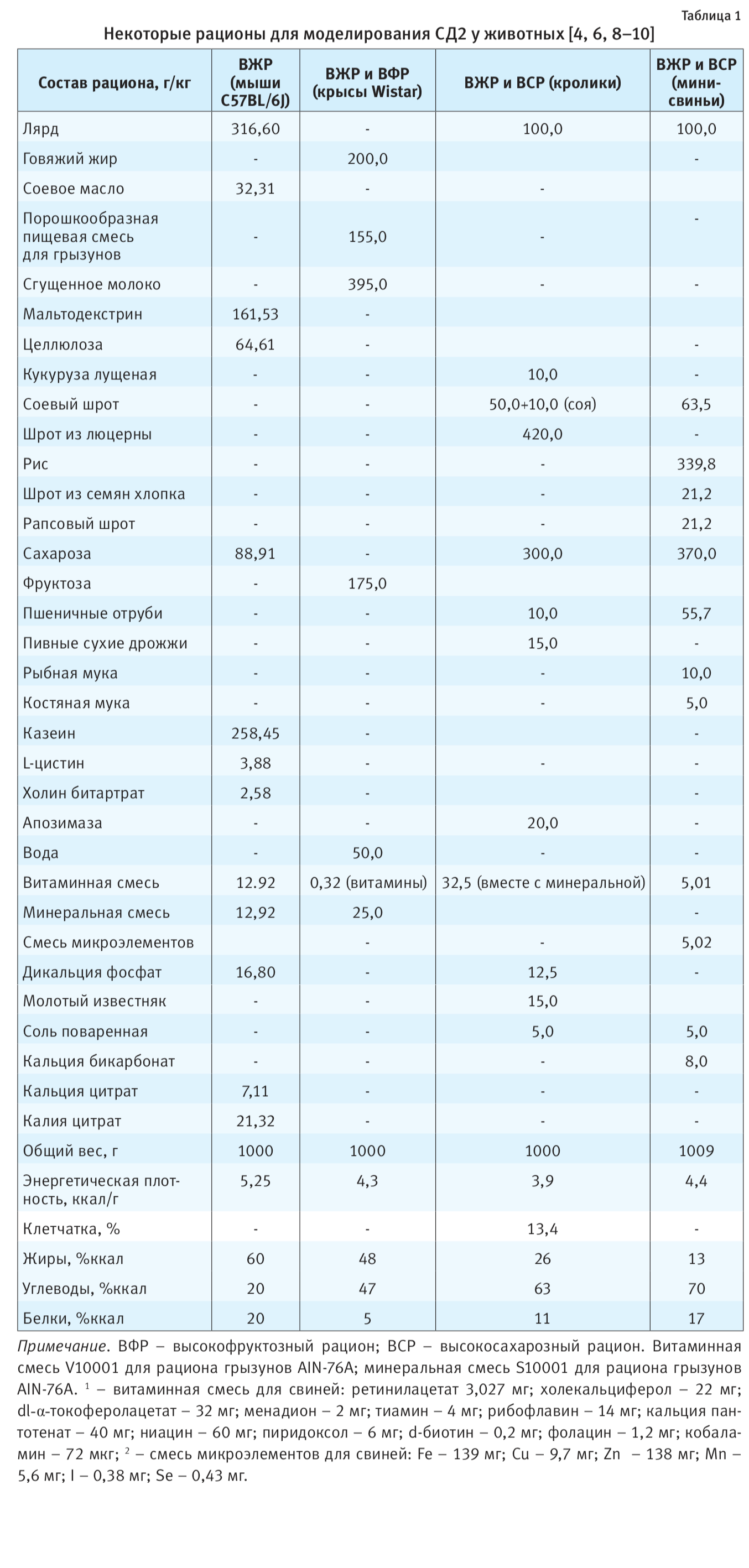
показателей, характерные для различных животных, используются в диет-индуцированных моделях СД2 (см. табл. 2).
Исходя из данных табл. 2, можно проследить быстрое развитие гипергликемии, инсулинорезистентности и рост
гликозилированного гемоглобина у мышей на фоне только ВЖР. Однако у кроликов проявления СД2 выражены слабо
и развиваются очень медленно (см. табл. 2). Вместе с тем у мини-свиней признаки возникновения СД2
развиваются гораздо лучше и быстрее, чем у кроликов: рост уровня глюкозы – до 10,27±2,25
ммоль/л в сравнении с 4,77±0,57 ммоль/л у контрольных животных, инсулина –
17,43±3,80 пмоль/л в сравнении с 7,65±1,33 пмоль/л, а инсулинорезистентность возрастает
почти в 5 раз (см. табл. 2).
Заключение
Таким образом, для моделирования СД2 лучше всего подходят грызуны (преимущественно – мыши, в том
числе и аутбредных линий), а также мини-свиньи, которых стали шире применять в последнее время. Как
для моделей метаболического синдрома и ожирения, наиболее близкими по этиологии и механизмам развития
к СД2 у человека также являются диет-индуцированные модели, среди которых наиболее эффективны
высокожировые рационы, обогащенные сахарозой или фруктозой. Для моделирования СД следует использовать половозрелых
животных, так как молодые животные, в частности мыши возрастом до 4 нед устойчивы к введению больших доз
глюкозы и только после полового созревания у них развивается нарушение толерантности к нагрузке
глюкозой. Для ускорения индукции СД2, в том числе у мини-свиней, рекомендуется использовать небольшие,
подбираемые индивидуально, дозы стрептозотоцина, чтобы полностью не разрушать β-клетки поджелудочной железы
аналогично ситуации при СД2.
Эффективность исследуемых лечебно-профилактических мероприятий у животных с СД2 оценивают на основании
определения показателей глюкозы, инсулина и гликозилированного гемоглобина плазмы крови, гистологии
и гистохимии поджелудочной железы и др. органов. Рассчитывают также количество β-клеток
в островках поджелудочной железы, площадь распределения сахарной кривой, индекс инсулинорезистентности
и др. Косвенно об эффективности исследуемых лечебно-профилактических мер судят на основании показателей
липидного обмена (триглицеридов, холестерина и его фракций), маркеров воспаления (интерлейкин-6, фактор некроза
опухоли и т.п.) и др.
Экспериментальное моделирование сахарного диабета
Выполнил:
студент 3 курса 6 группы
лечебного факультета
Кирюхин А.В.
Проверила:
Маслова М.В.
Рязань 2015
Содержание
1. Введение …………………………………………………………………. 1
2. Общая характеристика методов экспериментального моделирования сахарного диабета ………………………………………………………… 1
3. Методы экспериментального моделирования СД I типа ……………. 2
3.1. Хирургическая модель ……………………………………………. 2
3.2. Химическая модель ……………………………………………….. 3
а) аллоксановый диабет …………………………………………. 3
б) стрептозотоциновый диабет ………………………………… 4
в) дитизоновый диабет ………………………………………….. 6
3.3. Эндокринная модель ………………………………………………. 7
а) стероидный диабет ……………………………………………… 8
б) гипофизарный диабет ………………………………………….. 8
3.4. Иммунная модель …………………………………………………. 8
4. Методы экспериментального моделирования СД II типа …………… 9
5. Заключение ……………………………………………………………… 10
6. Список используемой литературы …………………………………… 12
Введение
Учитывая неуклонно возрастающее во всем мире число больных сахарным диабетом, актуальной проблемой современной медицины является его лечение, в частностиразработка антидиабетических препаратов, обладающих высокой терапевтической активностью и имеющих более совершенный профиль безопасности. В связи с этим важное значение имеет моделирование сахарного диабета, позволяющее достоверно выявлять наличие той или иной фармакологической активности или новых деталей в механизме действия лекарственных средств.
Общая характеристика методов экспериментального моделирования сахарного диабета
Перейдем к рассмотрению непосредственно вопроса о моделировании сахарного диабета. Модели сахарного диабета могут быть получены на различных видах животных спонтанно, индуцированы химическими диабетогенными веществами, диетическими или хирургическими манипуляциями, или сочетанием этих способов.К настоящему времени разработано несколько моделей экспериментального сахарного диабета основными из которых являются следующие:
1. Хирургическая модель. Используется полное (тотальное) или частичное (субтотальное) удаление поджелудочной железы.
2. Химическая модель. Используется введение химических веществ, избирательно воздействующих на B-клетки островков: аллоксан, стрептозотоцин, дитизон и др.
3. Эндокринная модель. Используется длительное введение гормонов аденогипофиза, соматотропного гормона, АКТГ, вызывающих метагипофизарный диабет, и введение глюкокортикоидов, вызывающих метастероидный диабет.
4. Иммунная модель. Используется введение животным антител против инсулина.
5. Генетическая модель. Используется выведение чистых линий мышей и других животных с наследственно обусловленной формой сахарного диабета.
Разумеется, моделирование сахарного диабета проводится на подопытных животных, правильный выбор которых для каждой модели очень важен. Так, панкреатэктомию лучше проводить на собаках. Это связано с особенностями строения поджелудочной железы, которая у собак узкая, длинная, имеет объемистую левую долю, телои правую долю. Хирургически удалить железу у собак проще, чем у других подопытных животных. Использование биологически активных веществ и фармакологических препаратов для формирования экспериментальной модели сахарного диабета вынуждает нас при выборе подопытного животного учитывать их чувствительность к тем или иным веществам, а также интенсивность и форму ожидаемого клинического проявления вызываемого заболевания. Все выше перечисленные факторы важно учитывать при выборе метода экспериментального моделирования.
Перейдем к рассмотрению непосредственно каждого метода. Как нам известно, выделяют сахарный диабет I и II типов. Знание патогенеза каждого из них позволяет сделать вывод о том, что смоделировать в эксперименте Iтип рассматриваемого заболевания проще, чем IIтип. Поэтому начнем с экспериментального моделирования сахарного диабета Iтипа.
Хирургическая модель
Впервые экспериментально сахарный диабет путем удаления поджелудочной железы удалось получить и официально обосновать физиологам Оскару Минковскому и Жозефу ван Мерингу. В научных достижениях наряду с упорным трудом играет немаловажную роль такое качество как интуиция – удивительная способность искать одну вещь и в процессе находить другую. Блестящий научный эксперимент Минковского как нельзя лучше иллюстрирует это утверждение. Ученый так описывал эту ситуацию: он и его коллега в университете Страсбурга Жозеф ван Меринг обсуждали следующий вопрос – являются ли свободные жирные кислоты необходимыми для всасывания жиров, вопрос, которым в то время занимался ван Меринг. Поджелудочная железа, по его мнению, играла главную роль в этом процессе, и ван Меринг попытался решить вопрос путем перевязывания панкреатических протоков, тем не менее без всякого успеха. Минковский предложил провести тотальную панкреатэктомию для доказательства теории ван Меринга, операцию, выполнение которой последний считал невозможным. Тем не менее, Минковский, имея уже опыт удаления печени у птиц, попросил ван Меринга подготовить собаку для эксперимента, что было выполнено в тот же день, и ван Меринг ассистировал Минковскому в проведении операции. Панкреатэктомия, без какой-либо специальной подготовки, была выполнена успешно, и проопериванную собаку было решено использовать для изучения ван Мерингом жирового обмена, однако впоследствии коллега Минковского вынужден был несколько дней отсутствовать в лаборатории. Естественно, ни у кого из них не было и мысли о развитии диабета после панкреатэктомии. Во время отсутствия ван Меринга, произошло нечто, что коренным образом изменило ход медицинской науки. Как сам Минковский впоследствии сообщал о полученных результатах: после экстирпации поджелудочной железы у собаки появился сахарный диабет. Он развился через пару дней после операции и длился несколько недель, пока не наступила гибель животного. Отмечалась глюкозурия в сочетании с полиурией, выраженный голод, потеря веса и астения несмотря на достаточное обеспечение питательными веществами. Моча экспериментальных животных также содер жала некоторое количество ацетона. Уровень сахара крови был значительно повышен, у одной собаки он достиг уровня 0,3%, у другой – 0,46%. Запас гликогена в органах практически исчезал. Солнечное сплетение в процессе операции не было повреждено, следовательно, развитие диабета было связано непосредственно с удалением поджелудочной железы. Переливание крови собак с диабетом здоровой особи не приводило к глюкозурии у последней. Интересно, что Минковский совершил свое открытие более чем за десять лет до того, как благодаря работам ученого Старлинга был введен термин «гормон» и появилось такое понятие, как «физиология эндокринной системы». В ходе эксперимента Минковским, а затем и другими учеными был доказан очевидный факт – отсутствие поджелудочной железы является необходимой предпосылкой для развития сахарного диабета. Однако механизм этого явления долгое время оставался неясным.
Химическая модель
а) аллоксановый диабет
Наибольшее распространение в современной экспериментальной диабетологии получили химические модели сахарного диабета.
Аллоксан является продуктом распада мочевой кислоты и представляет собой белое кристаллическое вещество, розовеющее на воздухе. Средство обладает диабетогенным действием только при парентеральном способе введения – внутривенном, подкожном, внутримышечном и интраперитонеальном. Оно используется для изучения сахарного диабета типа 1. Эффективная доза зависит от вида животного, способа введения и состояния питания. Для мышей и крыс чаще употребляется внутрибрюшинное введение моногидрата аллоксана однократно в виде 0,9 % нормального солевого раствора в дозе 150 мг/кг или внутривенное введение в виде 5 % водного раствора в дозе 65 мг/кг. Экспериментальная доза должна быть тщательно подобрана, чтобы избежать чрезмерного повреждения панкреатической ткани. У исследованных животных после введения ал локсана в диабетогенных дозах выявляется развитие трехфазной или четырехфазной гликемической кривой. Согласно авторам, первая скоротечная гипогликемическая фаза длительноcтью максимально 30 мин. начинается с первых минут после введения аллоксана. Этот короткий гипогликемический ответ – результат быстрой стимуляции секреции инсулина, который подтверждается увеличением его концентрации в плазме крови. Механизм этой гиперинсулинемии временное увеличение АТФ, обусловленное торможением фосфорилирования глюкозы вследствие угнетения глюкокиназы. Вторая фаза гликемической кривой начинается с подъема концентрации глюкозы через один час после введения аллоксана. Это первая гипергликемическая фаза после контакта В-клеток с токсином. Гипергликемия обычно остается на протяжении 2-4 часов и обусловлена уменьшением концентрации инсулина плазмы в связи с угнетением его секреции панкреатическими В-клетками. Однако есть и другие мнения. Ряд авторов считает гипергликемию следствием стресc-реакции со стороны надпочечников, отвечающих повышенным выделением адреналина или же влиянием глюкагона и гормонов гипоталамуса. Спустя 4-8 часов (по некоторым авторам 6-12 часов) после введения аллоксана наступает третья фаза гликемической кривой, характеризующаяся глубокой гипогликемией, продолжающейся до суток. Иногда без инъекции глюкозы она может закончиться судорогами и смертью животных. Высокая летальность подопытных животных – основной недостаток экспериментального моделирования сахарного диабета путем введения аллоксана. Согласно подавляющему большинству работ, гипогликемия обусловлена освобождением в кровь инсулина из разрушающихся В-клеток. Как подтверждает морфометрический и ультраструктурный анализ, изменения охватывают не только секреторные гранулы с потерей их содержимого, но и плазмолемму, компоненты ядра и многие субклеточные органеллы (гладкую эндоплазматическую сеть, комплекс Гольджи, митохондрии), нередко они заканчиваются некрозом В-клеток. Если животные в предыдущей стадии не погибают, то возникает вторичная устойчивая гипергликемия, которая свидетельствует о развитии диабета. Она рассматривается как четвертая, финальная фаза гликемической кривой, характеризующей аллоксановый диабет. Морфологические и ультрамикроскопические данные свидетельствуют о полной дегрануляции и потере целостности В-клеток. Другие эндокринные клетки, как и клетки экзокринной паренхимы, остаются интактными, подтверждая избирательный характер поражения В-клеток этим токсином. Патогенез экспериментального аллоксанового диабета можно представить как последовательность взаимодействия значительного количества факторов, совокупное действие которых приводит к деструкции, уменьшению количества В-клеток и диабетогенному эффекту.
б) стрептозотоциновый диабет
Среди химических моделей экспериментального диабета стрептозотоциновая наряду с аллоксановой является наиболее распространенной. Стрептозотоцин (стрептозоцин, изостоцин, занозар) – синтетический препарат, полученный из микроорганизмов Streptomyces achromogenes, откуда и произошло его название. Стрептозотоцин является токсическим соединением из группы производных нитрозомочевины, избирательно проникающим в панкреатические бета-клетки посредством переносчика GLUT-2. Его панкреатотоксичность в значительной мере связывают с алкилирующей активностью его метильной группы, которая способна вызывать дефицит запасов кофактора NAD+, а затем и энергетических субстратов в виде АТФ, что неминуемо приводит, в конечном счёте, к некрозу бета-клеток. Данный процесс усугубляется
активацией свободнорадикального окисления, связанного с генерацией пероксинитрита из избыточно образующегося оксида азота, донатором которого является нитрозогруппа стрептозотоцина. Диабетогенный эффект наблюдается у многих видов животных, включая мышей, собак, кошек, обезьян, морских свинок и др. Наиболее резистентными оказались кролики и свиньи, а максимальная сенсибилизация выявлена у крыс, при этом оптимальная диабетогенная доза для крысы уменьшается по мере увеличение массы животного. Замечено, что при использовании высоких цитотоксических доз стрептозотоцина первоначальные функциональные изменения постепенно переходят в серьезные нарушения. Они носят более общий и неспецифический характер и, прогрессируя, приводят к гибели клеток. В случае применения более низких доз стрептозотоцина многие В-клетки способны выдержать первоначальное воздействие, но длительное время обнаруживают снижение функции в результате недостаточного окислительного метаболизма митохондрий. Также отмечено, что особи мужского пола при сопоставимой дозе развивают более выраженную гипергликемию. Для получения экспериментального диабета существует несколько способов введения препарата в организм: внутривенный, внутрибрюшинный и метод прямой инфузии в сосуды поджелудочной железы. В связи с неустойчивостью стрептозотоцина и коротким периодом его полураспада самым надежным считается внутривенное введение.
Каковы же изменения концентрации глюкозы крови в ответ на введение препарата? Они носят трехфазный характер. В отличие от воздействия аллоксаном не развивается начальная скоротечная гипогликемическая фаза, обусловленная торможением фосфорилирования глюкозы в результате угнетения глюкокиназы. Установлено, что стрептозотоцин не угнетает глюкокиназу. Первая гипергликемическая фаза начинается через 1 час после введения стрептозотоцина, достигая пика подъема глюкозы через 2 часа и продолжается до 4-х часов. О причинах развития ранней гипергликемии имеются разные мнения. Большинство авторов считают её результатом угнетения секреции инсулина, вызванной токсическим воздействием стрептозотоцина на В-клетки поджелудочной железы, что приводит к нарушению синтеза проинсулина и инсулина. Некоторые авторы связывают её с повышением скорости печеночного гликогенолиза или рассматривают как вторичную по отношению к повышению содержания свободных жирных кислот. Следующая, гипогликемическая, фаза наступает спустя 4-8 часов после введения стрептозотоцина и продолжается в течение нескольких часов (до суток). По единодушному мнению авторов, она считается следствием освобождения инсулина из поврежденных В-клеток. Третья фаза гликемической кривой является финальной и характеризуется устойчивой гипергликемией и развитием перманентного стрептозотоцинового диабета, наблюдающегося через 24 часа после введения препарата. Морфологический и ультрамикроскопический анализ свидетельствует о полной дегрануляции и потере целостности В-клеток.
в) дитизоновый диабет
Является наиболее известным среди моделей, так называемого, «цинкового» диабета. Чтобы понять механизм его моделирования, нужно знать биологическую роль цинка относительно рассматриваемой нами темы. Итак, цинк является составной частью каталитически активного центра целого ряда ферментов – дегидрогеназы, карбоксипептидазы, трансфорилазы. Определенное количество ионов цинка содержится в панкреатических островках человека, кроликов, собак, мышей, крыс, котов и других животных, исключая морских свинок. С помощью гистохимических методов было показано, что цинк находится в тесной функциональной связи с инсулином непосредственно в секреторных гранулах, образуя специфические нерастворимые комплексы депонированного гормона. Под влиянием стимуляторов секреции инсулина происходит изменение характера связи и нерастворимый комплекс цинк-инсулин становится растворимым. При введении глюкозы количество цинка в В-клетках уменьшается, почти полностью исчезая при длительной нагрузке глюкозой. Установлено, что любые вещества, вступающие в соединения с цинком и нарушающие его связь с инсулином, могут обладать диабетогенным действием. Таким образом, дитизон блокирует в островках поджелудочной железы цинк, в результате чего происходит разрушение В-клеток.
Теперь перейдем непосредственно к механизму моделирования дитизонового диабета. Дитизон, химически представляющий собой дифенилтиокарбазон, рекомендуется вводить в водном растворе аммиака. Наилучшим объектом для изучения дитизонового диабета являются кролики, хотя удалось вызвать его и у мышей. Предварительное голодание животных в течение 1-2 суток значительно повышает их чувствительность к дитизону, как и к остальным диабетогенным веществам. Через 2-5 мин. после введения дитизон соединяется с цинком в панкреатических В-клетках, образуя дитизонат цинка. В первые сутки после введения диабетогенной дозы дитизона происходит трехфазное колебание концентрации сахара в крови, аналогичное описанному при аллоксановом диабете. Оно сопровождается структурными изменениями В-клеток. Первые изменения в виде небольших очагов опустошения цитоплазмы В-клеток начинают развиваться уже через 15 минут после образования комплекса цинк – дитизон. Через 30 мин. после введения дитизона наблюдается первая фаза – гипергликемия, достигающая максимума через 1-3 часа, обусловленная мобилизацией гликогена из печени. Вторая, гипогликемическая, фаза обусловлена выходом в кровь инсулина из разрушающихся В-клеток. Максимум гипогликемии наступает через 8-18 часов после введения дитизона. В случае тяжелой гипогликемии животные иногда погибают при явлениях жестоких судорог. Глубина гипогликемии позволяет судить о тяжести развивающегося в дальнейшем дитизонового диабета. Через 24-28 часов появляется вторичная гипогликемия и развивается диабет, характеризующийся стойкой гипергликемией, гликозурией, полиурией, полидипсией и полифагией.
Различают 3 типа течения дитизонового диабета. Первый тип характеризуется острым развитием заболевания. Кролики погибали через 5-7 дней после введения дитизона при явлениях, напоминавших диабетическую кому. Второй тип характеризуется хроническим течением заболевания, что наблюдалось у большинства животных. Они могли жить без введения инсулина свыше 400 дней. Третий тип заболевания характеризовался спонтанным выздоровлением от дитизонового диабета. Уровень глюкозы в крови приходил к норме, исчезал сахар из мочи, нарастал вес животных. При гистологическом исследовании поджелудочной железы можно было подтвердить восстановление инкреторной функции островковой ткани. У выздоровевших животных обнаруживали пылевидную зернистость, заполнявшую апикальную или назальную часть клеток или располагавшуюся в виде пристеночной каемочки. Зернистость была выражена значительно слабее, чем у интактных животных, но, по-видимому, образовывалась в количестве, достаточном для удовлетворения потребности организма в инсулине. Новообразование В-клеток обнаруживалось в эпителии протоков и в экзокринной ткани. Обнаруживали митотические деления В-клеток, свидетельствующие о репаративных процессах в островковой ткани.
Итак, мы рассмотрели хирургическую модель и основные химические модели экспериментального сахарного диабета и можем сделать вывод, что среди представленных моделей предпочтение отдается стрептозотоциновому диабету. Преимущество его заключается в относительной простоте воспроизведения, чего нельзя сказать о панкреатэктомии, высокой избирательности воздействия, возможности получения диабета различной степени тяжести и длительности, что позволяет смоделировать как постепенно развивающуюся дисфункцию В-клеток, так и нарушение толерантности к глюкозе и развитие связанных с ней расстройств. «Цинковые» формы диабета являются удобной моделью вследствие простоты их получения, незначительных побочных явлений на другие органы и ткани. Однако недостатком данной модели является ограниченный выбор животных. Что же касается аллоксанового диабета, то главным недостатком этой модели, как упоминалось нами выше, является высокая летальность подопытных животных.
Эндокринная модель
Эндокринные модели сахарного диабета основаны на действии контринсулярных гормонов. Моделирование этим путем осложняется тем, что, кроме гипофиза и надпочечников, многие железы внутренней секреции (щитовидная, поджелудочная железа) также влияют на углеводный обмен и могут содействовать развитию сахарного диабета.
а) стероидный диабет
Моделирование стероидного диабета на подопытных животных актуально, т.к. позволяет изучить течение этого заболевания у людей. Эндогенный стероидный диабет у людей возникает при заболеваниях, обусловленных избыточной активностью АКТГ, вторичным гиперкортицизмом или первичным гиперкортицизмом, связанным с кортикостеромой. Экзогенный стероидный диабет возникает при длительном лечении препаратами глюкокортикоидов больных, например, ревматоидным артритом, бронхиальной астмой, коллагенозами.
С целью изучения заболевания у людей проводится экспериментальное моделирова
