Лазерная флоуметрия при сахарном диабете
Сахарный диабет – хроническое заболевание, которое ассоциируется с различными осложнениями, прежде всего сосудистыми. К наиболее распространенным микрососудистым осложнениям относятся ретинопатия, нефропатия, синдром диабетической стопы. Механизмы развития диабетической ангиопатии сложны и разнообразны. В частности, синдром диабетической стопы развивается вследствие изменений периферической нервной системы, артериального и микроциркуляторного русла.
Одна из самых важных задач современной медицины – предотвратить развитие этих осложнений, в том числе благодаря своевременной диагностике.
В статье рассматриваются возможности лазерной допплеровской флоуметрии и флуоресцентной спектроскопии в выявлении доклинических проявлений синдрома диабетической стопы.
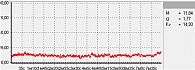
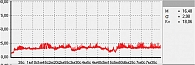
Рис. 1. Нормальная МК

Рис. 2. Повышенная МК
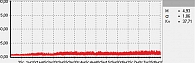
Рис. 3. Сниженная МК
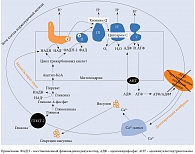
Рис. 4. Механизм увеличения продукции НАДН
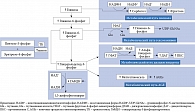
Рис. 5. Взаимосвязь между пентозофосфатным и альтернативными метаболическими путями

Рис. 6. Оценка НАДН

Рис. 7. Оценка ФАД

Рис. 8. Лазерный диагностический аппарат «ЛАЗМА СТ»
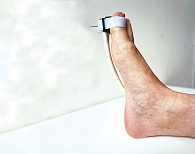
Рис. 9. Фиксация оптического волоконного зонда и температурного пробника аппарата «ЛАЗМА СТ» на пальце ноги

Таблица 1. Значения МК, резерва, ИУ в разных подгруппах контрольной группы

Таблица 2. Значения МК, резерва и ИУ в разных подгруппах основной группы
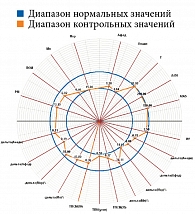
Рис. 10. Проба у пациентки контрольной группы
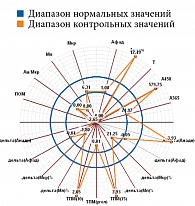
Рис. 11. Проба у пациента из подгруппы с риском развития СДС
Количество больных сахарным диабетом (СД) за последние десять лет увеличилось более чем в два раза. Столь стремительный рост заболеваемости стал причиной принятия Организацией Объединенных Наций в 2006 г. резолюции о сахарном диабете, а в 2011 г.– политической декларации, призывающей создавать многопрофильные стратегии для профилактики развития неинфекционных заболеваний и борьбы с ними, в частности в отношении СД как одной из ведущих причин инвалидизации и смерти [1].
В Российской Федерации, как и во всех странах мира, отмечается значительное повышение распространенности СД. По данным федерального регистра, в 2016 г. на диспансерном учете состояло 4,35 млн больных СД (3,0% населения). При этом насчитывалось 4 млн (92%) пациентов с СД 2 типа, 255 тыс. (6%) – с СД 1 типа и 75 тыс. (2%) пациентов с другими типами СД [1].
Сахарный диабет представляет собой хроническое, постоянно прогрессирующее заболевание, приводящее к развитию ряда осложнений, прежде всего микро- и макрососудистых.
Наиболее распространенным микрососудистым осложнением признана диабетическая ретинопатия. Она встречается практически у всех пациентов с СД длительностью более 20 лет [2, 3]. Еще одно опасное микрососудистое осложнение – диабетическая нефропатия. В 40–50% случаев ею обусловлено развитие терминальной стадии почечной недостаточности. На фоне терминальной стадии почечной недостаточности у трети пациентов развиваются серьезные осложнения, требующие в ряде случаев проведения гемодиализа [4]. Однако наиболее грозным микрососудистым осложнением является синдром диабетической стопы (СДС). Так, СДС ассоциируется с развитием язвенно-некротических процессов и гангрены стопы. До 75% выполняемых ампутаций нижних конечностей в мире связано с СДС [5, 6].
СДС ухудшает качество жизни больных [7], а также увеличивает риск инвалидизации и смерти [8–10]. Все это обусловливает повышение медицинских расходов [11].
Синдром диабетической стопы диагностируется у 15–25% больных СД. Его развитие обусловлено патологическими изменениями периферической нервной системы, артериального и микроциркуляторного русла, костно-суставного аппарата стопы.
К группе риска развития СДС относятся пациенты с дистальной полинейропатией, заболеваниями периферических артерий любого генеза, деформацией стоп, слепые и слабовидящие, пациенты с диабетической нефропатией и хронической болезнью почек третьей стадии и выше, пожилые лица, а также лица, злоупотребляющие алкоголем и табачной продукцией.
По данным Международной диабетической федерации, проблема ранней диагностики и мониторинга эффективности лечения при СД является одной из самых приоритетных.
В этой связи представляется неоспоримым потенциал комбинированной, одновременной оценки доставки крови в систему микроциркуляции методом лазерной допплеровской флоуметрии (ЛДФ) и окислительного метаболизма по биомаркерам – коферментам ткани способом лазерной флуоресцентной спектроскопии (ЛФС). Сочетание указанных методов диагностики позволяет оценить риск развития синдрома диабетической стопы [12].
Система микроциркуляции – одна из важных систем, по состоянию которой можно выявлять болезни на ранних стадиях. Необходимо отметить, что нарушения микроциркуляции могут быть не только вторичными, но и первичными, то есть обусловливать развитие ряда заболеваний и определять их исход. С теми или иными нарушениями отдельных звеньев микроциркуляции связано развитие атеросклероза, артериальной гипертензии, эндотоксемии и сепсиса, диабетической нефропатии, венозной недостаточности, диабетической ангиопатии нижних конечностей.
Мониторирование микроциркуляторной функции в клинике ограничено как из-за небольшого числа безопасных методов исследования, так и из-за сложности интерпретации данных [13]. В отличие от других методов исследования ЛДФ является безопасным методом оценки микроциркуляторной функции нижних конечностей, поскольку параметры кровотока определяются неинвазивно. С помощью ЛДФ можно исследовать такие звенья гемомикроциркуляторного русла, как артериолы, терминальные артериолы, капилляры, посткапиллярные венулы, венулы и артериоло-венулярные анастомозы [14–16].
Для оценки состояния микроциркуляции крови применяются следующие характеристики перфузии ткани кровью [17]:
- М – средняя величина потока крови, в относительных перфузионных единицах, характеризует среднюю перфузию;
- σ – среднее колебание перфузии крови в результате изменения сосудистого тонуса в микроциркуляторном русле, в перфузионных единицах;
- Кv – коэффициент вариации, характеризует зависимость изменения сосудистого тонуса от среднего значения кровотока.
Последний показатель рассчитывается по следующей формуле: Кv = σ : М × 100%.
В данной работе исследования проводились на подошвенной поверхности большого пальца ноги. Показатели микроциркуляции признаются нормальными, если М находится в пределах референсных значений – от пяти до 15 перфузионных единиц. При компенсаторном повышении микроциркуляции вследствие снижения энергетического метаболизма М превышает 15 перфузионных единиц, при снижении микроциркуляции из-за невозможности микроциркуляторного русла компенсировать нарушения энергетического метаболизма М не превышает пяти перфузионных единиц (рис. 1–3).
Митохондриальный стресс (нарушение окислительного метаболизма) – основной медиатор нейродегенерации при СД. Высокий уровень глюкозы в тканях обусловливает накопление в митохондриях восстановленного никотинамидадениндинуклеотида (НАДН). Увеличение доступности электронов (-e) и/или насыщенности митохондрий электронами может вызвать парциальное восстановление кислорода до супероксиданион-радикала в начальной части электронной транспортной цепи. Последующий подъем активных форм кислорода вызывает дегенеративные изменения тканей. Возрастание [Ca2+]m в клетках также может увеличить продукцию НАДН энзимами цикла Кребса – пируватдегидрогеназой, изоцитратдегидрогеназой, альфа-кетоглютаратдегидрогеназой. Дисбаланс редокс-системы (нарушение соотношения НАДН и никотинамидадениндинуклеотида (НАД)), окислительный стресс (образование свободных радикалов) и митохондриальный стресс также участвуют в повреждении тканей при СД.
Вазодилатация и усиление кровотока – характерные ранние сосудистые реакции на острую гипергликемию и тканевую гипоксию [18, 19].
Механизм увеличения продукции НАДН представлен на рис. 4 [20]. В бета-клетках поджелудочной железы глюкоза является не только энергетическим субстратом, но и стимулятором секреции инсулина [21–24]. Глюкоза транспортируется в бета-клетки глюкозным транспортером (ГЛЮТ) 2-го типа. Внутри клетки глюкоза фосфорилируется глюкокиназой с образованием глюкозо-6-фосфата [25, 26], который посредством гликолитического пути превращается в две молекулы пирувата. В дальнейшем пируват переносится в митохондрии и превращается в ацетилкофермент А (ацетил-КоА) пируватдегидрогеназным комплексом. Далее ацетил-КоА поступает в цикл трикарбоновых кислот, а полученные из него электроны передаются НАД и флавинадениндинуклеотиду (ФАД). В результате образуются внутримитохондриальный НАДН и окисленный ФАДН-2. Электроны, хранящиеся в этих двух молекулах, передаются коферменту Q через комплексы I и II. Возможный перенос электронов в молекулу O2 приводит к образованию во внутренних мембранах митохондрий протонного градиента, что приводит к синтезу аденозинтрифосфатсинтазы (АТФ) через комплекс V. Когда уровень глюкозы в крови повышается, количество НАДН и АТФ увеличивается, АТФ-чувствительные K-каналы закрываются. Это приводит к деполяризации клеточных мембран, и, следовательно, открытию Ca2+-каналов [24].
Именно приток Ca2+ запускает начальную фазу секреции инсулина из предварительно обработанных гранул инсулина.
При СД вследствие уменьшения количества бета-клеток достаточной утилизации НАДН и ФАД не происходит. Это приводит к нарушению гликолитического пути метаболизма глюкозы. Причина – ингибирование глицерол-3-фосфат-дегидрогеназы вследствие снижения количества НАД+. Поэтому запускаются другие пути метаболизма глюкозы, в том числе полиоловый. При полиоловом пути обмена генерируется НАДН из НАД+. В результате увеличивается соотношение НАДН/НАД+, продукция активных форм кислорода, развивается хроническая псевдогипоксия. Последняя может вызвать хроническое воспаление, способствующее дальнейшему прогрессированию дисфункции бета-клеток и повышению глюкозы крови [20].
Полиол-сорбитоловый путь обмена активируется гипергликемией. Длительная гипергликемия токсична для макро- и микрососудистой системы, данный феномен известен как глюкозотоксичность. Считается, что равномерный поток НАДН через комплекс I при СД может способствовать усугублению глюкозотоксичности [27].
Гипергликемия оказывает повреждающее действие на сосудистые стенки разными способами. Глюкоза попадает в эндотелиальные клетки с помощью ГЛЮТ-1 по инсулиннезависимому пути по градиенту концентрации. Повышенная ее концентрация может стимулировать образование оксида азота, что сопровождается синтезом высокоактивных пероксинитритов. Пероксинитриты способствуют активации перекисного окисления липидов и образованию нитротирозина. Нитротирозин нарушает функцию эндотелия и вместе с тем играет ключевую роль в окислительном стрессе. Подавление антиоксидантной защиты и усиленное образование продуктов окисления вызывают окислительный стресс.
К другим факторам, способствующим развитию окислительного стресса, относится активное образование метилглиоксаля и других веществ, синтезируемых в альтернативных путях метаболизма (рис. 5) [28].
Динамику коферментов энергетического метаболизма – ФАД и НАДН и нарушение окислительного метаболизма можно исследовать с помощью лазерной флуоресцентной спектроскопии (ЛФС) [29].
В работах по оценке окислительного метаболизма методом флуоресцентной спектроскопии применяются разные соотношения между амплитудами флуоресценции НАДН и ФАД. Метаболические процессы клеточных структур ткани энергозависимы. В данной методике регистрируются изменения амплитуд флуоресценции Δ ФАД и Δ НАДН при температурной пробе: тесты с нагревом (повышение активности) и охлаждением (снижение активности) метаболизма. Тесты проводятся для оценки адаптационных возможностей ткани и устранения возможных оптических помех от сопутствующих флуорофоров ткани при возбуждении флуоресценции коферментов [30].
Оценка НАДН и ФАД с помощью ЛФС представлена на рис. 6 и 7.
Нами проведено пилотное исследование, целью которого стала оценка критериев риска доклинических проявлений СДС по состоянию микроциркуляторного русла и тканевого метаболизма у больных СД.
Материал и методы
В исследование было включено 50 пациентов с разной длительностью СД.
Критерии включения в исследование:
- СД 1 и 2 типов;
- уровень гликированного гемоглобина – от 6,0 до 11,0%.
- Критерии исключения:
- нарушение магистрального кровотока сосудов нижних конечностей;
- тяжелые соматические заболевания;
- стенозирующий атеросклероз нижних конечностей;
- беременность.
Пациенты основной группы были разделены на три подгруппы в зависимости от типа и тяжести нарушений микроциркуляторной и тканевой систем.
Группу контроля составили 20 лиц без нарушений углеводного обмена, магистрального кровотока сосудов нижних конечностей, тяжелых соматических заболеваний. Данная группа была разделена на три подгруппы в зависимости от возраста.
Нарушение микроциркуляторного русла определяли с помощью ЛДФ, тканевого метаболизма – ЛФС. Исследование микроциркуляторного русла и окислительного метаболизма проводили на лазерном диагностическом аппарате «ЛАЗМА СТ» (рег. уд. № РЗН 2017/5844 от 8 июня 2017 г.) (рис. 8).
Согласно протоколу исследования регистрация параметров осуществлялась в три этапа в течение одной диагностической процедуры на подошвенной части большого пальца стопы (рис. 9). Первый этап – состояние покоя – восемь минут (достижение стабилизации исходного состояния), второй – при охлаждении до 10 °С – одна минута (до холодовой вазодилатации), третий – при нагревании до 35 °С – четыре минуты (время регистрации параметров сосудистого тонуса).
Результаты
Микроциркуляция крови (МК), резерв метаболизма (резерв), индекс утилизации (ИУ) в подгруппах контрольной группы представлены в табл. 1.
Результаты диагностической процедуры у пациентки контрольной группы представлены на рис. 10. Микроциркуляция активная, окислительный метаболизм в норме. МК – 15,0 перфузионной единицы, температура – 30 °С, резерв – 73%, ИУ – 2,5 относительной единицы.
Микроциркуляция крови, резерв, ИУ в подгруппах основной группы представлены в табл. 2, результаты диагностической процедуры у пациента из подгруппы с риском развития СДС – на рис. 11. Микроциркуляция неактивная, выраженное снижение окислительного метаболизма. МК – 6,31 перфузионной единицы, температура – 26 °С, резерв – 12%, ИУ – 0,44 относительной единицы.
Заключение
Лазерная допплеровская флоуметрия и лазерная флуоресцентная спектроскопия позволяют оценить динамику коферментов энергетического метаболизма и микроциркуляции, а также резервных показателей энергетического метаболизма при проведении функциональных проб: холодовой и тепловой.
Полученные результаты свидетельствуют о высокой диагностической значимости комплексного применения ЛДФ и ЛФС в отношении выявления риска развития СДС. Сочетание этих методов диагностики позволит персонифицировать антидиабетическую терапию СД.
Сахарный диабет – заболевание, которое ассоциируется с различными осложнениями, прежде всего микрососудистыми. Поэтому одна из важных задач диабетологии – своевременное выявление факторов риска их развития и профилактика. К информативным методам оценки нарушения функции микроциркуляторно-тканевой системы, включая микроциркуляцию кровотока и окислительный метаболизм, следует отнести лазерную допплеровскую флоуметрию в сочетании с лазерной флуоресцентной спектроскопией. Преимуществом такого подхода является не только высокая информативность, но и безопасность, возможность динамического наблюдения, объективность и получение данных о тканевом метаболизме (окисленном флавинадениндинуклеотиде и восстановленном никотинамидадениндинуклеотиде).
В статье приводятся результаты исследования состояния микроциркуляторного русла и тканевого метаболизма у 16 пациентов с сахарным диабетом 2 типа. Десять из них находились на терапии метформином в дозе 1000 мг два раза в день (утром и вечером), шесть –метформином и препаратом Субетта. Установлено, что добавление препарата Субетта к метформину способствовало значительному улучшению показателей микроциркуляции и тканевого метаболизма.

Таблица 1. Контрольные значения диагностических величин при применении ЛДФ

Рис. 1. Нормальная микроциркуляция

Рис. 2. Повышенная микроциркуляция
Рис. 3. Сниженная микроциркуляция

Таблица 2. Контрольные показатели окислительного метаболизма и резервов метаболизма

Рис. 4. Амплитуды флуоресценции НАДН

Рис. 5. Амплитуда флуоресценции ФАД

Рис. 6. Показатель микроциркуляции до добавления препарата Субетта

Рис. 7. Показатель микроциркуляции после добавления препарата Субетта
Согласно данным экспертов Международной федерации диабета (International Diabetes Federation – IDF) и Американской диабетической ассоциации, количество пациентов с сахарным диабетом (СД) за последние десять лет увеличилось более чем в два раза. Столь стремительный рост заболеваемости стал причиной принятия в 2006 г. Организацией Объединенных Наций резолюции о сахарном диабете [1], а в 2011 г. – политической декларации [2], призывающей создавать многопрофильные стратегии для профилактики развития неинфекционных заболеваний и борьбы с ними, в частности в отношении СД, осложнения которого являются одной из ведущих причин инвалидизации и смерти [3, 4].
В 2017 г. численность больных СД превысила 425 млн. Согласно прогнозам IDF, к 2045 г. СД будут страдать 629 млн человек [5].
В Российской Федерации, так же как во всем мире, отмечается возрастание заболеваемости СД. Согласно данным федерального регистра СД, в 2018 г. на диспансерном учете находилось 4 584 575 человек (3,1% населения). Из них 4 238 503 (92%) – с СД 2 типа, 256 202 (6%) – с СД 1 типа и 89 870 (2%) – с другими типами СД, в том числе 8006 с гестационным. Однако эти данные не отражают реального количества пациентов, поскольку учитывают только выявленные и зарегистрированные случаи. Так, результаты масштабного российского эпидемиологического исследования NATION подтверждают, что диагностируется лишь 54% случаев СД 2 типа. Реальное количество больных в России – не менее 9 млн (около 6% населения). В долгосрочной перспективе это может представлять чрезвычайную проблему. Поскольку у значительной части пациентов СД остается недиагностированным, они не получают лечения и высок риск развития сосудистых осложнений [6–11].
Инсулинорезистентность и ее роль в развитии эндотелиальной дисфункции
Изменения на любом из этапов внутриклеточной сигнальной трансдукции инсулина могут стать причиной инсулинорезистентности на молекулярном уровне.
Инсулинорезистентность – нарушение биологического ответа (метаболического и молекулярно-генетического) на экзогенный и эндогенный инсулин, метаболизма углеводов, жиров и белков, а также синтеза ДНК, регуляции транскрипции генов, процессов дифференцировки и роста клеток и тканей организма [12]. В инициации инсулинорезистентности большое значение отводится пострецепторным нарушениям передачи сигнала инсулина, обусловленным, вероятно, повышением уровня фактора некроза опухоли α, неэтерифицированных жирных кислот, малоподвижным образом жизни, высококалорийной диетой, возрастом, курением, избыточным весом/ожирением и др. [13]. Причинами инсулинорезистентности клеток поперечнополосатых мышц могут быть дефекты транспорта глюкозы, обусловленные патологией глюкозного транспортера 4 [14].
Инсулинорезистентность признана одной из главных причин развития эндотелиальной дисфункции, приводящей к развитию сердечно-сосудистых заболеваний и их осложнений [8, 12, 15].
Микро- и макроциркуляторные нарушения, которые зачастую формируются незаметно, значительно снижают качество жизни больных и могут стать причиной преждевременной смерти.
Микроциркуляция изменяется задолго до клинических проявлений сахарного диабета. Именно она играет центральную роль в формировании синдрома диабетической стопы – одного из поздних осложнений СД [15–19].
В этой связи представляется неоспоримым потенциал комбинированной, одновременной оценки перфузии крови в системе микроциркуляции с помощью лазерной допплеровской флоуметрии (ЛДФ) и окислительного метаболизма с помощью лазерной флуоресцентной спектроскопии (ЛФС). Окислительный метаболизм определяется по таким биомаркерам-коферментам, как окисленный флавинадениндинуклеотид (ФАД) и восстановленный никотинамидадениндинуклеотид (НАДН). Сочетание указанных методов диагностики позволяет установить риск развития нарушений со стороны микроциркуляторного русла и тканевого метаболизма [20].
Система микроциркуляции
Система микроциркуляции – одна из важных систем, по состоянию которой можно выявлять болезни на ранних стадиях. Необходимо отметить, что нарушение микроциркуляции может быть не только вторичным, но и первичным, то есть обусловливать развитие ряда заболеваний и определять их исход. С теми или иными нарушениями отдельных звеньев микроциркуляции связано развитие атеросклероза, артериальной гипертензии, эндотоксемии и сепсиса, диабетической нефропатии, венозной недостаточности, диабетической ангиопатии нижних конечностей [21].
Мониторирование микроциркуляторной функции в клинике ограниченно как из-за небольшого числа безопасных методов, так и из-за сложности интерпретации данных [21].
В отличие от других методов ЛДФ является безопасным способом оценки микроциркуляторной функции нижних конечностей, поскольку параметры кровотока определяются неинвазивно. С помощью ЛДФ можно исследовать такие звенья гемомикроциркуляторного русла, как артериолы, терминальные артериолы, капилляры, посткапиллярные венулы, венулы и артериоло-венулярные анастомозы [22–24].
В таблице 1 приведены контрольные значения диагностических величин состояния микроциркуляции, исследованной на подошвенной области большого пальца ноги здоровых лиц с помощью ЛДФ.
Примеры исследования микроциркуляции представлены на рис. 1–3.
Окислительный метаболизм
Митохондриальный стресс (нарушение окислительного метаболизма) – основной медиатор нейродегенерации при СД. Высокий уровень глюкозы в тканях обусловливает накопление в митохондриях НАДН. Увеличение доступности электронов и/или насыщенности митохондрий электронами может вызвать парциальное восстановление кислорода до супероксид-анион-радикала в начальной части электронной транспортной цепи. Последующий подъем активных форм кислорода вызывает дегенеративные изменения тканей. Возрастание [Ca2+]m в клетках также может увеличить продукцию НАДН энзимами цикла Кребса – пируватдегидрогеназой, изоцитратдегидрогеназой, α-кетоглутаратдегидрогеназой.
Дисбаланс редокс-системы (нарушение соотношения НАДН и НАД), окислительный стресс (образование свободных радикалов) и митохондриальный стресс участвуют в повреждении тканей при СД. Вазодилатация и усиление кровотока – ранние сосудистые реакции на острую гипергликемию и тканевую гипоксию [25, 26].
Регистрировать увеличение концентрации указанных выше коферментов позволяет лазерная флуоресцентная спектроскопия [27].
В таблице 2 приведены контрольные показатели окислительного метаболизма (ПОМ) и резервов метаболизма (РМ).
Показатель окислительного метаболизма рассчитывается по формуле: ПОМ = Мнутр. : (АНАДН + АФАД).
Резерв окислительного метаболизма определяется при проведении температурной пробы. Резервы окислительного метаболизма при нагреве области исследования до 35 °С (РМ(+)) и охлаждении до 10 °С (РМ(-)) определяются по следующим формулам:
РМ(+) = (1-(ПОМ(35) – ПОМисх.) : ПОМисх.) × 100%;
РМ(-) = (1-(ПОМ(10) – ПОМисх.) : ПОМисх.) × 100%,
где ПОМисх. – показатель окислительного метаболизма в исходном состоянии области исследования;
ПОМ(35) – показатель окислительного метаболизма при нагреве области исследования до 35 °С;
ПОМ(10) – показатель окислительного метаболизма при охлаждении области исследования до 10 °С.
Пример динамики амплитуд флуоресценции коферментов приведен на рис. 4 и 5.
Амплитуда коферментов рассчитывается по формулам:
АНАДН = АfНАДН : Аi385;
АФАД = АfФАД : Аi450,
где Аf – максимум в линии флюоресценции;
Аi – максимум в линии обратного рассеяния.
По оси ОХ отражается длина волны в нанометрах, по оси ОY – амплитуда флуоресценции в условных единицах, первый подъем – максимум в линии обратного рассеяния (Аi), то есть обратное рассеянное кожей излучение на длине волны генерации лазера, второй подъем – максимум в линии флуоресценции (Аf).
Способы коррекции инсулинорезистентности
Во всех разработанных алгоритмах лечения в качестве препарата выбора для стартовой терапии рекомендован метформин. Однако эта мера лишь частично решает проблему, поскольку влияние метформина на чувствительность мышечной и жировой тканей к инсулину незначительно. Тиазолидиндионы благодаря уникальному механизму действия превосходят в этом метформин. Снижая нагрузку на β-клетки, они способствуют длительному сохранению их способности секретировать инсулин. Однако публикация S.E. Nissen и соавт. «Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes» («Влияние росиглитазона на риск развития инфаркта миокарда и смерти от сердечно-сосудистых причин») (2007 г.), представляющая собой метаанализ данных 42 рандомизированных клинических исследований, всколыхнула медицинское сообщество [28]. Приведенные в ней результаты стали основанием для Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США ввести новые беспрецедентные требования к доказательной базе в отношении безопасности гипогликемических препаратов. В сентябре 2010 г. Европейское медицинское агентство рекомендовало приостановить продажу росиглитазона в Европе. До истории с росиглитазоном в 2000 г. был отозван еще один представитель данной группы препаратов – троглитазон – из-за высокой гепатотоксичности. Это стало поводом для проявления настороженности и в отношении пиоглитазона [12].
В связи с вышесказанным существует потребность в препаратах, влияющих на инсулинорезистентность.
В 2010 г. на отечественном фармацевтическом рынке появился новый препарат Субетта (ООО «Научно-производственная фирма „Материа Медика Холдинг“»).
Субетта – комплексный препарат, созданный на основе технологически обработанных антител в сверхвысоких разведениях к β-субъединице рецептора инсулина и антител к эндотелиальной NO-синтазе (анти-eNOS). В отличие от высоких концентраций антител, связывающихся с антигенами и блокирующих их, уникальная технология высокого разведения позволяет получить антитела, которые не блокируют молекулы-мишени, а через конформационные изменения регулируют их функцию и биологические эффекты [29, 30]. Изменяя конформацию β-субъединицы инсулинового рецептора, препарат активирует его: повышает соотношение активированных форм β-субъединиц инсулинового рецептора к общим формам [30] и продукцию адипонектина адипоцитами [31], стимулирует индуцированный инсулином захват глюкозы клетками мышечной ткани [32]. Одновременно препарат модулирует активность eNOS, оказывая терапевтическое воздействие на эндотелиальную дисфункцию [33]. Последняя также ассоциируется с инсулинорезистентностью. Эндотелиальная дисфункция способствует прогрессированию СД 2 типа и его сосудистых осложнений [33].
Цель исследования
Изучить динамику состояния микроциркуляторного русла и тканевого метаболизма (по динамике коферментов ФАД и НАДН) с помощью лазерной допплеровской флуометрии и лазерной флуоресцентной спектроскопии у больных сахарным диабетом 2 типа на фоне приема только метформина и в комбинации с препаратом Субетта.
Материал и методы
Обследовано 16 пациентов с СД 2 типа (11 женщин и пять мужчин) в возрасте 49–70 лет с уровнем гликированного гемоглобина 6,5–7,5%.
Помимо общепринятых методов исследования, таких как оценка общего статуса, биохимического и клинического анализа крови, гликированного гемоглобина, глюкозы крови в течение суток, ультразвукового исследования, реовазографии, с помощью ЛДФ и ЛФС изучались микроциркуляция (М) и тканевый метаболизм соответственно.
Для сочетанного применения ЛДФ и ЛФС использовали аппарат лазерный диагностический «ЛАЗМА СТ» (регистрационное удостоверение Росздравнадзора № РЗН 2017/5844 от 08.06.2017). Проводились тепловая (местное нагревание до 35 °С) и холодовая (местное охлаждение до 10 °С) пробы, позволяющие выявить резервные возможности тканевого метаболизма и, следовательно, раннее нарушение микроциркуляции.
Контрольные значения диагностических величин при применении ЛДФ представлены в табл. 1.
Показатели окислительного метаболизма и резервов метаболизма (РМ(+) и РМ(-)), соответствующие норме, представлены в табл. 2.
Исследование проводилось на подошвенной части большого пальца стопы. Данная область предварительно обрабатывалась спиртовым раствором. Исследование предполагало несколько этапов:
регистрация исходной температуры исследуемой области на панели «ЛАЗМА-ТЕСТ» в окне программы. Регистрация записи кровотока и лимфотока, амплитуды флуоресценции НАДН в течение четырех минут (ультрафиолетный спектр) и амплитуды флуоресценции ФАД также в течение четырех минут (синий спектр), общая длительность исследования – восемь минут;
- охлаждение области исследования до 10 °С. Контроль охлаждения по данным на панели «ЛАЗМА-ТЕСТ»;
- регистрация записи кровотока и лимфотока при 10 °С, спектров флуоресценции НАДН в течение 30 секунд (ультрафиолетный спектр) и ФАД в течение 30 секунд (синий спектр). Длительность исследования – одна минута;
- нагрев области исследования до 35 °С. Контроль нагрева по данным на панели «ЛАЗМА-ТЕСТ»;
- регистрация кровотока и лимфотока при 35 °С, спектров флуоресценции НАДН в течение двух минут (ультрафиолетный спектр) и ФАД в течение двух минут (синий спектр). Общая длительность исследования – четыре минуты.
Пациенты были разделены на две группы, сопоставимые по полу и возрасту, уровню гликированного гемоглобина.
Первую, контрольную, группу составили десять больных (семь женщин и трое мужчин). Они принимали метформин в дозе 2000 мг/сут (утром и вечером).
Вторая группа включала шесть пациентов (четыре женщины и двое мужчин). В дополнение к метформину в той же суточной дозе они принимали препарат Субетта. Препарат Субетта назначался два раза в день (по две таблетки для рассасывания).
Критерии включения в исследование:
- СД 2 типа;
- уровень гликированного гемоглобина от 6,5 до 7,5%.
Критерии невключения:
- наличие нарушений магистрального кровотока сосудов нижних конечностей;
- грибковое поражение;
- тяжелые соматические заболевания;
- онкология;
- беременность,
- прием других сахароснижающих препаратов, кроме метформина.
Оценка микроциркуляции и тканевого метаболизма проводилась в начале исследования и через три месяца. Определяли микроциркуляцию в перфузных единицах, ПОМ в относительных единицах.
Результаты
За время наблюдения общее состояние больных удовлетворительное, изменений со стороны клинических показателей крови и биохимических показателей состояния печени не отмечено, снижение гликированного гемоглобина на 0,4–0,7%, триглицеридов с 5,6 до 3,2 мкмоль/л.
В первой группе значимых изменений М, ПОМ и снижения РМ(+) выявлено не было, что свидетельствовало об отсутствии улучшения активности метаболизма.
Во второй группе у четырех пациентов из шести повысились М, ПОМ и снизился РМ(+), что соответствовало улучшению активности метаболизма.
Пациент 1. М исходно – 17,64, через 12 месяцев – 22,20, ПОМ – 2,29 и 6,14, РМ(-) – -85,60 и -32,91, РМ(+) – 122,0 и 7,8 соответственно.
Пациент 2. М исходно 7,09, через 12 месяцев – 22,10, ПОМ – 0,30 и 3,07, РМ(-) – -53,22 и -40,80, РМ(+) – 580 и 17 соответственно.
Пациент 3. М исходно – 12,31, после терапии Субеттой – 16,10, ПОМ – 0,37 и 1,69, РМ(-) – -5,15 и -46,81, РМ(+) – 213 и 130 соответственно.
Пациент 4. М до терапии препаратом Субетта – 7,00, после лечения – 14,00, ПОМ – 0,47 и 2,47, РМ(-) – -45,20 и -77,43, РМ(+) – 387 и 141 соответственно.
В качестве примера приведем более полные данные пациента 3. У больного до терапии практически отсутствовала реакция на холодовую пробу – низкое значение РМ(-) – -5,15. После терапии препаратом Субетта отмечался значительный прирост РМ(-) – -46,81, что свидетельст?
