Липотоксичность в патогенезе сахарного диабета
ГБОУ ДПО РМАПО, Москва
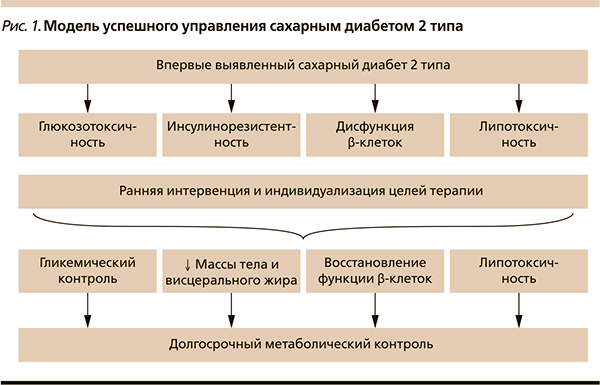
Стремительное распространение сахарного диабета и ожирения в мире требует незамедлительных мероприятий по изменению образа жизни и интервенции терапии начиная с ранних этапов развития заболевания, что позволит избегать дальнейшего развития нарушений углеводного и липидного обменов, а также их осложнений. По современным данным, патогенетическим связующим звеном данных заболеваний является липотоксичность, которая проявляется комплексом негативных эффектов жирных кислот на органы и ткани, вовлеченные в патогенез сахарного диабета. Проведенное исследование демонстрирует возможность успешного управления впервые выявленным сахарным диабетом 2 типа путем своевременного и эффективного влияния на массу тела под контролем параметров гликемического, липидного профилей и маркеров липотоксичности.
Введение
Важнейшими медицинскими, социальными и экономическими проблемами современности стали ожирение и сахарный диабет 2 типа (СД2). По данным 2013 г., СД2 имели 374 млн человек. Избыток массы тела или ожирение в настоящее время имеют 526 млн. Во многом именно за счет данной когорты пациентов к 2030 г. на Земле будет 552 млн больных СД [1]. Стремительное распространение СД и ожирения в мире во многом обусловлено сложившимся за последние десятилетия рационом питания, где превалируют легкоусвояемые углеводы и животные жиры. Ранее считалось, что данная проблема коснулась в основном США, где был изобретен и массово применяется фаст-фуд. Однако, по данным 2012 г., в Российской Федерации 46,5 % мужчин и 51,7 % женщин имеют ожирение или избыток массы тела, а СД страдают 9-10 млн человек [2, 3]. Следовательно, проблема нерационального питания и гиподинамии, приводящих к развитию нарушений углеводного обмена, требует незамедлительных мероприятий здравоохранения. Изменение образа жизни на раннем этапе позволит избегать дальнейшего развития СД2, его осложнений и сердечно-сосудистой патологии.
Для решения данных проблем в развитых странах мира разработаны алгоритмы, основной целью которых является достижение гликемического контроля, однако такой односторонний подход недостаточно эффективен. В исследованиях ACCORD, ADVANCE и VADT строгий гликемический контроль сопровождался увеличением риска смертности. Согласно результатам NHANES III (1988-1994), 44,5 % пациентов с СД2 имели уровень гликированного гемоглобина (HbA1c)
Липотоксичность-связующее звено нарушений углеводного и жирового обмена
В нескольких исследованиях показана взаимосвязь висцерального ожирения, резистентности к инсулину и гипергликемии. Висцеральное ожирение также является независимым сильным предиктором развития СД2. Висцеральный жир более метаболически активен, чем подкожный, в нем с высокой скоростью происходят процессы липолиза или липогенеза, что, соответственно, делает его основным источником ЖК. Висцеральная жировая ткань имеет ограниченные возможности хранения энергии в виде ЖК, индивидуальные для каждого человека. При избыточном длительном употреблении в пищу легкоусвояемых углеводов и жиров жировая ткань накапливает лишнюю энергию, однако, когда наступает предел ее возможностей, ЖК начинают поступать в кровоток и затем – в нежировые органы и ткани, не предназначенные для их хранения [5]. Насыщение адипоцитов ЖК также сопровождается активацией патологических механизмов: образуются более крупные, резистентные к действию инсулина адипоциты; запускается процесс местного воспаления, стимулируется секреция провоспалительных цитокинов, что способствует развитию нечувствительных жировых клеток. В поджелудочной железе, печени и мышцах запускаются различные патологические процессы, в комплексе способствующие развитию нарушений углеводного обмена.
При воздействии высокой концентрации свободных жирных кислот (СЖК) на культуру β-клеток и изолированные островки Лангерганса подавляется первая фаза глюкозостимулированной секреции инсулина [6]. По данным С. Olofsson и соавт., длительное воздействие на островки глюкозы и СЖК ингибирует секрецию инсулина на поздней стадии экзоцитоза, влияя на высвобождение инсулина при слиянии пор [7]. Кроме того, пальмитиновая кислота способна ингибировать экспрессию гена SUR (sulfonylurea receptor)-1, что также может являться одним из молекулярных механизмов подавления глюкозостимулированной секреции инсулина [8].
Помимо процессов высвобождения инсулина под действием СЖК нарушается экспрессия гена инсулина. В эксперименте на изолированных островках Лангерганса воздействие пальмитиновой кислоты вызывало увеличение концентрации церамида, что было ассоциировано со снижением количества мРНК инсулина. G. Solinas и соавт. показали, что пальмитиновая кислота активирует JNK в β-клетках, что сопровождается фосфорилированием субстратов рецептора инсулина 1 и 2, нарушая транскрипцию гена инсулина [9]. Более того, СЖК активируют апоптоз β-клеток путем образования церамида и активации оксидативного стресса. Синтез церамидов в β-клетках увеличивает количество адаптивных нитратоксид-синтаз. Результирующее увеличение оксида азота увеличивает экспрессию воспалительных цитокинов, включая интерлейкин-1 и фактор некроза опухоли, которые ухудшают функцию β-клеток и способствуют их апоптозу. Негативные эффекты СЖК на поджелудочную железу могут лежать в основе нарастающего снижения массы β-клеток и прогрессирования СД2.
Влияние СЖК на печень характеризуется несколькими механизмами.
В первую очередь происходит активация глюконеогенеза. Увеличение поступления СЖК в печень сопровождается ускорением окисления липидов и накоплением ацетил-КоА, повышенная концентрация которого стимулирует активность пируваткарбоксилазы и тормозит скорость ферментов глюконеогенеза, а также глюкозо-6-фосфатазы, контролирующей скорость высвобождения глюкозы из гепатоцитов. Кроме того, в исследовании G. Boden и соавт. показана способность СЖК подавлять ингибирующий эффект инсулина на гликогенолиз.

У пациентов с СД2 увеличение концентрации СЖК в плазме сопровождается повышением плазменного уровня глюкагона и чувствительности печени к активации гликогенолиза [10]. Дополнительным негативным эф…
>
А.С. Аметов, Е.А. Тертычная
В. М. Литвиненко, Л.Л. Камынина
Многопрофильный медицинский центр “123”, Сочи
ФГБОУ ДПО “Российская медицинская академия последипломного образования” Минздрава России
МКБ-10:
IV.E10-E14.E11 Инсулиннезависимый сахарный диабет
Представлены клинические случаи использования в реальной клинической практике двойной комбинации с метформином инновационных сахароснижающих препаратов (инкретиномиметика лираглутида и ингибитора SGLT2 дапаглифлозина) у молодых пациентов с сахарным диабетом типа 2 (СД2), страдающих висцеральным ожирением. Продемонстрировано снижение степени выраженности глюкозо- и липотоксичности у комплайентных пациентов при условии адекватной физической нагрузки и следования правилам рационального питания. Наряду с улучшением качества гликемического контроля отмечена тенденция к достижению нормального физиологического баланса между адипокинами.
глюкозотоксичность, липотоксичность, сахарный диабет типа 2, висцеральное ожирение, метформин, инкретиномиметик лираглутида, дапаглифлозин
Эндокринология: новости, мнения, обучение. 2016. № 2. С. 98-101.
В настоящее время, несмотря на предоставленный эндокринологу широкий выбор сахароснижающих препаратов, достижение целевых значений гликемического и внегликемического контроля отмечается не у всех пациентов с сахарным диабетом типа 2 (СД2). При этом в качестве основного метаболически неблагоприятного фактора рассматривается часто отмечаемое развитие СД2 на фоне висцерального ожирения, что предполагает сочетанное нарушение углеводного и липидного обмена. В условиях высокой гипергликемии активируются патофизиологические метаболические сигнальные шунты и развивается оксидативный стресс. Наличие висцерального ожирения является отягощающим фактором, так как в этом случае отмечается сочетание глюкозо- и липотоксичности.
Представляет несомненный интерес изучение динамики гликемических и внегликемических параметров у пациентов с СД2 и висцеральным ожирением при использовании инкретиновой терапии инкретиномиметиком лираглутидом или ингибитора SGLT2 дапаглифлозина в комбинации с препаратом первой линии сахароснижающей терапии метформином в отношении снижения интенсивности глюкозо- и липотоксичности.
Интенсификация сахароснижающей терапии при морбидном ожирении
Пациент К., 38 лет, чиновник, имеет отягощенный семейный анамнез по СД2 по материнской линии. Рожден в срок. У матери был диагностирован гестационный сахарный диабет, трансформировавшийся впоследствии в СД2. Масса тела при рождении – 6950 г. Быстрый набор массы тела отмечает с рождения. В 6 мес масса тела достигла 19 кг. В возрасте с 12 до 33 лет профессионально занимался спортом (армреслинг, сумо), что предопределило дальнейший набор массы тела на фоне гиперкалорийного питания и умеренных доз алкогольных напитков (саке, пиво).
В возрасте 33 лет был диагностирован СД2 и рекомендован прием двойной сахароснижающей терапии “метформин + препарат сульфонилмочевины”, продолжавшийся в течение 5 лет стартовой – в виде комбинации гликлазида и метформина, сменившейся фиксированной комбинацией Глибомет 0,5/0,025 2 таблетки 2 раза в день. На фоне приема последней фиксированной комбинации пациент отметил быстрый набор массы тела. По окончании спортивной карьеры в возрасте 33 лет отмечает дальнейший набор массы тела (+100 кг в течение 5 лет).
Сопутствующая терапия по поводу артериальной гипертензии I степени: периндоприл 5 мг 1 раз в сутки ежедневно.
Данные объективного обследования. Рост – 197 см, масса тела – 310 кг, ИМТ 81,5 кг/м2. Окружность талии – 177 см. Отношение к окружности бедер (ОТ/ОБ) – 2,1. Отношение окружности шеи к окружности голени (ОШ/ОГ) – 1,05. Объем висцерального жира – 52%. Аускультативно: дыхание в легких везикулярное, хрипы не выслушиваются. Тоны сердца – приглушены, ритм правильный. АД -135/85 мм рт.ст. ЧСС – 85 в минуту. ЧД – 16 в минуту.
Результаты лабораторного исследования: HbA1c – 8,1%, гликемия натощак (ГН) – 8,8 ммоль/л, постпрандиальная гликемия (ППГ) – 12,7 ммоль/л. Иммунореактивный инсулин (ИРИ) натощак – 28,8 мкЕд/мл, HOMA-IR – 11,2%, HOMA-β – 109%. Креатинин – 96 мкмоль/л, CKD-EPI – 120, MDRD – 134 мл/мин/1,73м2.
Отмечались нецелевые параметры липидограммы [индекс атерогенности (ИА) – 11,0]. Лептин – 102,3 нг/мл, адипонектин -0,7 мкг/мл.
Диагноз: СД2 (целевой уровень HbA1c <7%). Ожирение III степени (ИМТ – 81,5 кг/м2). Дислипидемия IIb. Артериальная гипертензия I степени, риск 3. ХБП QA1.
Назначена интенсифицированная сахароснижающая терапия: инкретиномиметик лираглутид 1,8 мг/сут подкожно [с титрацией по схеме 0,6 (10 дней), 1,2 (20 дней), далее – 1,8] перед завтраком на фоне приема пролонгированной формы метформина ГлюкофажЛонг 2000 мг однократно на ночь.
Рекомендованы диета с устранением легкоусвояемых углеводов и животных жиров и адекватная физическая нагрузка (плавание, ходьба 5 км в день в продолжительном неинтенсивном регулярном режиме). Старт инкретиновой терапии в первые 10-12 дней сопровождался транзиторными нежелательными явлениями со стороны желудочно-кишечного тракта (слабость, незначительно выраженная тошнота, отсутствие аппетита).
Через 3 мес терапии у пациента были отмечены близкие к целевым значениям гликемические и внегликемические параметры. Положительная динамика продолжилась и в последующем (табл. 1).
Пациент выразил большую удовлетворенность схемой терапии “метформин + инкретиномиметик” по сравнению с исходным использованием терапии “метформин + препарат сульфонилмочевины”, несмотря на необходимость подкожного введения инкретиномиметика. К основным преимуществам инкретиновой терапии инкретиномиметиком лираглутидом. У данного пациента следует отметить снижение массы тела, отсутствие эпизодов гипогликемий, возможность вести активный образ жизни и адекватно выполнять профессиональные обязанности, что свидетельствует об улучшении качества жизни пациента.
Стартовая терапия при впервые выявленном сахарном диабете типа 2
Пациенту Б., 38 лет, бизнесмену, с впервые выявленным сахарным диабетом, развившимся на фоне висцерального ожирения и характеризовавшимся плохим качеством гликемического контроля HbA1c – 8,1%) была назначена стартовая сахароснижающая терапия “метформин + ингибитор SGLT2”.
Мать страдает СД2. Масса тела при рождении – 5 кг. Набор массы тела в течение последних 10 лет составил 45 кг.
Со стороны внутренних органов – без особенностей. ИМТ – 39,8 кг/м2, ОТ – 137 см.
Креатинин – 82 мкмоль/л, CKD-EPI – 86, MDRD – 81 мл/мин/1,73 м2.
Диагноз: СД2 (целевой уровень HbA1c <7%). Ожирение II степени. Дислипидемия IIb. ХБП С2A1.
Рекомендована стартовая комбинированная сахароснижающая терапия: дапаглифлозин 10 мг + метформин медленного высвобождения 2000 мг. На фоне проводимой терапии (через 3 мес) отмечена положительная динамика гликемических и внегликемических показателей (табл. 2). Пациент придерживался гипокалорийной диеты (~1200 ккал/сут) и имел адекватный уровень физической нагрузки (ходьба 5 км в день, ежедневно).
На фоне сахароснижающей терапии “форсига 10 мг + ГлюкофажЛонг 2000 мг/сут” пациент отметил улучшение самочувствия и отсутствие напряжения при выполнении профессиональных обязанностей.
Представленные клинические случаи подтверждают возможность улучшения качества гликемического контроля при использовании инновационной сахароснижающей терапии, как при стартовом назначении, так и при интенсификации гликемического контроля.
Характерно, что в обоих случаях уже через 3 мес терапии отмечено достижение целевых параметров гликемии. При этом выявлено снижение как уровня ГН, так и ППГ, что свидетельствует о снижении вариабельности гликемии, основной причины развития оксидативного стресса и присоединения осложнений СД2.
Показано, что назначение как инкретиномиметика, так и ингибитора SGLT2 способствует быстрому улучшению качества гликемического контроля без набора массы тела. Так, было показано, что назначение стартовой комбинированной терапии метформином и препаратами сульфонилмочевины пациенту К. способствовало набору массы тела, в то время как переключение с препаратов сульфонилмочевины на инкретиномиметик лираглутид привело к ее снижению. Между тем лираглутид в дозе 3 мг/сут утвержден FDA в качестве препарата для терапии ожирения у лиц, не имеющих нарушения углеводного обмена, что также подтверждено результатами исследования SCALE [4]. Так, использование лираглутида в качестве сахароснижающего препарата в данном наблюдении способствовало снижению массы тела (динамика ИМТ составила 16,9 кг/м2) и стало примером эффективного терапевтического ведения морбидного ожирения, как правило, резистентного к терапевтическому воздействию у большинства пациентов.
Снижение массы тела также отмечалось и у пациента Б., имевшего перед назначением стартовой сахароснижающей терапии ИМТ, приближающегося к 40 кг/м2, традиционной cut-off для проведения бариатрической терапии ожирения. Между тем терапия ингибитором SGLT2, сопровождаемая дополнительным снижением суточного калоража [5], позволила уже через 3 мес терапии достигнуть снижения ИМТ с 39,8 до 38,0 кг/м2.
Важным в данном наблюдении стало снижение интенсивности исходно имевшихся у пациента глюкозо- и липотоксичности.
Улучшение качества гликемического контроля в обоих случаях сопровождалось снижением вариабельности гликемии и уровня гликированного гемоглобина. Это предопределяет снижение интенсивности оксидативного стресса, глюкозотоксичности и минимизацию риска присоединения микро- и макрососудистых осложнений СД2 [1, 2].
В обоих представленных наблюдениях использование инновационных сахароснижающих препаратов способствовало коррекции висцерального ожирения, основного фактора развития СД2 и других ассоциированных заболеваний [3]. Отмечено снижение ИМТ, ОТ как маркера диабетической дислипидемии, а также антропометрических индексов ОТ/ОБ, ОШ/ОГ, свидетельствующих об уменьшении степени выраженности абдоминального распределения жира. Между тем у обоих пациентов с СД2 и висцеральным ожирением на фоне проводимой терапии выявлена тенденция к снижению лептина и снижению выраженности лептинорезистентности, а также к повышению уровня адипонектина, что свидетельствует о восстановлении адипокинового ответа висцеральной жировой ткани.
У обоих пациентов на фоне инновационной сахароснижающей терапии отмечены коррекция дислипидемии, снижение индекса атерогенности и минимизация риска развития макрососудистых осложнений СД2.
Необходимо отметить, что использование инновационных сахароснижающих препаратов, в отличие от препаратов сульфонилмочевины, не способствовало снижению функциональной активности β-клеток и приводило к устранению имевшейся у пациентов высокой инсулинорезистентности.
Кроме того, использование препаратов, характеризуемых антигипергликемическим эффектом, способствовало улучшению качества жизни пациента с СД2 и висцеральным ожирением.
Ключевые моменты
- ■ У молодых пациентов с СД2 и висцеральным ожирением целесообразно использовать сахароснижающую терапию инновационными препаратами (инкретиномиметиками, ингибиторами SGLT2) в комбинации с метформином.
- ■ Улучшение качества гликемического контроля сопровождается сочетанным снижением массы тела, что создает предпосылки для устранения глюкозо- и липотоксичности.
- ■ Устранение окислительного стресса и снижение патологического цитокинового ответа жировой ткани позволяют предотвратить прогрессирование СД2 и присоединение его осложнений, что особенно актуально для молодых пациентов, страдающих СД2 и висцеральным ожирением.
Сведения об авторах
Владислав Михайлович Литвиненко
Должность: врач-эндокринолог
Место работы: Многопрофильный медицинский центр “123”, Сочи
: vml2010@mail.ru
Людмила Леонидовна Камынина
Cтепень/зв.: кандидат медицинских наук
Должность: врач-эндокринолог кафедры эндокринологии
Место работы: ФГБОУ ДПО “Российская медицинская академия последипломного образования” Минздрава России
: petrology@yandex.ru
МНН:   ТН:  
IV.E10-E14.E11 Инсулиннезависимый сахарный диабет
Литература
1. Аметов A.C, Камынина Л.Л., Ахмедова З.Г. Глюкозо- и липотоксичность – взаимоотягощающие факторы при сочетании сахарного диабета типа 2 и ожирения // Врач. 2014, № 4. С. 20-23.
2. Бабенко А.Ю., Красильникова Е.И., Лихоносов Н.П. и др. Влияние различных групп сахароснижающих препаратов на вариабельность гликемии у больных сахарным диабетом 2 типа // Сахарный диабет. 2014. № 4. С. 72-80.
3. Defronzo R.A. Banting Lecture. From the triumvirate to the ominous octet: a new paradigm for the treatment of type 2 diabetes mellitus // Diabetes. 2009. Vol. 58, N 4. 773-795.
4. Pi-Sunyer X; SCALE 0besity and Prediabetes Investigators. Liraglutide in weight management // N. Engl. J. Med. 2015. Vol. 373, N 18. P. 1781-1782.
5. Zhang Q., Dou J., Lu J. Combinational therapy with metformin and sodium-glucose cotransporter inhibitors in management of type 2 diabetes: systematic review and -analyses // Diabetes Res. Clin. Pract. 2014; Vol. 105, N 3. P. 313-321.
