Матриксные металлопротеиназы и сахарный диабет

Расшифровка механизмов развития фиброза почек при сахарном диабете (СД) остается одной из актуальных задач. Накопление компонентов внеклеточного матрикса в клубочках и интерстиции почек, составляющее основу развития фиброза, начинается еще до появления клинических признаков диабетической нефропатии (ДН) [1]. Установлено, что гипергликемия запускает синтез компонентов матрикса (коллагена, протеогликанов, фибронектина и др.) в различных участках нефрона. Этот эффект реализуется через протеинкиназу С, продукты гликирования, окислительный стресс, фиброгенные факторы роста и цитокины [2, 3]. В последние годы большее внимание уделяется нарушениям катаболизма матрикса в «диабетических» почках. Ведущая роль в этом процессе принадлежит ферментам из группы матриксных металлопротеиназ (ММП).
Цель настоящего обзора — обобщить данные о роли ММП и их ингибиторов в развитии фиброза почек при СД. Поиск данных осуществлен по базам данных Medline/Pubmed и eLibrary.
Общая характеристика ММП и их ингибиторов
ММП. Семейство белков MMП (матриксинов) относится к надсемейству цинковых металлопротеиназ. Большинство ММП синтезируется как препробелки и секретируется как проферменты. Активация проMMП осуществляется под действием плазмина или других MMП. Лишь отдельные представители металлопротеиназ, известные как MMП мембранного типа, секретируются в функционально активной форме [4].
В настоящее время известно более 30 MMП, объединенных в 6 различных групп (табл. 1). Они различаются молекулярной структурой, субстратной специфичностью и распределением в тканях. Наиболее изучены ферменты группы желатиназ — ММП-2 и ММП-9. Именно этим ферментам принадлежит ведущая роль в расщеплении коллагена IV типа и других компонентов матрикса в почках. ММП из группы коллагеназ, стромелизинов и матрилизинов также участвуют в расщеплении компонентов матрикса. ММП мембранного типа являются рецепторами и активаторами других ММП и обеспечивают протеолиз в околоклеточном пространстве. Группа «других» ММП включает разные пептидазы, которые секретируются единичными типами тканей и клеток или экспрессируются в особых ситуациях [5, 6].
Они различаются молекулярной структурой, субстратной специфичностью и распределением в тканях. Наиболее изучены ферменты группы желатиназ — ММП-2 и ММП-9. Именно этим ферментам принадлежит ведущая роль в расщеплении коллагена IV типа и других компонентов матрикса в почках. ММП из группы коллагеназ, стромелизинов и матрилизинов также участвуют в расщеплении компонентов матрикса. ММП мембранного типа являются рецепторами и активаторами других ММП и обеспечивают протеолиз в околоклеточном пространстве. Группа «других» ММП включает разные пептидазы, которые секретируются единичными типами тканей и клеток или экспрессируются в особых ситуациях [5, 6].
Ингибиторы ММП. Активность ММП в физиологических условиях регулируется рядом специфических ингибиторов, прежде всего тканевыми ингибиторами металлопротеиназ (ТИМП). В настоящее время хорошо изучены ТИМП-1, ТИМП-2, ТИМП-3 и ТИМП-4, которые различаются по специфическому действию на металлопротеиназы (табл. 2). Так, ТИМП-1 наиболее активно ингибирует ММP-9, в то время как ТИМП-2 подавляет активность ММП-2 [5].
Так, ТИМП-1 наиболее активно ингибирует ММP-9, в то время как ТИМП-2 подавляет активность ММП-2 [5].
Важным ингибитором ММП является ингибитор активатора плазминогена 1-го типа (ИАП-1), способный блокировать активаторы плазминогена тканевого и урокиназного типов и препятствовать образованию плазмина. Блокируя плазминообразование, ИАП-1 препятствует активации ММП. Другой механизм его подавляющего действия связан со способностью соединяться с активатором плазминогена урокиназного типа. Это предотвращает индуцированную урокиназой активацию МТ1-ММП, с помощью которой образуется функционально активная форма ММП-2 [4]. Активность ММП также может подавляться α2-макроглобулином, мегзином и другими ингибиторами [4, 7].
Экспрессия и функции MMП и их ингибиторов в почках
Экспрессия ММП и их ингибиторов. В физиологических условиях в почках синтезируются MMП-2, -3, -9, -13, -14, -15, -24, -25, -27 и -28, а также TIMP-1, -2 и -3. Эти молекулы экспрессируются многими типами клеток: мезангиальными, эндотелиальными, эпителиальными, гладкомышечными, фибробластами, однако их распределение не всегда равномерно. ММП-2, ММП-3, ММП-9 выявляются на протяжении всего нефрона. ММП-13 и ММП-14 экспрессируются в основном в клубочках. Преимущественно канальцевую локализацию имеет ММП-24.
ТИМП-1, ТИМП-2 выявляются в клубочках и канальцах [5, 6]. Преимущественно в мезангиоцитах синтезируется мегзин [7].
Функции ММП. Баланс между активностью ММП и их ингибиторов играет большую роль в эмбриональном развитии почек, в частности, в нефроногенезе. Во «взрослых» почках ММП участвуют в ремоделировании внеклеточного матрикса, что важно для поддержания структурной и функциональной целостности клубочков и интерстиция. ММП регулируют обмен матрикса, катализируя распад его компонентов, а также изменяя активность факторов роста и сигнальных молекул [8]. Кроме того, ММП и их ингибиторы участвуют в регуляции апоптоза и пролиферативной активности нефроцитов [9]. Нарушение баланса в системе ММП и их ингибиторов является одним из механизмов развития ряда острых и хронических заболеваний почек [5, 6, 9—11].
MMП и их ингибиторы в патогенезе ДН
Исследования in vitro. Проведенные в 90-х гг. прошлого века исследования [12, 13] показали, что высокий уровень глюкозы тормозит деградацию компонентов внеклеточного матрикса в мезангиоцитах. Отчасти этот эффект объясняется снижением активности ММП-2 [14]. Хотя в условиях избытка глюкозы экспрессия ММП-2 в мезангиоцитах может повышаться, процесс активации фермента замедлен [15]. Изменения синтеза ММП зависят от длительности воздействия глюкозы. Например, в подоцитах мыши высокая концентрация глюкозы увеличивает экспрессию и активность ММП-9 на 2—3-й день культивирования, однако после 5-го дня активность фермента снижается [16].
Снижение активности ММП при избытке глюкозы может быть результатом повышения продукции их ингибиторов. Показано, что в мезангиоцитах глюкоза повышает экспрессию TИMП-1 и TИMП-3 [17], а также ингибитора ММП мегзина [7]. В эпителиоцитах проксимальных канальцев повышенный уровень глюкозы стимулирует синтез ТИМП-2 и снижает синтез и активность ММП-2 [18]. В фибробластах коркового вещества почки избыток глюкозы повышает экспрессию ИАП-1 [19].
Влияние гипергликемии на синтез ММП и их ингибиторов усугубляют продукты гликирования и факторы роста. Поздние продукты гликирования снижают экспрессию MMП-7 в мезангиоцитах. Этот эффект блокируют антитела к трансформирующему фактору роста β (ТФР-β) [20]. Продукты гликирования повышают экспрессию генов ТИМП-3 и ИАП-1 [21]. В свою очередь ИАП-1 усиливает сигнал ТФР-β [22]. Последний снижает синтез ММП-2 и повышает синтез ТИМП-2 в мезангиоцитах [14]. В канальцевых клетках ТФР-β и ангиотензин II оказывают такой же эффект [18]. Тормозящее влияние глюкозы и ТФР-β на катаболизм матрикса в мезангиоцитах резко усиливает фактор роста соединительной ткани (ФРСТ), повышающий экспрессию TИMП-1 и TИMП-3 [17]. Инсулиноподобный фактор роста 1 (ИФР-1) снижает активность ММП-2 в мезангиоцитах [23].
Гликирование компонентов матрикса при диабете тормозит их деградацию. Показано, что накопление продуктов гликирования в мезангии клубочков почти вдвое снижает активность ММП, секретируемых мезангиальными клетками [15]. Гликированный коллаген снижает продукцию мезангиоцитами ММР-2 и повышает продукцию ТИМП-1 [24].
Исследования на моделях СД у животных. В почках крыс со стрептозотоциновым СД (модель СД 1-го типа у человека) обнаружено снижение экспрессии ММП-7 [20] и стромелизина-1 (ММП-3) [25]. Экспрессия ММП-2 возрастает, но активность фермента снижается [26]. Обнаружена связь между экспрессией белка Ets-1 — активатора генов ММП и экспрессией ММП-2 [27]. Экспрессия ММП-9 оказалась повышенной через 8 нед после индукции стрептозотоцинового СД [28] и сниженной через 6 мес после начала диабета [26]. У мышей линии db/db (модель СД 2-го типа) на ранних стадиях нефропатии обнаружено снижение экспрессии α- и β-меприна — металлопротеиназ щеточной каймы проксимальной канальцев. У мышей линии db/db с выраженной нефропатией и у крыс со стрептозотоционовым СД содержание α-меприна отрицательно коррелировало с выраженностью поражения почек [29]. На другой модели СД 2-го типа (мыши линии Kkay), обнаружено повышение содержания и экспрессии ММП-9 в клубочках [30].
Интересно, что в почках плодов крыс с СД значительно снижена активность ММП-2 и ММП-9, а экспрессия ТФР-β и ФРСТ, напротив, повышена. Это может способствовать нарушениям нефроногенеза и предопределять повышенную склонность к развитию патологии почек после рождения [31].
Синтез ингибиторов ММП в почках при диабете увеличивается. У крыс со стрептозотоциновым СД обнаружено увеличение экспрессии ТИМП-1 [25, 26] и ТИМП-2 [18, 27]. Повышение экспрессии ТИМП-2 в клубочках и канальцах почек положительно коррелировало с альбуминурией и отрицательно — с экспрессией ММП-2 [18]. Соотношение ММП-2/ТИМП-2 в клубочках и тубулоинтерстиции в свою очередь было обратно связано с содержанием коллагена IV типа [27].
Изменения синтеза ИАП-1 в почках при диабете не изучены, однако они могут иметь важное значение в развитии ДН. Показано, что нокаут гена ИАП-1 у мышей приводит к уменьшению выраженности диабетического гломерулосклероза [32]. У мышей с отсутствием гена ИАП-1 не увеличивается альбуминурия и ниже уровень ТФР-β в корковом веществе почек по сравнению с животными с диабетом и сохранным синтезом ИАП-1 [22].
Исследования у пациентов с СД. Данные об изменениях активности ММП и их ингибиторов у больных с ДН фрагментарны. В почках пациентов с СД 2-го типа выявлено снижение экспрессии ММП-2 [33], ММП-7 [20] и повышение экспрессии МТ5-ММП [34]. Некоторые исследователи зафиксировали связь между изменениями активности ММП и их ингибиторов с почечным фиброзом. T. Cornish и соавт. [35] выявили снижение содержания MMП-1 и TИMП-1 у больных СД со скоростью клубочковой фильтрации ниже 30 мл/мин и отметили обратную связь между интенсивностью окрашивания на ММП-1 и выраженностью фиброза клубочков. По данным D. Suzuki и соавт. [36], экспрессия ММП-3 и ТИМП-1 в клубочках почек наиболее высока у больных СД с начальной степенью расширения мезангия; по мере развития гломерулосклероза она снижается; экспрессия ММП-3 и ТИМП-1 в тубулоинтерстиции коррелирует с выраженностью интерстициального фиброза.
Таким образом, результаты экспериментов in vitro, in vivo на моделях СД, а также исследования у больных с ДН свидетельствуют о сложных нарушениях регуляции синтеза ММП и их ингибиторов в почках в условиях гипергликемии. Некоторую противоречивость данных можно объяснить многокомпонентностью системы катаболизма внеклеточного матрикса, сложностью ее регуляции, возможностью фазных изменений на разных стадиях поражения почек. Вместе с тем не вызывает сомнений, что дисбаланс между синтезом и активностью ММП и их ингибиторов способствует нарушениям процессов ремоделирования матрикса и развитию фиброза клубочков и тубулоинтерстиция почек при СД (рис. 1). Рисунок 1. Механизмы подавления катаболизма компонентов ВКМ в почках при СД. ММП — металлопротеиназы, ТФР-β — трансформирующий фактор роста β, ФРСТ — фактор роста соединительной ткани, ИФР-1 — инсулиноподобный фактор роста-1, ВКМ — внеклеточный матрикс.
Рисунок 1. Механизмы подавления катаболизма компонентов ВКМ в почках при СД. ММП — металлопротеиназы, ТФР-β — трансформирующий фактор роста β, ФРСТ — фактор роста соединительной ткани, ИФР-1 — инсулиноподобный фактор роста-1, ВКМ — внеклеточный матрикс.
MMP и их ингибиторы как потенциальные диагностические маркеры ДН
Содержание ММП и их ингибиторов в крови. В ряде исследований зафиксировано повышение содержания ММП в плазме у больных СД. В частности, найдено повышение уровня ММП-2 при СД 1-го типа [37], ММП-9 при СД 2-го типа [38]. В последнем случае повышение уровня ММП-9 оказалось предиктором микроальбуминурии. Соотношение MMП-9/TИMП-1 и MMП-2/TИMП-2 у больных СД2 с нефропатией было вдвое выше, чем у пациентов с нормальной функцией почек [39]. Однако ММП могут поступать в кровоток не только из почек, но и из других органов, в частности, из стенок сосудов. У больных с ДН найдено увеличение содержания ММП-2 и особенно ММП-9 в стенках артерий [40], установлена связь между повышением ММП-2 в крови, протеинурией и выраженностью атеросклероза сонных артерий [41].
Экскреция ММП и их ингибиторов с мочой. О нарушениях синтеза ММП и их ингибиторов при патологии почек можно судить по изменениям экскреции этих веществ с мочой. У больных СД1 повышение экскреции ММП-2 связано с развитием микроальбуминурии [37]. У больных СД2 найдена связь между экскрецией ММП-9, альбуминурией [42, 43] и функцией почек [43]. Имеются данные о повышении экскреции MMП-14 у пациентов с ДН [44]. Показано, что экскреция ТИМП-1 при ДН коррелирует с альбуминурией и выраженностью поражения клубочков [45].
Таким образом, определение содержания ММП и их ингибиторов в плазме и моче является новым подходом к оценке процессов ремоделирования внеклеточного матрикса при СД. Значение различных ММП и их ингибиторов как потенциальных маркеров фиброза почек при ДН необходимо доказать в клинических исследованиях с морфологическим контролем.
MMP и их ингибиторы как новые мишени для нефропротекции
Сахарснижающие препараты. Устранение гипергликемии, по-видимому, нормализует катаболизм матрикса при СД. Показано, что инсулин повышает способность мезангиоцитов расщеплять компоненты внеклеточного матрикса, вероятно, за счет активации ММП-2 [46]. Инсулинотерапия предупреждает повышение экспрессии ТИМП-1 и снижение деградации матрикса в почечных клубочках у крыс с экспериментальным СД [17].
Тиазолидинедионы также влияют на катаболизм матрикса. Пиоглитазон снижает активность MMП-9 и секрецию TИMП-1 и TИMП-2 в культивируемых фибробластах [47]. У крыс со стрептозотоциновым СД троглитазон тормозит синтез ИАП-1 в почках [48]. Известно, что тиазолидиндионы оказывают антиальбуминурический эффект у больных СД2 [49]. Однако способность тиазолидиндионов тормозить развитие фиброза почек при СД остается недоказанной.
Блокаторы ренин-ангиотензиновой системы. Периндоприл уменьшает степень подавления активности ММП-2 и ММП-9 и снижает синтез ТИМП-1 у крыс со стрептозотоциновым СД [26]. Эналаприл препятствует снижению экспрессии α- и β-меприна (металлопротеиназы щеточной каймы проксимальных канальцев) и уменьшает экскрецию α-меприна с мочой у мышей с СД линии db/db [29]. Лозартан предотвращает повышение экспрессии TIMП-2 в почках крыс с экспериментальным СД [50].
Селективные модуляторы активности ММП. Выяснение роли ММП и их ингибиторов в развитии ДН открывает перспективы направленного воздействия на эти молекулы с целью нефропротекции. Показано, что инсерция гена ММП-1 предупреждает развитие фиброза почек у мышей со стрептозотоциновым СД [51]. In vitro антитела к TИMП-1 в значительной степени блокируют подавляющие эффекты глюкозы на деградацию компонентов матрикса в мезангиоцитах [17]. Таким образом, направленная активация ММП и/или нейтрализация их ингибиторов может оказаться перспективным подходом к лечению ДН.
Дисбаланс между активностью ММП и их ингибиторов играет важную роль в развитии ДН. Сниженная активность ММП и/или повышенный синтез ингибиторов ММП (ТИМП, ИАП-1 и др.) в нефроцитах способствует уменьшению катаболизма компонентов внеклеточного матрикса и создает биохимическую основу для развития фиброза клубочков и интерстиция почек. Гипергликемия играет ведущую роль в развитии нарушений катаболизма матрикса при СД. Дальнейшее изучение изменений активности ММП и их ингибиторов открывает перспективу разработки новых методов диагностики и лечения диабетического поражения почек.
Работа выполнена в рамках научного проекта, поддержанного грантом Президента Российской Федерации по государственной поддержке молодых российских ученых — докторов наук (грант МД-5725.2010.7).
В статье представлены результаты оригинального исследования, посвященного оценке связи концентрации матриксных металлопротеиназ в сыворотке крови с показателями гликемического статуса больных инфарктом миокарда в зависимости от наличия сахарного диабета 2 типа.
Несмотря на то, что за последние несколько лет в большинстве развитых стран отмечается снижение смертности и инвалидизации от сердечно-сосудистых заболеваний (ССЗ), их вклад в статистику заболеваемости остается превалирующим [1]. Известно, что сахарный диабет 2 типа (CД 2) ассоциируется с высоким сердечно-сосудистым риском: инфаркта миокарда (ИМ), инсульта и внезапной сердечной смерти [2, 3]. Более того, около 20–25% пациентов с острым коронарным синдромом (ОКС) имеют ранее или впервые выявленный СД 2 [4]. Пациенты с ОКС в сочетании с СД 2 имеют более высокий риск неблагоприятных исходов, таких как смерть (8,5% против 5,4%), рецидивирующий ИМ или сердечная недостаточность как в раннем, так и в отдаленном периоде наблюдения. Кроме того, в ряде ранее проведенных исследований определяется высокая концентрация биологических маркеров (адипонектина, тропонина, C-реактивного белка, матриксных металлопротеиназ (MMП)-1, -3, -9, N-концевого прогормона натрийуретического пептида B-типа (NT-proBNP) и др.), а также снижение активности тканевого ингибитора матриксных металлопротеиназ-1 (ТИМП-1) у пациентов с ОКС в сочетании с СД 2 [5].
Использование новых биологических маркеров в диагностике и лечении острых и хронических форм ишемической болезни сердца (ИБС) активно изучается, а данные, полученные в ходе исследований, позволяют расширить понимание тонких механизмов патофизиологии ССЗ. Однако возможности клинического использования новых инструментов ограничены. С учетом высокого риска развития осложнений в группе пациентов с СД 2 актуален поиск новых терапевтических стратегий, направленных на ограничение воспаления в стенке сосудов и снижение уровней воспалительных маркеров, а также ММП в сыворотке крови. Однако до сих пор отсутствуют однозначные данные о влиянии СД 2 на экспрессию ММП.
Цель исследования — оценить связь ММП-1, -3, -9 с показателями гликемического статуса больных инфарктом миокарда с подъемом сегмента ST (ИМпST) в зависимости от наличия СД 2.
Материал и методы
В проспективное когортное исследование последовательно включены 175 пациентов с диагнозом ИМпST. Диагноз ИМ был подтвержден согласно критериям Российского кардиологического общества: начало симптомов не более чем за 48 ч до госпитализации; симптомы, заставляющие предположить ИМ (ангинозная боль или ее эквивалент ≥ 20 мин, одышка, синкопальное состояние, остановка кровообращения и др.); электрокардиографические изменения, подъем или снижение сегмента ST ≥1 мм в двух смежных отведениях; предположительно новая полная блокада левой ножки пучка Гиса; формирование патологического зубца Q; выявление кардиоспецифических маркеров некроза миокарда (общая креатинфосфокиназа — КФК и ее фракция МВ, тропонины I и Т). Критериями исключения были возраст пациента моложе 18 лет, а также любые клинически значимые состояния, способные изменять уровень изучаемых биохимических маркеров (онкологические и системные заболевания; наличие почечной, гепатоцеллюлярной недостаточности; острые инфекционные заболевания или обострение хронических; психические заболевания, а также смерть больного в 1-е сут после госпитализации).
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинкской декларации.
У всех пациентов при поступлении в стационар и в динамике на 12-е сут от начала заболевания проводилось определение концентраций ММП-1, -3 и -9 в сыворотке крови методом количественного твердофазного иммуноферментного анализа с помощью лабораторных наборов BCM Diagnostics (США). Измерение уровня HbA1c проводилось быстрым ионообменным методом на 5-е сут госпитализации. Уровень глюкозы в сыворотке венозной крови измеряли при поступлении пациента в стационар, а также на 8-е сут госпитализации (натощак) глюкозооксидазным методом с использованием реактивов «Глюкоза ФС «ДДС». Статистическую обработку данных исследования осуществляли с помощью программы Statistica версии 7.0 (StatSoft, Inc, США). Применяли стандартные методы описательной статистики. Полученные данные представлены в виде медианы и интерквартильного размаха (25-й процентиль; 75-й процентиль). При распределении данных, отличном от нормального, две независимые группы по количественному признаку сравнивали с помощью U-критерия Манна — Уитни [6].
Описание группы исследования было опубликовано ранее [6].
Средний возраст пациентов в общей группе больных ИМпST составил 61,3 (33; 89) года. Среди 175 больных было 116 (66,3%) мужчин. Наиболее часто у пациентов в анамнезе были следующие заболевания: эссенциальная артериальная гипертензия (АГ) (76%) и стенокардия напряжения (53,7%), а также хроническая сердечная недостаточность различных функциональных классов (50,3%) (табл. 1).
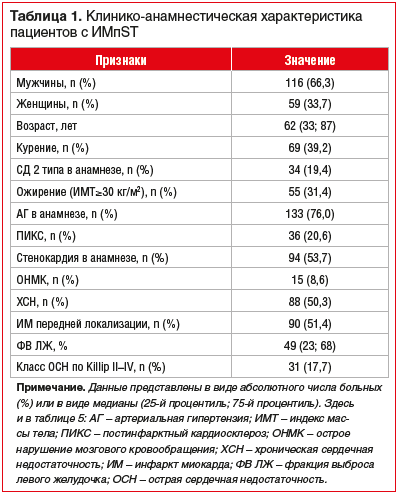
Продолжительность пребывания больных в стационаре составила 14 (12; 16) дней.
Группа контроля была представлена 87 здоровыми добровольцами в возрасте 59 (43; 68) лет, у которых ранее не диагностированы АГ, ИБС, СД, а также без клинически значимой сопутствующей патологии, среди них было 52 (59,8%) мужчины и 35 (40,2%) женщин.
В зависимости от наличия ранее диагностированного и установленного диагноза СД 2 (в соответствии с критериями Всемирной организации здравоохранения 2011 г.) [7]
пациенты были распределены на 2 группы с наличием и отсутствием СД 2. У всех участников исследования изучали концентрации ММП-1, -3 и -9 в сыворотке крови. Группу больных ИМпST в сочетании с СД 2 составили 34 (18,2%) пациента: 25 (73,53%) мужчин и 9 (26,47%) женщин в возрасте 69 (43; 81) лет. По наличию сопутствующих заболеваний (хронической обструктивной болезни легких, хронической почечной недостаточности, язвенной болезни) достоверных различий в группах выявлено не было. При сравнительном анализе клинико-анамнестических данных группы больных ИМпST в зависимости от наличия СД 2 определено, что при СД 2 достоверно чаще выявляются такие факторы сердечно-сосудистого риска, как АГ (91,2% и 72,3%) и ожирение (52,9% и 26,2%). Кроме того, медиана возраста пациентов с ИМпST в сочетании с СД 2 достоверно превышала медиану возраста больных ИМпST без СД 2 (р=0,02). Также у пациентов с ИМпST и СД 2 достоверно чаще наблюдались ОНМК в анамнезе (20,6% и 5,7%). Вместе с тем по другим клинико-анамнестическим характеристикам достоверных различий между группами не было (табл. 2).
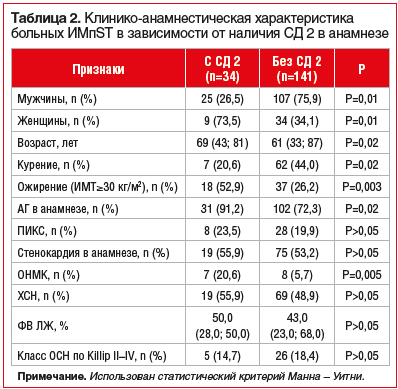
При оценке объема терапии на догоспитальном этапе было определено, что большинство (61,8% (n=21)) пациентов с ИМпST в сочетании с СД 2 принимали пероральные гипогликемические препараты. При этом основными на догоспитальном этапе были метформин и производные сульфонилмочевины. Комбинированную пероральную сахароснижающую терапию в сочетании с инсулинами получали 4 пациента (12,8%), 9 (26,4%) больных находились только на гипоуглеводной диете (табл. 3).

Результаты исследования
При анализе концентраций ММП в сыворотке крови установлено, что медианные значения этих показателей как в 1-е, так и на 12-е сут ИМпST превышают значения аналогичных маркеров в группе здоровых добровольцев. Определено, что концентрации ММП-1 в 1,7 раза в 1-е сут и в 2,7 раза на 12-е сут превышают значения в контрольной группе; ММП-3 — в 1,2 раза (1-е сут) и в 1,4 раза (12-е сут); ММП-9 — в 1,3 (1-е сут) и в 1,4 раза (12-е сут) соответственно. Было установлено, что значения всех изучаемых ММП в сыворотке крови на 12-е сут ИМпST оказались в 1,1–1,6 раза (р<0,05) выше по сравнению с показателями в 1-е сут заболевания (табл. 4).

Таким образом, у пациентов с ИМпST отмечаются достоверно более высокие значения ММП-1, -3 и -9 на протяжении всего госпитального периода заболевания по сравнению со значениями, полученными в контрольной группе. При этом для всех анализируемых МПП характерно повышение их концентрации к 12-м сут госпитального периода.
Определено, что в группе пациентов с ИМпST в сочетании с СД 2 при поступлении в стационар закономерно наблюдаются достоверно более высокие концентрации глюкозы (р=0,006), HbA1c (р=0,03), а также глюкозы крови натощак (р=0,0001), чем в группе больных ИМпST без СД 2 (табл. 5).
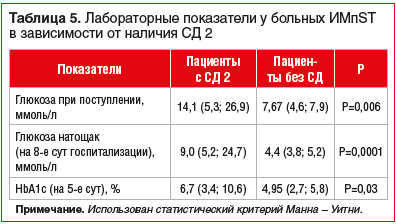
В группе больных ИМпST с СД 2 концентрация ММП-1
в 1-е сут госпитализации оказалась в 1,53 раза (р=0,02), на 12-е сут — в 2,35 раза (р=0,001) выше соответствующих показателей у больных ИМпST без СД 2. Концентрация ММП-9 в 1-е сут у пациентов с ИМпST в сочетании с СД 2 в 1,3 раза превышала концентрации у больных без СД 2 (р=0,0001) (табл. 6).
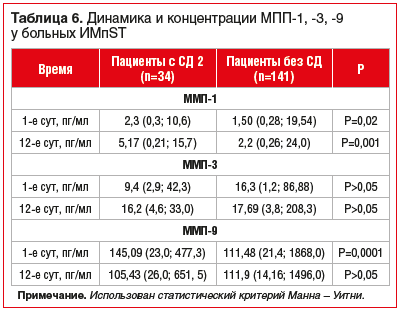
Анализ уровней ММП в зависимости от сахароснижающей терапии выявил следующие закономерности: у пациентов, которые находились только на гипоуглеводной диете, концентрации ММП-3 в 1-е сут пребывания в стационаре в 1,9 раза (р=0,02), на 12-е сут — в 1,3 раза (р=0,04) превышали концентрации ММП у пациентов, которые принимали пероральные сахароснижающие препараты.
Вместе с тем в группе пациентов, которые находились на комбинированной сахароснижающей терапии с инсулином на догоспитальном этапе, наблюдались превалирующие концентрации ММП-3 (1-е и 12-е сут) по сравнению с пациентами, принимавшими пероральные противодиабетические препараты (табл. 7).
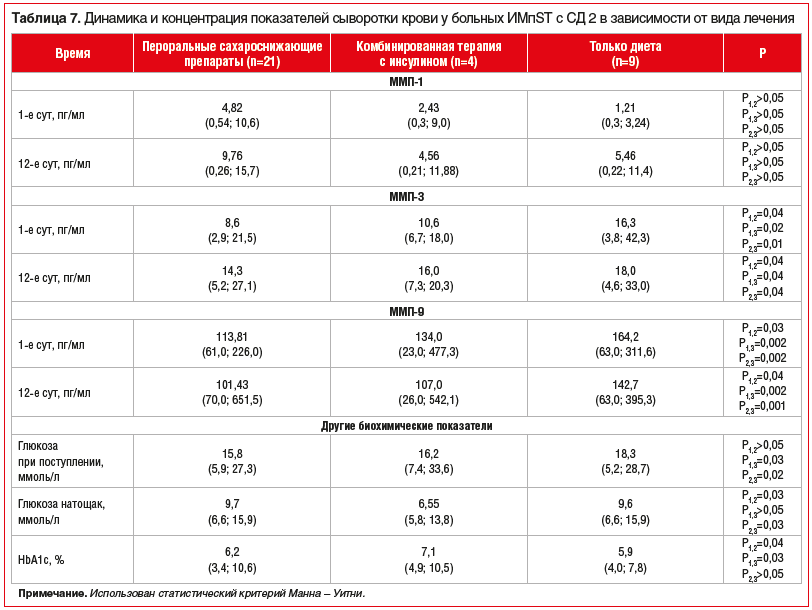
Аналогичные тенденции выявлены для ММП-9, концентрация которой также была выше у больных, которые находились только на гипоуглеводной диете (p<0,05). Достоверных различий между 3 группами по уровню ММП-1 определено не было. При этом максимальная гликемия при поступлении регистрировалась также в группе пациентов, которые на догоспитальном этапе находились только на гипоуглеводной диете, — 18,3 (5,2; 28,7) ммоль/л. Однако при оценке глюкозы крови натощак ее минимальные концентрации регистрировались в группе больных с комбинированной терапией.
Полученные результаты позволяют предположить, что концентрация ММП зависит не от вида проводимой терапии, а от компенсации СД 2. Проведен корреляционный анализ между значениями HbA1c и ММП-1, -3, -9 в общей группе пациентов, по результатам которого определена достоверная прямая связь между уровнями HbA1с и ММП-3 (1-е сут: r=0,29, р=0,03; 12-е сут: r=0,38, р=0,007), а также между уровнями HbA1с и ММП-9 (1-е сут: r=0,34, р=0,02; 12-е сут: r=0,41, р=0,01). При проведении корреляционного анализа в группах пациентов в зависимости от наличия СД выявлено, что имеется аналогичная прямая корреляционная связь между уровнями HbA1с и ММП-3: группа с СД — 1-е сут: r=0,34, р=0,02; 12-е сут: r=0,37, р=0,005; группа без СД — 1-е сут: r=0,46, р=0,001; 12-е сут: r=0,28, р=0,04, а также между уровнями HbA1с и ММП-9: группа с СД — 1-е сут: r=0,37, р=0,03; 12-е сут: r=0,4, р=0,01; группа без СД — 1-е сут: r=0,29, р=0,04; 12-е сут: r=0,38, р=0,02.
Определено, что уровень глюкозы крови (при поступлении) также коррелирует с уровнем ММП-3 (1-е сут: r=0,45, р=0,001; 12-е сут: r=0,39, р=0,001) и ММП-9 (1-е сут: r=0,43, р=0,04; 12-е сут: r=0,4, р=0,03). Для ММП-1 статистически значимых связей как с концентрацией глюкозы крови, так и со значениями HbA1с выявлено не было.
Обсуждение результатов
В исследованиях in vitro и in vivo подтвержден тот факт, что некоторые ММП играют ведущую роль в патогенезе дестабилизации атеросклеротической бляшки с последующим ее тромбозом и, как следствие, манифестацией ОКС [8, 9].
При проведении экспериментальных и клинических исследований было установлено, что после ИМ экспрессия MMП повышается уже через несколько часов от начала заболевания [9]. Так, по данным R. Eckart и C. Uyehara [10], у больных ОКС значительно повышаются плазменные концентрации ММП-1, -2, -9. В ряде экспериментальных и клинических исследований также показано, что продукция ММП-3 и ММП-9 существенно возрастает в течение 1-х сут от начала ИМ и сохраняется в избыточном титре на протяжении всего острого периода ИМ [11, 12]. В работах H. Kai [13] и E. Armstrong [14] доказано достоверное повышение концентраций ММП-1, -2, -9 к 7–14-м сут течения ИМпST. Представленные данные согласуются с результатами настоящего исследования, в котором определено, что пациенты с ИМпST характеризуются достоверно более высокими значениями ММП-1, -3 и -9 на протяжении всего госпитального периода заболевания по сравнению с группой здоровых лиц соответствующего возраста. При этом для всех анализируемых ММП характерно повышение их концентрации к 12-м сут госпитального периода.
Активно обсуждается возможность использования некоторых ММП в качестве независимых предикторов не только дестабилизации атеросклеротической бляшки, но и маркеров неблагоприятного течения раннего и отдаленного периодов ИМ [14]. Одной из возможных причин повышенной экспрессии ММП у пациентов без ИБС и с ИМ является наличие сопутствующего СД 2. В немногочисленных работах, посвященных изучению ММП у пациентов с ИМ в сочетании с СД 2, получены неоднозначные результаты в отношении ассоциации гликемического статуса пациента с концентрацией ММП.
Данный факт обусловливает актуальность изучения активности ММП у больных ИМ в сочетании с хронической гипергликемией при СД 2 и при «стрессовой» гипергликемии, которая связана с резким повышением секреции катехоламинов, глюкагона, кортизола, гормона роста, активностью креатинкиназы и увеличением площади некроза миокарда [15].В некоторых исследованиях отмечено, что более чем у половины больных без СД 2 в остром периоде ИМ отмечено повышение уровня глюкозы крови [16].
Существует мнение о том, что не столько сам факт СД 2, сколько наличие хронической гипергликемии является индуцирующим фактором гиперпродукции ММП. В крупных проспективных исследованиях доказано, что прогноз больных ИМ без СД 2 в анамнезе, но с гликемией в остром периоде более 11,1 ммоль/л не отличается от прогноза больных с ранее диагностированным СД 2 [17]. Метаболические нарушения в случае гипергликемии формируют дополнительные факторы риска осложнений со стороны сердечно-сосудистой системы, что приводит к увеличению смертности и негативно сказывается на прогнозе [17, 18]. В своем исследовании A.K. Death [19] продемонстрировал влияние гипергликемии на экспрессию ММП-1 и -2 в эндотелиальных клетках и ММР-9 в макрофагах. В ранее проведенных исследованиях определено, что СД 2 является независимым предиктором неблагоприятного прогноза течения ближайшего и отдаленного периодов у пациентов с ИМ [17]. S.S. Signorelli et al. [20] в своем исследовании наблюдали более высокие концентрации ММП-2 и -9 в сыворотке крови пациентов с СД 2. При сравнении результатов с аналогичными значениями контрольной группы было установлено, что плазменные уровни ММП-2 были выше у пациентов с СД, в то же время у пациентов без СД достоверных различий не получено. Напротив, в работе A. Papazafiropoulou et al. [21] достоверных различий между концентрациями ММП-2 и -9 у пациентов с СД 2 и без него получено не было. В исследовании приняли участие 120 пациентов, 60 из которых имели СД 2. Плазменные концентрации ММП-2 и -9 не различались в группе пациентов с СД и без него.
Другим доказательством патологических эффектов гипергликемии и экспрессии ММП при ИМ на фоне СД 2 являются данные экспериментального исследования L.K. Bhatt и A. Veeranjaneyulu [22]. Авторы предположили, что гипергликемия при СД может увеличивать экспрессию ММП-2 и -9 при ИМ. С этой целью у самцов крыс линии Вистар в течение 3 нед. провоцировали развитие СД. Затем в конце 6-й нед. наблюдения путем лигирования передней нисходящей коронарной артерии в течение 30 мин вызывали ишемическое повреждение миокарда. При анализе полученных данных оказалось, что частота аритмии, смертность, уровень коллагена и уровень ММП-2 и -9 были значительно выше в группе СД по сравнению с крысами без СД. В исследовании А. Dominguez-Rodrigue [23] доказано, что повышенные концентрации ММП-9 у больных ИМпST в сочетании с СД 2
являются неблагоприятным фактором развития госпитальных осложнений. В данное исследование было включено 120 пациентов с ИМпST, из которых 48 имели в анамнезе СД 2. Сывороточные уровни ММП-9 были измерены на 1-е сут госпитализации. Первичными конечными точками исследования были сердечная смерть в стационаре и кардиогенный шок. Определено, что средние сывороточные значения ММП-9 были значительно выше среди пациентов с СД по сравнению с пациентами без СД (р<0,0001). При проведении многофакторного регрессионного анализа определено, что СД и повышение уровня ММП-9 являются независимыми предикторами конечных точек (смерти и кардиогенного шока) в раннем периоде ИМпST.
Следует отметить, что ранее авторами настоящей статьи уже была показана высокая клинико-прогностическая значимость различных факторов воспаления у пациентов с ИМ с проявлением мультифокального атеросклероза или СД [24, 25].
Заключение
В настоящем исследовании доказано, что в группе пациентов с СД 2 в госпитальном периоде ИМпST регистрируются достоверно более высокие концентрации ММП-3 и -9. Определена статистически значимая корреляционная связь в 1-е сут ИМпST между уровнем глюкозы крови, с одной стороны, и уровнями ММП-3, -9, с другой, что свидетельствует о возможном влиянии гипергликемии на экспрессию ММП независимо от наличия в анамнезе СД 2. Кроме того, полученные данные о связи HbA1c с концентрацией ММП-3, -9 могут говорить о том, что уровни ММП потенциально зависят от степени компенсации СД.
Тем не менее доказательств того, что концентрация MMП у больных СД 2 зеркально отражает степень тяжести процесса, нет, т. к. повышенная деградация матрикса может быть проявлением не только хронической гипергликемии, но и других процессов в различных тканях, связанных непосредственно как с течением острого ИМ, так и с СД. Данный факт диктует необходимость дальнейшего изучения потенциального прогностического значения высоких концентраций ММП у больных СД 2.
