Мочевина для больных сахарным диабетом

Синдром диабетической стопы является одним из поздних осложнений сахарного диабета (СД). Диабетические язвы стоп плохо поддаются лечению, часто рецидивируют и могут приводить к ампутациям нижних конечностей у больных СД. В основе образования язв лежит сухость кожи стоп вследствие нейропатии. Поэтому коррекция сухости кожи стоп является важным фактором профилактики диабетических язв стопы. В статье приведены результаты исследования эффективности препарата Бальзамед® интенсив, содержащего мочевину, в отношении нормализации состояния кожи стоп у 45 пациентов с СД 1 и 2 типа и ксерозом стоп по сравнению с увлажняющим кремом на основе глицерина (препарат сравнения). Показано, что Бальзамед® интенсив более эффективно уменьшает сухость кожи и хорошо переносится пациентами.
![Таблица 1. Шкала оценки сухости кожи [12]](https://umedp.ru/upload/resize_cache/iblock/169/195_350_1/16941e2036641e7c87625a68265f4622.jpg)
Таблица 1. Шкала оценки сухости кожи [12]
Таблица 2. Характеристика пациентов первой и второй групп
Таблица 3. Состояние кожи стоп в двух группах на фоне проводимой терапии (оценка по шкале Exelbert), баллы
Таблица 4. Оценка эффекта лечения Бальзамедом интенсив и препаратом сравнения через месяц исследования
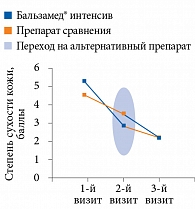
Рисунок. Изменение сухости кожи стоп на фоне проводимой терапии (оценка по шкале Exelbert)
Синдром диабетической стопы (СДС) является одним из поздних осложнений сахарного диабета (СД). СДС диагностируется у 4-10% пациентов с СД. При этом около 85% поражений составляют трофические язвы стоп [1]. Несмотря на успехи в изучении патогенеза заболевания и его осложнений, диабетические язвы стоп плохо поддаются лечению, часто рецидивируют и могут приводить к ампутациям нижних конечностей у больных СД [2].
Более редкими поражениями являются абсцессы, флегмоны, остеомиелит, тендовагинит, гнойный артрит и другие процессы, развивающиеся либо как осложнение трофической язвы, либо первично. К СДС относится негнойное деструктивное поражение скелета конечностей – диабетическая остеоартропатия, которая является одним из осложнений диабетической нейропатии, а также последствия перенесенных ампутаций в пределах нижних конечностей, выраженные деформации стоп и др.
Основными патогенетическими механизмами, приводящими к поражению нижних конечностей при СД, являются диабетическая полинейропатия и макроангиопатия. Исходя из патогенеза была предложена следующая классификация СДС:
- нейропатическая форма;
- нейроишемическая форма;
- ишемическая форма.
У 50-70% пациентов с СДС наблюдается нейропатическая форма, у 25-45% – нейроишемическая и 5-10% – ишемическая.
Поскольку на стопы приходится повышенная нагрузка, они травмируются чаще других частей тела, в особенности при СД. Из-за сниженной иннервации больные не замечают мелких травм: потертостей, ушибов, трещин, порезов. А из-за связанных с СД нарушений кровообращения снижается защитная функция тканей, и самая незначительная травма способна привести к образованию долго не заживающей раны, которая при попадании инфекции превращается в язву.
Нарушение целостности кожи стопы происходит по разным причинам: однократное механическое (травматизация кожи при подстригании ногтей, срезании мозоли и др.) или термическое (ожог) повреждение из-за нарушения болевой и температурной чувствительности, сдавление тесной обувью (пациент может не ощущать дискомфорт из-за диабетической нейропатии), перегрузка определенных участков стопы из-за ее деформации. На этих участках образуются локальные гиперкератозы, которые в свою очередь увеличивают давление на кожу данных участков при ходьбе. Под мозолью происходит кровоизлияние с последующим нагноением и формированием подкожного или внутрикожного абсцесса.
У большинства пациентов с СД процесс образования язвы начинается с трещины сухой кожи. Сухость кожи, или ксероз, приводит к образованию трещин огрубевшей кожи, которые являются воротами для инфекции, особенно при язвах в пяточной области у пациентов с нарушениями артериального кровотока (ишемией конечности). Ксероз стоп является следствием как общей дегидратации на фоне декомпенсации СД, так и автономной (вегетативной) диабетической нейропатии, которая нарушает иннервацию и регуляцию потовых желез. Следовательно, ксероз кожи стоп не косметическая проблема, а звено патогенеза СДС.
Главная причина патологической сухости кожи стоп при СД – нарушение функции потовых желез кожи стопы вследствие диабетической нейропатии [3]. Зона нарушений потоотделения обычно расположена дистально и имеет форму носков (со временем распространяясь все выше), а проксимальнее от этой зоны потоотделение может быть, наоборот, увеличено. Иногда зоны нарушенного потоотделения располагаются пятнами. Ангидроз стоп приводит к образованию трещин на коже. Особенно это опасно у пациентов с ишемией конечности, которая является дополнительным фактором истончения кожи и при которой резко нарушается способность кожи к заживлению мелких повреждений.
Для диагностики нарушений потоотделения на стопах можно использовать новый инструмент – Neuropad, который представляет собой нейроиндикатор в виде пластыря. Пластырь меняет цвет, если кожа влажная. С его помощью можно определить наличие или отсутствие потоотделения на коже стоп. Это самый простой скрининговый тест (пациент может проводить его самостоятельно) для раннего выявления диабетической нейропатии. Результаты данного диагностического теста хорошо коррелируют с другими методами выявления диабетической полинейропатии [4, 5].
Установлено, что сухость кожи стоп более выражена у пациентов с СД и язвами стоп, нежели у пациентов с СД, не имеющих язв [6]. Если полученные результаты будут подтверждены в проспективном исследовании, сухость кожи следует включить в список диагностических признаков группы повышенного риска СДС (язвенных дефектов) [6].
Необходимо помнить, что устранение сухости кожи может и не снизить риск образования язв, так как сухость – это следствие нейропатии (известного патогенетического фактора диабетических язв), а не ее причина.
У большинства пациентов сухость кожи стоп под действием обычных косметических средств устраняется слишком медленно. Кроме того, традиционно применяемые жирные кремы создают неприятное ощущение на коже, что зачастую приводит к отказу пациентов от местного лечения ксероза. Поэтому необходимы препараты, быстро и эффективно устраняющие сухость кожи и формирующиеся трещины. Такие лекарственные средства уже появились на фармацевтическом рынке. Это препараты, содержащие мочевину. Они не только смягчают кожу, но и восполняют дефицит воды в роговом слое эпидермиса.
Крем с мочевиной (карбамидом) помогает связывать влагу в роговом слое, снижает воспаление и дезинфицирует. Мочевина усиливает регенерацию кожи и повышает ее защитные функции, способствует отшелушиванию рогового слоя, не допуская образования трещин.
Эффективность разных по составу кремов и бальзамов для кожи, содержащих мочевину, изучали в ряде исследований с участием пациентов с СД. В одних работах эффективность этих препаратов оказалась выше эффективности традиционных косметических средств на основе жиров и масел [7-9]. В других исследованиях была показана схожая эффективность традиционных средств и препаратов с мочевиной, но из-за более приятных ощущений при нанесении предпочтение отдавалось последним, в результате повышалась приверженность пациентов к лечению [10].
В 2012 г. было проведено рандомизированное исследование с целью сравнения эффективности препарата, содержащего 5% мочевины, а также аргинин и карнозин, и увлажняющего крема на основе глицерина. В исследовании участвовало 40 пациентов с СД 2 типа. Эффективность препарата оценивалась в слепом режиме (исследователь не знал, какое средство применялось) по визуальной аналоговой шкале и полуколичественной шкале DASI (Dry Skin Area and Severity Index – индекс площади поражения и тяжести поражения сухой кожи). Препараты применялись два раза в день в течение четырех недель. Препарат, содержащий мочевину, показал более высокую эффективность по обоим методам оценки [11].
Однако следует помнить, что разные препараты, содержащие мочевину, имеют разное количество вспомогательных компонентов, поэтому не являются идентичными.
В связи с неоднозначностью имеющихся данных и отсутствием подобных работ в отечественной литературе автором было проведено исследование эффективности крема, содержащего мочевину, в отношении нормализации состояния кожи стоп у пациентов с СД.
Материал и методы исследования
В исследовании участвовало 45 пациентов с СД 1 или 2 типа и сухостью кожи стоп, не вызванной дерматологическими заболеваниями (ихтиоз и т.п.). У шести пациентов в анамнезе СД 1 типа, у 39 – СД 2 типа. Средний возраст больных – 60 ± 12 лет, длительность заболевания – 13 ± 7 лет. Пациенты были разделены на две группы. Терапия проводилась препаратом Бальзамед® интенсив и препаратом сравнения.
В состав препарата Бальзамед® интенсив (компания «Эспарма», Германия) входит мочевина (10%), вода, децилолеат, пантенол (провитамин В5), токоферола ацетат (витамин Е), глицерин, полиглицеро-2-диполигидроксостеарат (Дегимульс® PGPH), линоленовая кислота (витамин F), сульфат магния, стеарат цинка, масло авокадо, масло жожоба, масляный раствор витамина А, метилпарабен, пропилпарабен.
Состав препарата сравнения: вода, моностеарат глицерина, масло оливковое, воск эмульсионный и пчелиный, стеарин косметический, ланолин, масла ментоловое и чайного дерева, экстракты дуба, календулы, ромашки, зверобоя, крапивы, чистотела, подорожника, солодки, тысячелистника, сосны, метилпарабен, пропилпарабен, трилон Б.
Исследование включало оценку степени сухости кожи стоп, ощущений пациента при применении препарата (с помощью опроса), выполнения рекомендованного режима лечения.
Состояние кожи оценивали при осмотре пяточных областей пациента в положении лежа на животе, выраженность диабетического ксероза кожи определяли по шкале Exelbert (табл. 1) [12].
Нормальность распределения изучаемых показателей была подтверждена сопоставлением среднего и медианы. Данные представлены в виде средних величин и стандартных отклонений (M ± SD). При сравнении групп для оценки достоверности различий использовался непарный критерий Стьюдента (для количественных параметров) и критерий хи-квадрат Пирсона (для качественных).
Дизайн исследования
Исследование предполагало три визита врача: в начале исследования, через месяц терапии, через два месяца. Первый визит: пациентам первой группы (n = 23) для проведения терапии был назначен препарат Бальзамед® интенсив. Способ применения: нанесение на сухие участки кожи стоп два раза в день в течение месяца. Пациенты второй (n = 22) получали препарат сравнения (наносился в том же режиме). Второй визит: пациентам первой группы назначен препарат сравнения, второй – Бальзамед® интенсив (также для применения в течение месяца). Была проведена промежуточная оценка результатов применения препаратов. Во время третьего визита сделана итоговая оценка результатов.
Результаты и обсуждение
Исходно группы достоверно не различались по основным параметрам (табл. 2).
Результаты показали, что при применении бальзама Бальзамед® интенсив и препарата сравнения достоверно уменьшилась сухость кожи (табл. 3, рисунок). При этом Бальзамед® интенсив оказывал достоверно более выраженное действие (p
С клинической точки зрения имеет значение число пациентов, у которых произошло значительное (не менее чем на 50% (очень хороший эффект лечения) или не менее чем на 33% (хороший эффект)) уменьшение степени сухости кожи, а также число больных, не ответивших на лечение (сухость кожи уменьшилась незначительно – менее чем на 33% (недостаточный эффект лечения)). Результаты продемонстрировали преимущество препарата Бальзамед® интенсив перед препаратом сравнения (табл. 4).
Данные, полученные после первого месяца применения, отражают эффективность препарата у пациентов без предшествующей топической терапии. Как видно из табл. 3 и рисунка, эффект обоих препаратов по окончании второго месяца применения был менее выражен, что закономерно, учитывая частичную ликвидацию ксероза после первого месяца лечения. При этом различия в эффективности препаратов были достоверны как по окончании первого месяца терапии, так и второго (табл. 3).
Практическую пользу принесло бы выявление факторов, влияющих на эффективность препарата. Это позволило бы прогнозировать эффект применяемых средств (очень хороший, хороший или недостаточный) еще до начала лечения. Однако при проведении корреляционного анализа корреляции между эффектом препарата Бальзамед® интенсив и другими исследовавшимися параметрами (возраст, длительность СД, исходная степень сухости кожи, степень соблюдения предписанного режима лечения и приятные/неприятные ощущения пациента при нанесении препарата) выявить не удалось (r 0,05).
Доля пациентов, плохо соблюдавших предписанный режим применения, среди получавших Бальзамед® интенсив и препарат сравнения достоверно не различалась – 11 против 8% (p > 0,05), что косвенно свидетельствует об одинаково хорошей переносимости обоих препаратов. Можно констатировать, что небольшое число пациентов, плохо соблюдавших предписанный режим лечения, не оказало заметного влияния на результаты исследования.
Субъективные ощущения при нанесении препарата Бальзамед® интенсив 57% пациентов описывали как приятные, 6% – как неприятные и 29% – как нейтральные. Это соотношение не отличалось достоверно от такового для препарата сравнения (p > 0,05). В целом при применении Бальзамеда интенсив не возникало проблем с субъективной оценкой пациентами препарата, и даже при описании ощущений как неприятные они продолжали его использовать.
Заключение
Ксероз кожи стоп не просто косметическая проблема, а проявление диабетической автономной нейропатии и звено патогенеза СДС.
Проведенное исследование показало, что препарат Бальзамед® интенсив достоверно лучше устраняет сухость кожи стоп, чем крем на основе растительных масел. Данные литературы в целом подтверждают полученные результаты. Субъективные ощущения пациентов при использовании Бальзамеда интенсив оказались не хуже, чем при использовании препарата сравнения. При этом важно учитывать, что ощущения пациента при нанесении препарата на кожу не коррелируют с эффективностью препарата при длительном применении, и пациентов следует предупреждать об этом.
Без сомнений, профилактика язвенных дефектов стоп не ограничивается только лишь борьбой с ксерозом кожи. Пациенты должны быть обучены и другим правилам профилактики язвенных дефектов стоп: ежедневный осмотр ног и гигиенические мероприятия, правильная обработка ногтей и мозолей, отказ от удаления мозолей острыми предметами или мозольными жидкостями, правильный подбор обуви, отказ от ходьбы без обуви и ношения обуви без носка, проверка внутренней поверхности обуви рукой перед надеванием, правильная обработка мелких повреждений кожи, своевременное обращение за медицинской помощью и др. Адекватное лечение СД и сопутствующих заболеваний (достижение целевых показателей уровня глюкозы, холестерина и артериального давления), регулярные осмотры пациентов в кабинетах диабетической стопы, ношение ортопедической обуви теми пациентами, кому она необходима, – все эти мероприятия являются обязательными.
Однако, учитывая важность такого фактор риска СДС, как сухость кожи стоп, его наличие у пациентов должно регулярно проверяться и при необходимости устраняться. Особенно это касается пациентов с ишемией конечности, у которых трещины кожи пяточных областей развиваются легко и прогрессируют до диабетической язвы очень быстро. Этим пациентам необходимы регулярный осмотр кожи пяточных областей (которые зачастую пропускаются при обычном осмотре стоп) и активное устранение сухости кожи, если она выявлена.
Препараты, в состав которых входит мочевина, такие как Бальзамед® и Бальзамед® интенсив, показали высокую эффективность в борьбе с ксерозом кожи стоп у пациентов с СД.
Диабетическая нефропатия – это специфическое патологическое изменение почечных сосудов, возникающее при сахарном диабете. Данное осложнение приводит к гломерулосклерозу, а также снижает фильтрационные функции почек и способствует развитию хронической почечной недостаточности (ХПН). Клинически диабетическая нефропатия проявляется протеинурией и микроальбуминурией, нефротическим синдромом, артериальной гипертензией, признаками уремии и ХПН.
Диабетическая нефропатия является одним из самых тяжелых осложнений сахарного диабета первого и второго типов, она проявляется на поздних стадиях заболевания и является одной из основных причин смерти пациентов. Диабетическую нефропатию диагностируют у 10-20% больных сахарным диабетом. Чаще всего заболевание наблюдается у мужчин или лиц, у которых сахарный диабет I типа развился в пубертатный период. Пик развития диабетической нефропатии наблюдается спустя 15-20 лет после начала диабета.

Прогноз и профилактика диабетической нефропатии
Прогноз диабетической нефропатии зависит от стадии заболевания и от своевременности лечения. При этом единственным обратимым этапом развития является стадия микроальбуминурии. На стадии протеинурии возможно лишь приостановить прогрессирование диабетической нефропатии до ХПН. Если пациент достигает терминальной стадии диабетической нефропатии, то прогноз самый неблагоприятный, поскольку данное состояние не совместимо с жизнью.
Диабетическая нефропатия и ХПН, появившаяся вследствие нее, указывают на необходимость заместительной терапии – трансплантации почки или гемодиализа. В этом случае ХПН является причиной 15% летальных исходов, приходящихся на больных сахарным диабетом первого типа, не достигших 50-ти лет.
Профилактика диабетической нефропатии заключается в постоянном наблюдении пациентов, страдающих сахарным диабетом, контроле уровня ангиотензина, самоконтроле уровня гликемии, своевременной коррекции терапии, соблюдении всех рекомендаций врач.
Причины диабетической нефропатии
Как известно, почки в организме человека ответственны за очищение крови от токсинов, вредных веществ, ядовитых продуктов распада. После подобной фильтрации все отходы выводятся из организма с мочой.
Фильтрующим элементом почек являются почечные клубочки. Именно они, прежде всего, и повреждаются диабетом из-за высокого уровня сахара в крови. Эти патологические изменения в почечных сосудах и клубочках приводят к заболеванию диабетической нефропатией.
Существует несколько теорий, объясняющих причину возникновения диабетической нефропатии: метаболическая, гемодинамическая, генетическая. Несмотря на их различие, большинство специалистов сходится во мнении, что основным фактором и пусковым механизмом развития диабетической нефропатии является гипергликемия. Диабетическая нефропатия является следствием недостаточной компенсации нарушения углеводного обмена на протяжении длительного времени.
Метаболическая теория диабетической нефропатии утверждает, что постоянная гипергликемия способна привести к нарушению всех биохимических процессов в почках и снижению их функциональной активности. Нарушение «барьерной» функции почек приводит к появлению белка в моче – протеинурии. Если почки перестают очищать кровь должным образом, в организме начинают накапливаться продукты обмена и вода. В крови больного повышаются мочевина и креатинин, что указывает на развитие почечной недостаточности.
Гемодинамическая теория объясняет развитие диабетической нефропатии артериальной гипертензией, нарушением почечного кровотока. Длительная гипертензия способна привести к изменениям в структуре почечных клубочков. Сначала наблюдается гиперфильтрация с увеличением скорости выхода белков и образования первичной мочи. Позже происходит замещение ткани почечных клубочков на соединительную (гломерулосклероз), полная окклюзия почечных клубочков, снижение их фильтрационных способностей, развитие ХПН.
Генетическая теория развития диабетической нефропатии предполагает наличие у пациента факторов, проявляющихся при гемодинамических нарушениях и патологиях в обмене. Как правило, в патогенезе данного заболевания участвуют все три механизма развития, тесно связанных между собой.
К факторам риска, способствующим развитию диабетической нефропатии, могут относиться длительная неконтролируемая гипергликемия, артериальная гипертензия, избыточный вес, инфекции мочевыводящих путей, курение, принадлежность к мужскому полу.
Симптомы диабетической нефропатии
Диабетическая нефропатия – это медленно прогрессирующее заболевание, проходящее в своем развитии несколько стадий. В зависимости от патологических изменений диабетическая нефропатия имеет разные симптомы.
В настоящее время существует общепринятая классификация диабетической нефропатии по стадиям, согласно которой различают:
- стадию микроальбуминурии;
- стадию протеинурии;
- стадию хронической почечной недостаточности.
Длительное время диабетическая нефропатия протекает без каких-либо симптомов и внешних проявлений. На начальной стадии заболевания у пациента отмечается гиперфункциональная гипертрофия (увеличение размера клубочков почек), усиление почечного кровотока, а также увеличение скорости клубочковой фильтрации. Через несколько лет после начала сахарного диабета у пациента можно обнаружить первые структурные изменения клубочков почек и почечных сосудов. При этом объем клубочковой фильтрации остается высоким, а выведение альбумина с мочой остается в пределах нормы (менее 30 мг/сут).
Стадия микроальбуминурии при диабетической нефропатии развивается не раньше, чем через пять лет от момента возникновения сахарного диабета. Проявляется она постоянной микроальбуминурией. Показатели составляют 20-200 мг/мл или от 30 до 300 мг/сут в утренней моче. Периодически у пациента может повышаться артериальное давление, особенно при физической нагрузке. Дальнейшее ухудшение состояния больных диабетической нефропатией происходит лишь на более поздних стадиях.
Клинически выраженная диабетическая нефропатия может развиться при сахарном диабете I типа через 15-20 лет после начала заболевания. Для этой стадии развития болезни характерна стойкая протеинурия, когда уровень белка в моче превышает 300 мг/сут. Данный показатель свидетельствует о необратимости поражения сосудов почек. На этом этапе диабетической нефропатии наблюдается снижение скорости клубочковой фильтрации, а также почечного кровотока. Артериальная гипертензия при этом становится постоянной и практически некорригируемой. У пациента развивается нефротический синдром, проявляясь гиперхолестеринемией, гипоальбуминемией, периферическими и полостными отеками. Уровень креатинина, а также мочевины в крови в указанный период развития диабетической нефропатии практически не превышает норму.
Для терминальной стадии заболевания характерно резкое снижение функции почек – концентрационной и фильтрационной. Проявляется это массивной протеинурией, низкой скоростью клубочковой фильтрации, значительным повышением в крови уровня креатинина и мочевины, выраженными отеками, развитием анемии. На этой стадии диабетической нефропатии могут существенно уменьшиться гипергликемия, выделение с мочой эндогенного инсулина и потребность в экзогенном инсулине. Нефротический синдром прогрессирует, артериальное давление (АД) растет, у пациента развивается диспепсический синдром и уремия. Кроме того, на этой стадии фиксируется ХПН с явными признаками самоотравления организма токсинами и продуктами обмена.
Обнаружили симптомы данного заболевания?
Звоните
Наши специалисты проконсультируют Вас!
Диагностика диабетической нефропатии
Диагностировать диабетическую нефропатию на ранней стадии очень важно. С этой целью пациенту с диабетической нефропатией назначают биохимический и общий анализ крови, биохимический и общий анализ мочи, пробу Зимницкого, пробу Реберга, УЗДГ сосудов почек.
Основными маркерами на ранних стадиях диабетической нефропатии считаются микроальбуминурия и скорость клубочковой фильтрации (СКФ). У больных сахарным диабетом с этой целью исследуют соотношение креатинина и альбумина в утренней порции мочи или суточное выделение альбумина с мочой.
О переходе диабетической нефропатии в стадию протеинурии можно судить по наличию белка в моче или по выделению альбумина с мочой больше 300 мг/сутки. На этом этапе развития болезни отмечаются все признаки нефротического синдрома, повышение АД. Диагностика поздней стадии диабетической нефропатии затруднений не вызывает, поскольку наряду с массивной протеинурией и снижением СФК у пациентов происходят нарастание уровня мочевины и креатинина в крови, ацитоз, анемия, гипокальцемия, гиперлипидемия, гиперфосфотемия, отеки лица и тела.
При проведении диагностики диабетической нефропатии и назначении последующего лечения важно дифференцировать ее с другими заболеваниями: острым и хроническим гломерулонефритом, туберкулезом, хроническим пиелонефритом. Для этого проводится экскреторная урография, бактериологическое исследование мочи на микрофлору, УЗИ почек. В том случае, если у пациента отмечается быстро нарастающая протеинурия, стойкая гематурия или внезапное развитие нефротического синдрома, то проводится биопсия почки для уточнения диагноза.
Лечение диабетической нефропатии
Основная цель, преследуемая при лечении диабетической нефропатии, – это предупреждение и максимальная отсрочка дальнейшего прогрессирования заболевания до ХПК, снижение риска развития инфаркта, инсульта, ишемической болезни сердца.
В зависимости от стадии развития диабетическая нефропатия имеет разный подход к лечению. При этом общим в терапии для всех стадий диабетической нефропатии является строжайший контроль сахара крови, артериального давления, а также компенсация нарушений минерального, белкового, углеродного, липидного обменов. При лечении диабетической нефропатии препаратами первого выбора являются ингибиторы АПФ и антагонисты рецепторов к ангиотензину, способные нормализовать системную и клубочковую гипертензию и замедлить развитие заболевания. Препараты могут назначаться даже при нормальном АД в дозах, которые не могут привести к развитию гипотонии.
Начиная со стадии микроальбуминурии, пациенту с диабетической нефропатией наряду с указанным лечением рекомендуется специальная низкобелковая бессолевая диета. Чтобы снизить риск развития сердечно-сосудистых заболеваний при диабетической нефропатии, необходима коррекция дислипидемии, а именно: диета с низким содержанием жира и прием препаратов, нормализующих липидный спектр крови.
На терминальной стадии при лечении диабетической нефропатии пациенту необходима коррекция лечения сахарного диабета, дезинтоксикационная терапия, нормализация уровня гемоглобина, прием противоазотемических средств и сорбентов, профилактика остеодистрофии. Если функции почек резко ухудшаются, то при назначении лечения ставится вопрос о проведении гемодиализа, о трансплантации донорской почки или постоянного перитонеального диализа.
Данная статья размещена исключительно с целью ознакомления в познавательных целях и не является научным материалом или профессиональным медицинским советом. За диагностикой и лечением обратитесь к врачу.
