Неалкогольная жировая болезнь печени при сахарном диабете
Сахарный диабет и жировая болезнь печени
Сахарный диабет – это заболевание, связанное с нарушением одной из функций поджелудочной железе, а именно регулированием уровня сахара (глюкозы) в крови. Это та самая ситуация, когда поджелудочная железа и выделяемые ей регуляторные вещества не справляются с возложенной на них нагрузкой.
Сахарный диабет – это заболевание, связанное с нарушением одной из функций поджелудочной железе, а именно регулированием уровня сахара (глюкозы) в крови. Это та самая ситуация, когда поджелудочная железа и выделяемые ей регуляторные вещества не справляются с возложенной на них нагрузкой.
Что делает в организме поджелудочная железа?
Поджелудочная железа состоит из 2-х частей, находящихся одна внутри другой. Одна из частей, нам более известная, выполняет пищеварительную функцию. Он выделяет различные вещества – ферменты, переваривающие преимущественно жиры и углеводы. Нарушение данной функции поджелудочной железы, связанное с ее воспалением и снижением выработки ферментов, называется панкреатит. Он бывает острый и хронический. Однако в рамках сахарного диабета нас это мало интересует.
Другая часть поджелудочной железы, расположенная в виде так называемых островков Лангерганса, выделяет большое количество регулирующих веществ – гормонов. Часть этих гормонов отвечает за рост и развитие организма и более значима в молодом возрасте. Другая часть гормонов, собственно, отвечает за регулирование уровня глюкозы в организме.
Зачем нам нужна глюкоза?
Глюкоза является основным источником энергии в организме, ей питаются все клетки, ткани и органы, в том числе и мозг. Поскольку значение глюкозы в организме чрезвычайно велико, то организм различными способами поддерживает ее постоянное количество в крови. Мы можем определить уровень глюкозы, в норме ее концентрация в крови составляет от 3,5 до 5,5 ммоль/л (данный диапазон может меняться в разных лабораториях в зависимости от используемых ими реактивов).
Таким образом, для нормальной работы в первую очередь мозга и остальных органов в крови должна поддерживаться постоянная концентрация глюкозы. Снижение ее количества называется гипогликемия и может привести к тяжелым осложнениям, вплоть до гипогликемической комы! Повышение количества глюкозы называется гипергликемия и также может привести развитию сахарного диабета, к тяжелым осложнениям со стороны сердца, мозга, сосудов, вплоть до гипергликемической или гиперосмолярной комы!
Уровень глюкозы (сахара) в организме можно сравнить с количеством бензина в машине. Например, когда водитель замечает низкий уровень бензина, на котором работает двигатель, он едет на заправочную станцию и пополняет запас топлива в баке. Точно также и организм, замечая низкий уровень глюкозы, с помощью мозга сообщает нам о том, что необходимо поесть. Водитель заправляет свою машину таким количеством топлива, которое необходимо ему, чтобы доехать до следующей автозаправочной станции или до места назначения. Так же и мозг дает сигнал о насыщении, когда отмечает уровень потребленной пищи, достаточный до следующего перекуса.
Как развивается сахарный диабет?
Это заболевание развивается, когда мы заправляем свой организм с избытком, таким количеством, которое ему не нужно. Но, если водитель заливает слишком много топлива в машину, то оно выливается из бензобака наружу, создавая опасность возгорания не только автомобиля, но и всей заправочной станции. Напротив, человек, заправляя свой организм избытком высокоэнергетической пищи, создает повышенную нагрузку на печень и поджелудочную железу. Если переедание, главным образом высокоэнергетической пищи, богатой углеводами и жирами, происходит на регулярной основе, в конце концов организм не выдерживает этой нагрузки… Тогда развивается панкреатит, диабет, жировая болезнь печени.
Как сахарный диабет связан с печенью?
Оказывается все достаточно просто. Наше кровообращение устроено таким образом, что все вещества, переваренные в желудке и кишечнике, всасываются в кишечнике в кровь, которая в дальнейшем поступает частично в печень. И кроме высокой нагрузки на пищеварительную часть поджелудочной железы, ведь она должна переварить весь этот объем пищи, создается высокая нагрузка на печень и регулирующую часть поджелудочной железы.
Печень должна пропустить через себя все жиры из пищи, а они оказывают на нее повреждающее воздействие. Поджелудочная железа, должна куда-то «пристроить» все полученные с пищей углеводы и глюкозу – ведь ее уровень должен быть стабильным. Так организм превращает излишек углеводов в жиры и опять появляется повреждающее действие жиров на печень! А поджелудочная железа истощается, вынужденная вырабатывать все больше и больше гомонов и ферментов. До определенного момента, когда в ней развивается воспаление. И печень, постоянно повреждаясь, до определенного момента не воспаляется.
Что такое метаболический синдром?
Когда оба органа повреждены и воспалены, развивается так называемый метаболический синдром. Он сочетает в себе 4 основных компонента: стеатоз печени и стеатогепатит, сахарный диабет или нарушение устойчивости к глюкозе, нарушение обмена жиров в организме, поражение сердца и сосудов.
Стеатоз печени и стеатогепатит
Все полученные жиры содержат холестерин, триглицериды и различные липопротеиды. Они накапливаются в печени в большом количестве, могут разрушать клетки печени и вызывать воспаление. Если избыток жиров не может полностью нейтрализоваться печенью, он разносится кровотоком к другим органам. Отложение жиров и холестерина на кровеносных сосудах приводит к развитию атеросклероза, в дальнейшем провоцирует развитие ишемической болезни сердца, инфарктов и инсультов. Отложение жиров и холестерина повреждает и поджелудочную железу, нарушая обмен глюкозы и сахара в организме, способствуя тем сама развитию сахарного диабета.
Накопленные в печени жиры подвергаются воздействию свободных радикалов, и начинается их перекисное окисление. В результате образуются измененные активные формы веществ, обладающие еще большим разрушающим действием в отношении печени. Они активируют определенные клетки печени (звездчатые клетки) и нормальная ткань печени начинает замещаться соединительной тканью. Развивается фиброз печени.
Таким образом, вся совокупность изменений, связанных с обменом жиров в организме повреждает печень, приводит к развитию:
– стеатоза (избыточного накопления жиров в печени),
– стеатогепатита (воспалительных изменений печени жировой природы),
– фиброза печени (образования в печени соединительной ткани),
– цирроза печени (нарушения всех функций печени).
Когда и как заподозрить эти изменения?
Раньше всего нужно начинать бить тревогу тем, у кого уже установлен диагноз. Это может быть один из перечисленных ниже диагнозов: атеросклероз, дислипидемия, ишемическая болезнь сердца, стенокардия, перенесенный инфаркт миокарда, постинфарктный атеросклероз, артериальная гипертензия, гипертоническая болезнь, сахарный диабет, нарушение толерантности к глюкозе, инсулинорезистентность, метаболический синдром, гипотиреоз.
Если у Вас установлен один из перечисленных диагнозов, обратитесь к врачу для проверки и контроля состояния печени, а также назначения лечения.
Если в результате обследования у Вас выявили отклонения одного или нескольких лабораторных показателей в анализе крови, например, повышенный уровень холестерина, триглицеридов, липопротеидов, изменения уровня глюкозы или гликозилированного гемоглобина, а также повышение показателей, характеризующих функцию печени – АСТ, АЛТ, ТТГ, ЩФ, в некоторых случаях Билирубин.
При повышенном уровне одного или нескольких параметров, также обратитесь к врачу для уточнения состояния здоровья, проведения дальнейшей диагностики и назначения лечения.
Если у Вас есть один или несколько симптомов или факторов риска развития заболеваний, Вам также нужно обратиться к врачу для более точной оценки риска, определения необходимости проведения обследования и назначения лечения. Факторами риска развития или симптомами метаболического синдрома являются избыточный вес, большой объем талии, периодическое или постоянное повышение артериального давления, употребление большого количества жирной или жареной пищи, сладкого, мучного, алкоголя.
Что будет рекомендовать врач?
В любом случае, при наличии заболевания или наличии повышенных показателей в анализах или наличии симптомов и факторов риска, необходима консультация специалиста!
Нужно обратиться сразу к нескольким специалистам – терапевту, кардиологу, эндокринологу и гастроэнтерологу. Если в данной ситуации больше всего интересует состояние печени, можно обратиться к гастроэнтерологу или гепатологу.
Врач определит серьезность нарушений или степень тяжести заболевания, в зависимости от этого при реальной необходимости назначит обследование и подскажет, что именно в этом обследовании будет иметь значение для оценки рисков.
До, после или во время проведения обследования врач может назначить лечение, это будет завесить от выраженности обнаруженных симптомов и нарушений.
Чаще всего для лечения жировой болезни печени в сочетании с сахарным диабетом, то есть при наличии метаболического синдрома используется несколько лекарственных препаратов: для коррекции состояния печени, для снижения уровня холестерина, для восстановления чувствительности организма к глюкозе, для снижения артериального давления, для снижения риска инфарктов и инсультов, и некоторые другие.
Самостоятельно экспериментировать с модификацией лечения или подбором препаратов небезопасно! Обратитесь к врачу для назначения лечения!
Какие препараты используются для восстановления функции печени?
Важную роль в лечении занимает снижение избыточного веса, увеличение физической активности, специальная диета с пониженным уровнем холестерина и быстрых углеводов, в зависимости от ситуации, возможно, придется даже считать «хлебные единицы».
Для лечения заболеваний печени существует целая группа препаратов, которые называются гепатопротекторы. За рубежом эта группа препаратов называется цитопротекторы. Эти препараты имеют различную природу и химическую структуры – есть растительные препараты, препараты животного происхождения, синтетические лекарственные средства. Безусловно, свойства этих препаратов различны и используются они преимущественно при разных заболеваниях печени. В тяжелых ситуациях используется сразу несколько медикаментов.
Для лечения жировой болезни печени обычно назначаются препараты урсодезоксихолевой кислоты и эссенциальные фосфолипиды. Эти лекарственные средства уменьшают перекисное окисление жиров, стабилизируют и восстанавливают клетки печени. За счет этого повреждающее действие жиров и свободных радикалов уменьшается, также уменьшаются и воспалительные изменения в печени, процессы образования соединительной ткани, как следствие замедляется развитие фиброза и цирроза печени.
Препараты урсодезоксихолевой кислоты (Урсосан) оказывают в большей степени стабилизирующее действие на клеточные мембраны, препятствуя тем самым разрушению печеночных клеток и развитию воспаления в печени. Урсосан также обладает желчегонным действием и увеличивает выделение холестерина вместе с желчью. Именно поэтому предпочтительное его использование при метаболическом синдроме. Кроме этого, Урсосан стабилизирует желчевыводящие пути, общие у желчного пузыря и поджелудочной железы, оказывая на эти органы благоприятное воздействие, что особенно важно при панкреатитах.
Жировая болезнь печени, сочетающаяся с нарушением обмена сахара и глюкозы, требует использования в лечении дополнительных медикаментозных препаратов.
В данной статье приведена ограниченная информация о методах и способах лечения болезней печени. Благоразумие требует обращения к врачу для подбора правильной схемы лечения!
Обращаем ваше внимание! Эта статья не является призывом к самолечению. Она написана и опубликована для повышения уровня знаний читателя о своём здоровье и понимания схемы лечения, прописанной врачом. Если вы обнаружили у себя схожие симптомы, обязательно обратитесь за помощью к доктору. Помните: самолечение может вам навредить.
Представлены особенности патогенеза и лечения неалкогольной жировой болезни печени у пациентов с сахарным диабетом 2-го типа. Неалкогольная жировая болезнь печени (НАЖБП) является одним из самых распространенных заболеваний в гепатологии. Рассмотрена роль дефицита таурина в патогенезе данного заболевания.
Введение
Неалкогольная жировая болезнь печени (НАЖБП) уже несколько десятилетий является предметом пристального внимания врачей разных специальностей. НАЖБП признана основным компонентом метаболического синдрома и главным фактором риска развития сердечно-сосудистых осложнений [1–4]. Поражение печени при данном заболевании характеризуется жировой дистрофией (стеатоз) с воспалением и повреждением гепатоцитов (неалкогольный стеатогепатит (НАСГ)) и развитием фиброза. При прогрессировании существует риск перехода НАЖБП в цирроз.
В 75% случаев НАЖБП сочетается с ожирением, дислипидемией, артериальной гипертензией, сахарным диабетом (СД) 2 типа или нарушением толерантности к глюкозе (НТГ) [1, 5, 6]. Указанные патологические процессы относятся к факторам риска прогрессирования атеросклероза и развития сердечно-сосудистых заболеваний. Определенная роль в патогенезе НАЖБП отводится снижению синтеза и нарушению транспорта желчных кислот (ЖК), что обусловлено повреждением мембран гепатоцитов, ингибированием ферментных систем и воспалением.
ЖК – стероидные монокарбоновые кислоты, производные холановой кислоты. Они образуются в гладком эндоплазматическом ретикулуме гепатоцитов и являются секретом эпителиальных клеток печени.
Биосинтез ЖК считается одним из важных путей выведения холестерина (ХС). Пул ЖК у человека представлен примерно в равных количествах высокогидрофобными холевой, хенодезоксихолевой, дезоксихолевой кислотами. Первичные ЖК конъюгируются с глицином и таурином, что повышает их гидрофильность. Они являются активаторами ядерных рецепторов, регулирующих экспрессию генов, участвующих в секреции, транспорте и метаболизме первичных ЖК, ХС и триглицеридов (ТГ) в гепатоцитах и плазме [3, 7, 8]. При СД 2 типа и инсулинорезистентности (ИР) эндокринная функция ЖК нарушается, уменьшается их абсорбция, что увеличивает жировую инфильтрацию печени, нарушает метаболизм липидов, в печени и плазме накапливаются ТГ и липопротеины низкой плотности (ЛПНП). Развивается билиарная недостаточность, приводящая к уменьшению количества желчи и циркулирующих ЖК. Как следствие, развиваются жировая болезнь печени и холелитиаз [3, 4, 6, 9–12].
ЖК являются активаторами липолитических ферментов, повышают активность липазы в 10–15 раз. В крови ЖК транспортируются главным образом с альбумином, а также с липопротеинами высокой плотности (ЛПВП).
Образование желчи, транспорт ЖК связаны с активностью Na/K-АТФазы, играющей важную роль в захвате гепатоцитами хлоридов и бикарбонатов из плазмы. Нарушение активности Na/K-АТФазы обусловливает снижение чувствительности рецепторов к инсулину.
Нарушение транспортных функций гепатоцитов приводит к нарушению метаболизма лекарств, изменению их токсичности и эффективности.
При воспалении значительно снижается активность многих белков-транспортеров. В первую очередь происходят нарушения в мембранных белках-транспортерах глюкозы. Это приводит к ИР, провоцирует развитие сосудистой воспалительной реакции из-за избыточной продукции жировой тканью воспалительных цитокинов [4, 10, 12]. Перекисное окисление липидов подавляет активность ферментов – цитохромоксидазы (таким образом угнетается тканевое дыхание) и гидроксилазы (участвует в превращении холестерола в ЖК). Под влиянием активных форм кислорода нередко образуются аномальные формы ЖК, липопротеинов, липидов и других продуктов секреции желчи. Как следствие, изменяются их физико-химические свойства, физиологические функции, развивается и прогрессирует НАСГ. Пероксинитрит тормозит ферменты дыхательной цепи митохондрий – мембранную Na/K-АТФазу и блокирует натриевые каналы. Избыток в клетках свободных жирных кислот (СЖК) усиливает продукцию активных форм кислорода, активизируются синтез эндотелием синтазы оксида азота (NO) и его образование. При избытке СЖК уменьшается связывание инсулина рецепторами гепатоцитов, развивается гиперинсулинемия. Инсулин стимулирует образование NO. Высокая продукция NO наблюдается при эндотоксинемии, септическом шоке и увеличенной кишечной проницаемости при воспалительных заболеваниях кишечника [13, 14].
Эндотоксинемия угнетает антиоксидантную систему, что сопровождается повышением деконъюгации ЖК, образованием токсичных солей и повышением реабсорбции. При этом синтез ЖК уменьшается, ХС – увеличивается. В патогенезе НАЖБП немаловажную роль играет дефицит таурина. Таурин – жизненно необходимая сульфоаминокислота, которая является конечным продуктом обмена серосодержащих аминокислот (метионина, цистеина, цистеамина) [15, 16]. Молекула таурина состоит из двух атомов углерода, сульфоновой группы (SO3H) и аминогруппы (NH2). Однако биологически синтезируемого таурина недостаточно для поддержания биохимических процессов в организме, в которых он задействован. Основным источником таурина считаются мясные и рыбные продукты. При недостаточности поступления таурина с пищей или вследствие каких-либо иных причин (ишемия, СД, стресс, травма и др.) страдают все виды обмена веществ в каждой клетке каждого органа. Так, дефицит таурина в печени ассоциируется с нарушением выделения желчи, образованием камней, изменением обмена ХС и липидов.
Известно, что таурин, соединяясь с холевой кислотой, участвует во всасывании жиров и жирорастворимых витаминов.
Таурин может соединяться с атомом хлора, источником которого является гипохлорная кислота, производимая активированными нейтрофилами. В данном случае таурин выступает в качестве окислителя и компонента антибактериальной защиты.
В митохондриях хлораминотаурин влияет на сборку белков дыхательной цепи и оказывает антиоксидантное воздействие. Это соединение уменьшает воспалительный сигнал в клетках животных через ингибирование активации нуклеарного фактора каппа B.
В свободном состоянии таурин выполняет жизненно важную для животной клетки функцию – регуляцию осмотического давления и ионов кальция.
Таурин участвует в регуляции желчевыделения. Первичные ЖК (холевая и хенодезоксихолевая) синтезируются в гепатоцитах печени из ХС. Вторичные (литохолевая, урсодезоксихолевая, аллохолевая и др.) ЖК образуются из первичных в толстой кишке.
В желчном пузыре ЖК присутствуют главным образом в виде конъюгатов – парных соединений с глицином и таурином. Продуктом конъюгации ЖК с таурином являются таурохолевая, таурохенодезоксихолевая и тауродезоксихолевая кислоты. Конъюгация с ЖК обеспечивает их устойчивость – не выпадают в осадок при низких значениях рН в желчных протоках и двенадцатиперстной кишке. Важная роль ЖК в пищеварении заключается в способствовании всасыванию ряда гидрофобных веществ: ХС, жиров, жирорастворимых витаминов, растительных стероидов. В отсутствие ЖК всасывание вышеперечисленных компонентов пищи практически невозможно.
Таурохолевая кислота снижает количество Escherichia coli в слепой кишке [17].
В отличие от ЖК, конъюгированных с глицином, тауроконъюгаты ЖК обладают холеретическим действием и предупреждают развитие холестаза [18, 19].
В исследовании in vitro гликолитохолевая кислота легко осаждается кальцием, чего не наблюдается с тауролитохолевой кислотой [13]. Таким образом, таурин необходим для повышения текучести желчи, увеличения продукции ЖК и предупреждения развития холестаза [14, 20].
Таурин снижает содержание продуктов жизнедеятельности микроорганизмов в толстой кишке (короткоцепочечных ЖК, эндотоксина, оксида азота) [21–23].
При диффузных заболеваниях печени таурин увеличивает кровоток, улучшает микроциркуляцию и уменьшает выраженность цитолиза [24]. Доказано его положительное влияние на углеводный и липидный обмен. Антиоксидантное, гипогликемическое, детоксицирующее действие таурина и его способность выводить ХС (рис. 1) позволяют рассматривать его в качестве препарата для терапии НАЖБП. 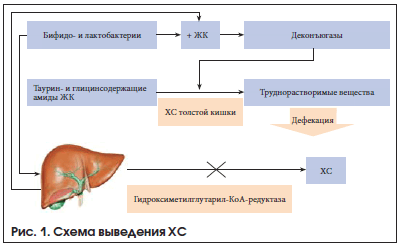
У больных СД таурин уменьшает ИР, защищает бета-клетки поджелудочной железы, оказывает сахароснижающее действие, не вызывая развития гипогликемии [14, 20].
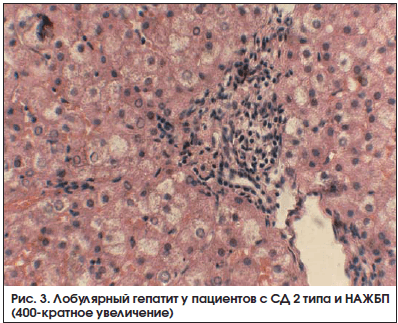
В деконъюгации комплексов ЖК с таурином и глицином активно участвуют ферменты различных бактерий. В норме дезоксихолевая и хенодезоксихолевая кислоты при участии секреторного иммуноглобулина А, влияющего на их антимикробную активность, подавляют рост патогенных и условно-патогенных микроорганизмов даже в физиологических концентрациях [2]. При нарушении энтерогепатической циркуляции ЖК образуется их значительный дефицит в кишечнике. В тонкой кишке недостаток ЖК обусловливает изменение работы всего пищеварительно-транспортного конвейера, нарушение всасывания и переваривания пищи (синдром нарушенного всасывания). В толстой кишке их дефицит (помимо многочисленных метаболических нарушений) ассоциируется со снижением «стерилизующих» и нутритивных свойств желчи. Прогрессирование дисбиоза, брожение, дисфункция баугиниевой заслонки и усиление микробной контаминации тонкой (подвздошной) кишки, с одной стороны, поддержание хронического воспаления в печени вследствие поступления через систему воротной вены с кровью повышенного количества эндотоксина грамотрицательной микрофлоры – с другой, способствуют прогрессированию стеатогепатита (рис. 2 и 3). В связи с вышеизложенным необходимым условием эффективного лечения НАЖБП представляется восстановление энтерогепатической циркуляции желчных кислот: нормализация синтеза желчи в печени и ее адекватное поступление в кишечник [25]. Поэтому назначение препаратов, одновременно обеспечивающих антиоксидантную защиту, стабилизацию мембран гепатоцитов, противовоспалительное действие, нормализацию состава метаболитов кишечной микрофлоры, обоснованно.
Цели исследования
В ходе исследования было поставлено три цели:
1) определить общее содержание ЖК в сыворотке крови пациентов с НАЖБП и СД 2 типа;
2) оценить влияние маркеров воспаления (NO, эндотоксина, фосфолипазы А2 (ФЛА2), малонового диальдегида (МДА)) на синтез и транспорт ЖК;
3) проанализировать фармакодинамические показатели метаболитов NO и бактериального эндотоксина, биохимические показатели крови и липидного спектра на фоне трех месяцев терапии таурином (препаратом Дибикор) у больных НАЖБП и СД 2 типа.
Материал и методы
Обследовано 158 пациентов с НАЖБП (90 женщин и 68 мужчин), из них с СД 2 типа – 46, с НТГ – 112. Средний возраст больных – 55,5 ± 7,5 года, индекс массы тела – более 30 кг/м2. Диагноз верифицирован клиническими, биохимическими, инструментальными и морфологическими методами. Общее содержание ЖК в сыворотке крови определяли ферментным методом на биохимическом анализаторе Olimpus с использованием тест-систем Randox (Англия). Содержание ФЛА2 определяли иммуноферментным методом с использованием диагностических наборов PLAC TEST ELiSA Kit (США). Перекисное окисление липидов определяли по содержанию МДА с тиобарбитуровой кислотой. Для определения эндотоксина применяли хромогенный метод по конечной точке с использованием LAL-теста (Limulus Amebo-cyte Lysate). Уровень метаболитов NO оценивали скрининг-методом в биологических жидкостях с хлоридом ванадия (Германия). В двойное слепое плацебо-контролируемое исследование включено 40 больных, страдающих НАЖБП и СД 2 типа: 30 женщин и 10 мужчин. Их средний возраст составил 56,35 ± 8,75 года. Методом случайных чисел пациентов разделили на две группы. Первая (основная группа) получала таурин (Дибикор, ООО «ПИК-ФАРМА»), вторая (контрольная группа) – плацебо.
Дибикор назначали в дозе 0,5 г 2 р./сут за 20 мин до еды. Длительность применения – 3 мес. Статистическую обработку данных проводили с использованием программы «Биостат».
Результаты и их обсуждение
Общее содержание ЖК в сыворотке крови. У больных НАЖБП без нарушения углеводного обмена (68 пациентов) среднее содержание ЖК в сыворотке крови составило 5,4 ± 1,8 мкмоль/л, у больных НАЖБП с НТГ – 8,88 ± 4,94 мкмоль/л. У 59 пациентов с НАЖБП и СД 2 типа их содержание было достоверно снижено на 45% и составило 2,97 ± 0,2 мкмоль/л (р = 0,001). У пациентов с НАЖБП, которая наблюдается при ожирении в 90% случаев [1, 3], изменяется состав желчи, увеличивается ее литогенность и развиваются билиарный сладж и холелитиаз. ЖК регулируют метаболизм глюкозы и липидов. Биосинтез и транспорт ЖК связаны с активностью фермента Na/K-AТФазы. ЖК восстанавливают чувствительность рецепторов к инсулину [4, 6, 9, 12], лептину, грелину и адипонектину.
При развитии воспаления снижается активность НNF4-альфа (гепатоцитарный ядерный фактор для синтеза и конъюгации ЖК) [4, 6, 9, 10, 12].
Оксид азота ингибирует и блокирует натриевые каналы, подавляет активность фермента холестерол-гидроксилазы, осуществляющей превращение холестерола в ЖК. При воспалении, гипоксии, эндотоксиновой агрессии нарушаются функции эндотелия. Макрофаги под действием эндотоксина выделяют NO, который легко проникает в клетки и взаимодействует с ферментами и белками-переносчиками, влияет на конъюгацию ЖК, липопротеинов и глюкозы. Уровень стабильных метаболитов NO в группе НАЖБП и СД 2 типа оказался достоверно выше и составил в среднем 137,7 ± 35,96 мкмоль/л по сравнению с группой НАЖБП и НТГ и контрольной группой – 66,75 ± 17,01 и 32,15 ± 0,51 мкмоль/л (р = 0,0001). Содержание метаболитов NO возрастало параллельно концентрации аминотрансфераз (r = 0,86) и ФЛА2 (r = 0,658). ФЛА2 гидролизует окисленный фосфатидилхолин с образованием жирной кислоты и лизофосфатидилхолина, который изменяет активность синтазы NO и количество синтезируемого NO или снижает его биодоступность.
Утилизация глюкозы в жировой и мышечной тканях NO-зависима, при блокировании как нейрональной, так и эндотелиальной NO-синтазы развивается гипергликемия [19]. Оксид азота ингибирует Na/K-АТФазу. В результате снижается чувствительность к инсулину, ингибируются митохондриальные ферменты, цитохром Р-450, который метаболизирует ЖК и ХС, происходит накопление СЖК в клетках печени.
Уровень ФЛА2 в сыворотке крови пациентов с НАЖБП и СД 2 типа в среднем составил 621,9 ± 84,71 нг/мл (медиана – 605 (504–826) нг/мл) (р = 0,0001), пациентов с НАЖБП и НТГ – 423,2 ± 45,2 нг/мл (медиана – 430 (324–497) нг/мл) (р = 0,0001).
При попадании в кровоток ФЛА2 связывается и транспортируется с ЛПНП. Между ФЛА2 и ЛПНП отмечена корреляционная зависимость (r = 0,957): чем выше в плазме крови уровень ХС ЛПНП, тем более активно формируется атероматоз интимы артерий, тем в большей степени выражен дефицит в клетках эссенциальных полиеновых жирных кислот. Как следствие, повышается вязкость фосфолипидов в мембране клеток, нарушается функция белков мембраны, в т. ч. глюкозных транспортеров, что приводит к развитию СД 2 типа.
Содержание эндотоксина в сыворотке крови в группе НАЖБП и СД 2 типа было увеличено в 12 раз по сравнению с содержанием эндотоксина в контрольной группе – 3,69 ± 1,44 ЕЭ/мл (норма – 0,3 ± 0,05 ЕЭ/мл). В группе НАЖБП и НТГ его уровень составил 1,43 ± 0,24 ЕЭ/мл (р = 0,0001). Повышение эндотоксина и NO выявлено при прогрессировании воспалительной инфильтрации в печени (рис. 4). Эндотоксин активирует Са2+-каналы на мембране гладкомышечных клеток, что приводит к активации ФЛА2.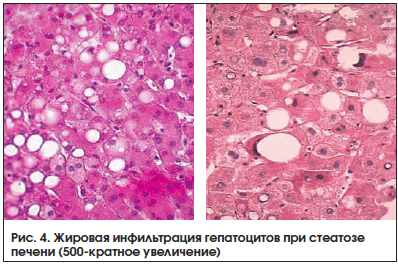
Показатели перекисного окисления липидов. Содержание МДА у пациентов с НАЖБП и СД 2 типа в зависимости от степени выраженности воспаления оказалось увеличенным в два раза. При гипергликемии и чрезмерном накоплении липидов в гепатоцитах усиливаются процессы перекисного окисления первых, что проводит к некрозу гепатоцитов, нарушению функции митохондрий, развитию фиброза и формированию стеатогепатита (рис. 2–4).
Выявлена также связь перекисного и фосфолипазного механизмов повреждения мембран гепатоцитов. Отмечена корреляционная зависимость между ФЛА2 и МДА. Коэффициент корреляции – -0,578 (р = 0,005).
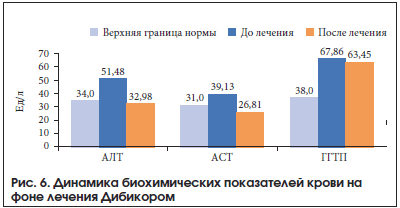
Уровень метаболитов NO у пациентов с НАЖБП и СД 2 типа до лечения был повышен в 6,8 раза и составлял 220,7 ± 14,27 мкмоль/л (норма – 32,15 ± 0,51 мкмоль/л) (р = 0,001). После лечения Дибикором их содержание снизилось на 97 мкмоль/л (на 44%) (рис. 5). Лечение таурином сопровождалось улучшением биохимических показателей крови. Отмечались снижение уровня общего ХС (ОХС), ХС ЛПНП и ТГ, нормализация липидного спектра. Уровень метаболитов NO уменьшался одновременно с уменьшением уровня
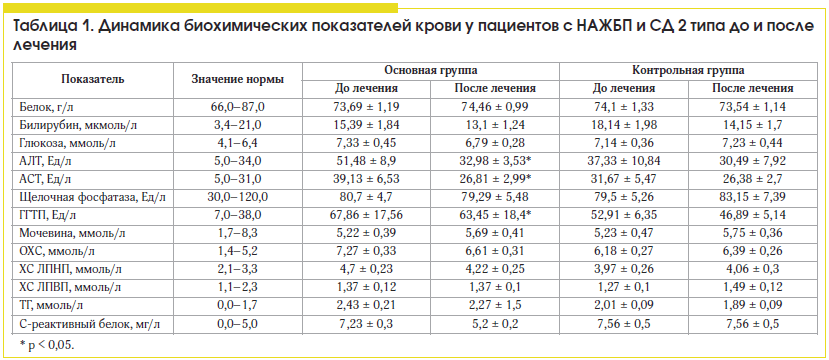
аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ) и гамма-глутамилтранспептидазы (ГГТП) (табл. 1, рис. 6 и 7). Таким образом, у пациентов с НАЖБП и СД 2 типа отмечено снижение уровня ЖК на 45%, что связано с повреждением мембран клеток, ингибированием ферментных систем и воспалением. Увеличение содержания маркеров воспаления липопротеин-ассоциированной ФЛА2, NO, эндотоксина, МДА при НАЖБП и СД 2 типа связано с воспалительным процессом в печени, повышением активности печеночных ферментов и тяжелыми морфологическими изменениями.

Заключение
Полученные результаты свидетельствуют о противовоспалительном, антиоксидантном, детоксицирующем и мембраностабилизирующем действии Дибикора у пациентов с НАЖБП и СД 2 типа. На фоне приема препарата уменьшалась активность НАСГ, что сопровождалось улучшением биохимических показателей крови и липидного спектра (отмечена тенденция к снижению уровня ОХС, ХС ЛПНП, увеличению уровня ХС ЛПВП), снижением уровня метаболитов NO параллельно снижению уровня АЛТ, АСТ и ГГТП.
Статья впервые опубликована в журнале «Эффективная фармакотерапия». 2017. № 8. С. 6–13.
