Неферментативное гликозилирование белков при диабете

Глики́рование, или неферментати́вное гликозили́рование, — реакция между восстанавливающими углеводами (глюкоза, фруктоза и др.) и свободными аминогруппами белков, липидов и нуклеиновых кислот живого организма, протекающая без участия ферментов. Гликирование белков является ключевым механизмом повреждения тканей при сахарном диабете.

Гликирование белков — одна из главных причин, вызывающих старение организма, провоцирующих атеросклероз, инсульт, инфаркт, морщины и т.д.
В нормальных условиях скорость гликирования белков в организме настолько мала, что её продукты успевают удаляться. Однако, при повышении уровня сахара в крови реакция значительно ускоряется, продукты накапливаются и способны вызвать серьезные нарушения. Особенно это выражено в крови, где резко повышается уровень повреждённых белков (например, концентрация гликозилированного гемоглобина является показателем степени диабета). Накопление изменённых белков в хрусталике вызывает тяжёлое нарушение зрения у больных диабетом.
Накопление гликированных белков, так же как и продуктов окисления, которое происходит с возрастом, приводит к возрастным изменениям в тканях. Пока не найдено лекарств, способных подавлять эти реакции в организме, однако активно ведутся соответствующие исследования . Наиболее распространённым поздним продуктом реакции является карбоксиметиллизин, производное лизина. Карбоксиметиллизин в составе белков служит биомаркером общего оксидативного стресса организма. Он накапливается с возрастом в тканях, например в коллагене кожи, и повышен при диабете.
Что происходит в результате гликирования белков?
- повреждается коллаген кожи, теряется упругость кожи, появляются морщины.
- повреждается кристаллин хрусталика глаза, это вызывает катаракту и повреждение зрения
- конечные продукты гликирования вызывают системное воспаление, приводящее к старению всего организма и атеросклерозу сосудов. Атеросклероз сосудов — это основная причина инсульта и инфаркта сердца.
Основные причины, вызывающие гликирование белков
- Употребление в пищу конечных продуктов гликирования, которые получаются при приготовлении пищи, если температура приготовления выше 120 градусов. Золотистая корочка, которая образуется при жарке и запекании — яркий самый распространенный пример продукта гликирования.
- Употребление в пищу продуктов, вызывающих процессы гликирования. К ним относятся так называемые быстрые сахара (глюкоза, лактоза, сахароза и другие)
 Вот так заманчиво выглядят гликированные белки.
Вот так заманчиво выглядят гликированные белки.
Как снизить скорость реакции гликирования белков
Ничто не сможет сравниться по эффективности в этом вопросе с простым соблюдением диеты. Необходимо свести к минимуму или вовсе исключить продукты с высоким гликемическим индексом (мучные изделия, сладости), а также жареные и печеные продукты (приготовленные при температуре выше 120 градусов)
Некоторые медикаментозные препараты обладают свойством замедлять скорость гликирования. Это аспирин, витамины B6 и B1, глюкозамин сульфат, метформин. Витамин B6 способен мощно мешать образованию конечных продуктов гликирования.
Самая эффективная форма Витамин B6 — пиридоксаль-5`-фосфат. В исследованиях одна из форм витамина Б6 (пиридоксамин) показала способность ингибировать гликирование в 6 раз сильнее, чем метформин. А пиридоксаль-5`-фосфат делает это ещё в 4 раза сильнее и является самым мощным средством для подавления гликирования, известным нам.
Однако, применять эти препараты без назначения врача и предварительных исследований не рекомендуется, так как есть мнение, что неумеренное потребление этих препаратов увеличивает риск развития раковых опухолей.
Рекомендуемая дозировка Витамина B6 (пиридоксамина) — 20 мг в сутки(максимальная) , а Витамин B6 (пиридоксина) — ниже 10 мг в сутки. Возможная токсичная дозировка Витамина B6 (пиридоксина)- 30 и выше (вероятность необратимого поражения мозга), хотя FDA допускает до 100 мг в сутки. Токсичная доза Витамина B6 (пиридоксамин) — 250 мг, но возможно и ниже.
Рекомендуются к употреблению продукты с высоким содержанием витамина В6 — скумбрия, фасоль, соя.
Источник
В развитии осложнений сахарного диабета (СД) участвует огромное количество факторов. Однако ключевую роль играет гликирование белков, характерное для хронической гипергликемии, активации воспаления и окислительного стресса.
Установлено, что образование и накопление конечных продуктов гликирования (КПГ) негативно воздействует на функции внутри- и внеклеточных структур. В частности, КПГ нарушают образование поперечных связей между своими рецепторами и молекулами базальной мембраны внеклеточного матрикса. Подобные изменения приводят к прогрессированию атеросклероза, ускоренному росту атеросклеротических бляшек, патологическому фиброзу миокарда с последующим развитием сердечной недостаточности.
В статье рассматривается участие КПГ и их рецепторов в развитии сердечно-сосудистых заболеваний при сахарном диабете.
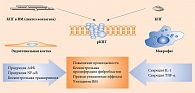
Участие конечных продуктов гликирования в формировании атеросклеротической бляшки
Конечные продукты гликирования (КПГ) – гетерогенная группа молекул, которые образуются в результате неферментативного гликирования и окисления белков, липидов и нуклеиновых кислот. К ним также относятся карбонильные соединения – продукты их деградации [1, 2]. Хорошо изученными КПГ являются пентосидин – производное перекрестного связывания белков и N-карбоксиметил-лизин (N-carboxymethyllysine – CML). Необходимо отметить, что именно флуоресценция пентосидина лежит в основе неинвазивных методов исследования уровня КПГ [3]. Однако чаще для определения уровня CML и КПГ используют иммуноферментный анализ.
В процессе образования КПГ выделяют несколько этапов. Сначала глюкоза связывается со свободными аминогруппами с формированием оснований Шиффа. Затем основания переходят в более стабильные продукты Амадори и в конечном итоге в разные по структуре КПГ – конечные продукты реакции Майяра. Образование КПГ в белках происходит в течение нескольких месяцев, поэтому их накопление больше характерно для медленно обменивающихся белков.
КПГ труднорастворимы, устойчивы к протеолитическому расщеплению, активны химически.
Данные молекулы способны менять функции и свойства тканей. Это достигается патологической сшивкой белков внутриклеточного и межклеточного матрикса [3, 4] путем связывания с рецептором КПГ (рКПГ).
С возрастом накопление КПГ в организме повышается. На это влияют как эндогенные, так и экзогенные факторы. Так, табачный дым и длительная термическая обработка стимулируют генерацию продуктов гликоокисления и липоокисления [5, 6]. Кроме того, при наличии определенных патологических состояний, например сахарного диабета (СД) или почечной недостаточности, скорость гликирования значительно увеличивается и количество КПГ достигает критических значений [7, 8].
Известно, что КПГ приводят к декомпенсации СД 2 типа. Кроме того, они признаны предикторами риска развития сердечно-сосудистых заболеваний. Избыток КПГ отвечает за такой феномен, как метаболическая память.
Образование КПГ – один из процессов, ассоциированных со старением клетки. Их воздействие преимущественно направлено на долгоживущие белки. Именно поэтому в настоящее время КПГ также рассматриваются как один из возможных биомаркеров старения.
Таким образом, изучение свойств и роли КПГ в патофизиологических процессах имеет важное значение, в том числе для разработки методов снижения риска развития сердечно-сосудистых заболеваний как основной причины смерти у пациентов с СД 2 типа [9].
Механизм действия конечных продуктов гликирования на ткани
Интерес к реакции Майяра, или взаимодействию глюкозы с белками, появился в середине 1990-х гг., после того как в условиях in vivo было установлено, что глюкоза способна модифицировать белки без участия ферментов [8]. Эффекты КПГ на ткани реализуются посредством трех основных механизмов:
- скрещивание внеклеточных (матричных) белков, влияющих на механические свойства тканей [7, 9];
- образование измененных поперечных межмолекулярных связей внутриклеточных белков, что приводит к их патологической функции [10, 11];
- связывание с рКПГ на клеточной поверхности для индуцирования множества внутриклеточных сигнальных каскадов [8, 9].
В большей степени неферментативному гликированию подвергаются белки внеклеточного матрикса (ВМ) (особенно коллаген 4-го типа) [8–10]. Коллаген относится к долгоживущим белкам и является основным компонентом внеклеточного матрикса [11]. Коллагеновые нити образуют каркас для кожи, сухожилий, кровеносных сосудов, костной ткани, роговицы и стекловидного тела, а также являются основой большинства паренхиматозных органов. Гликирование белков внеклеточного матрикса – коллагена и эластина делает их более жесткими и менее восприимчивыми к протеолитическому расщеплению [5]. Это может способствовать увеличению жесткости сосудов, наблюдающейся у пациентов старшей возрастной группы и с хронической гипергликемией [8, 9].
Коллаген 1-го типа – основной органический компонент костной матрицы подвергается серии посттрансляционных модификаций, больше характерных для процессов старения. Это приводит к миграции миофибробластов и формированию фиброза [7]. Согласно результатам последних исследований, артериосклероз является следствием гликирования коллагеновых цепей в артериолах мышечного типа, вызванного образованием поперечных связей между коллагеновыми волокнами [11]. Ключевая роль КПГ в старении кожи подтверждена H. Pageon и соавт., проводивших эксперимент на модели восстановленной кожи, модифицированной гликированием коллагена [6]. S. Zeiman и соавт., а также R. Candido и соавт. показали, что под воздействием КПГ изменяются свойства миокардиального коллагена, что приводит к развитию диастолической дисфункции [5, 12]. Подобные изменения обусловливают утолщение базальной мембраны, например в мезангиальном матриксе почек, что вызывает развитие почечной недостаточности при СД [13].
Гликирование влияет и на структуру липопротеинов низкой плотности (ЛПНП). Наиболее интенсивное разрушение ЛПНП и продуктов реакции Майяра происходит в макрофагах. При этом наблюдается активация эндоцитоза и синтеза многих регуляторных молекул, в том числе инсулиноподобного фактора роста 1 и фактора роста тромбоцитов, являющихся стимуляторами деления фибробластов, гладкомышечных и мезангиальных клеток [13]. Таким образом, создаются условия для образования большого количества пенистых клеток и последующего запуска атеросклеротических изменений в сосудистой стенке (рисунок) [14, 15].
Накопление КПГ приводит к бесконтрольному синтезу провоспалительных цитокинов и молекул адгезии, которые влияют на рост атеросклеротических бляшек [16, 17]. Речь, в частности, идет об интерлейкине (IL) 1α, IL-6, факторе некроза опухоли (Tumor Necrosis Factor – TNF) α, молекулах межклеточной адгезии 1, молекулах адгезии сосудистых клеток 1, факторах роста эндотелия сосудов, эндотелине 1, тканевом факторе, E-селектине, тромбомодулине [18, 19].
Запуск патогенетического каскада осуществляется при взаимодействии КПГ с их рецепторами и последующем фосфорилировании p21ras, митоген-активированных протеинкиназ, внеклеточной сигнально-регулируемой киназы 1/2, p38 и активации GTPases Cdc42 и Rac. Это в конечном итоге стимулирует миграцию транскрипционного фактора NF-κB к ядру, где он начинает транскрибировать собственный целевой набор генов [20].
Рецепторы конечных продуктов гликирования и их роль
В качестве специфических рКПГ рассматриваются различные мембранные белки. Это белки, принадлежащие к суперсемейству иммуноглобулинов, которые выполняют функцию рецепторов для гликозилированных молекул КПГ [21]. Однако были обнаружены и другие лиганды к рКПГ, включая семейство белков S100 [22], амилоид b [23, 24] и агрегаты фибриллярных белков [25, 26].
Рецепторы КПГ играют важную роль в развитии состояний, ассоциированных с участием перечисленных лигандов, например в повреждении сосудистой стенки, канцерогенезе, нейродегенерации и амилоидозах [25, 27–29]. Сообщалось, что ген рКПГ расположен на шестой хромосоме между генами, кодирующими основные комплексы гистосовместимости второго и третьего классов [30].
Связывание КПГ с их рецепторами приводит к эндотелиальной дисфункции вследствие активации ряда сигнальных путей, например никотинамидадениндинуклеотидфосфатоксидазы, которая усиливает образование активных форм кислорода (АФК) [31]. Последние образуются в результате митохондриального дыхания и клеточного метаболизма. В малых количествах, считающихся физиологичными, АФК задействованы в таких процессах, как индукция стрессорных белков и ферментов, синтез и распад цитокинов, рост, деление и дифференцировка клеток, антимикробный, противовирусный, противоопухолевый эффекты, старение и гибель клеток, разрушение поврежденных молекул, межклеточного вещества, регуляция репаративных процессов, продукция коллагена [32]. Необходимо отметить, что АФК, столь опасные согласно свободнорадикальной теории старения, вырабатываются организмом целенаправленно [33]. Было показано, что АФК играют ключевую роль в развитии сердечно-сосудистых осложнений за счет изменения структуры клеточных белков, липидов и нуклеиновых кислот и, следовательно, их физиологических функций [34].
В настоящее время известно несколько типов рКПГ. В частности, рКПГ-1 при связывании с КПГ инактивируется, что приводит к деградации лиганда. Снижение экспрессии рКПГ-1 ассоциируется с ускорением гломерулярной дисфункции при СД 2 типа [34] и активацией циркулирующих мононуклеарных клеток при высоких значениях КПГ у лиц с тяжелыми осложнениями СД 2 типа [35]. Функция рКПГ-3 (семейство углевод-связывающих белков) напрямую зависит от длительности и степени гипергликемии. При инактивированном рКПГ-3 достоверно чаще развивается диабетическая нефропатия [36].
Сердечно-сосудистая система
Образование КПГ в тканях ускоряет иммуновоспалительные реакции и перекисное окисление липидов, что в условиях хронической гипергликемии приводит к декомпенсации СД.
Кроме того, накопление КПГ связано не только с ранним развитием сердечно-сосудистых осложнений, но и с более негативным прогнозом в отношении выживаемости.
Так, E.Y. Choi и соавт., изучавшие в течение пяти лет уровень КПГ в сыворотке крови 203 пациентов, перенесших чрескожное коронарное вмешательство, установили, что высокие значения КПГ являются независимым фактором риска развития рестеноза при СД 2 типа (отношение шансов – 2,659 при 95%-ном доверительном интервале (ДИ) 1,431–4,940, p = 0,002) [37]. Уже через шесть месяцев у пациентов с высокими значениями КПГ (> 170 Ед/мл) частота рестенозирования была значительно выше (р
Увеличение уровня КПГ у пациентов с СД 1 типа влияло на частоту развития сердечно-сосудистых событий, независимо от наличия других факторов риска, таких как возраст, индекс массы тела, курение, артериальная гипертензия и гиперлипидемия [43].
Согласно результатам проспективного исследования EURODIAB, у больных СД 1 типа увеличение артериального давления было напрямую связано с высокими значениями КПГ [44]. У больных СД уровень рКПГ коррелировал с толщиной комплекса «интима – медиа» брахиоцефальных артерий [45]. В нескольких экспериментальных исследованиях установлено, что КПГ могут участвовать в образовании неоинтимы в месте повреждения. Z. Zhou и соавт. отметили, что у крыс, больных СД, при значительном увеличении уровня КПГ повышалась иммунореактивность рКПГ и S100/calgranulins в ответ на травматическое воздействие баллона в сонной артерии [46].
В условиях in vitro и in vivo предотвращение связывания рКПГ с лигандом снижало пролиферацию эндотелиоцитов.
КПГ также могут оказывать влияние на целостность структуры сосудистой стенки. В частности, чрезмерное гликирование молекул ВМ, таких как коллаген, может нарушать как клеточно-мембранные, так и межмембранные взаимодействия [47].
Для диабетической кардиомиопатии характерны гипертрофия и формирование патологического фиброза миокарда, что в конечном итоге приводит к диастолической дисфункции. Доказано, что эти процессы напрямую зависят от степени компенсации углеводного обмена, скорости снижения уровня гликированного гемоглобина. Однако в настоящее время в качестве основной причины ее развития рассматривают накопление КПГ [48]. Взаимодействие КПГ с внутриклеточными белками, в частности с основным фактором роста фибробластов (Basic Fibroblast Growth Factor – β-FGF), значительно стимулирует фиброзирование миокарда [49]. β-FGF – мощный модулятор клеточной дифференцировки, пролиферации и подвижности клеток [50].
Активация фибробластов в условиях гипергликемии обусловлена ускорением полиолового шунта, значительным повышением концентрации глюкозо-6-фосфата, фруктозы и фруктозо-3-фосфата, активацией С-протеинкиназы, окислительного стресса и гликирования факторов роста фибробластов [51, 52]. При неферментативном анаэробном гликолизе внутри клетки накапливаются дикарбонилы, которые признаются одними из основных участников сшивания белков [53]. Это приводит к патологической, бесконтрольной работе фибробластов. Они начинают активно пролиферировать, разрушать старый и синтезировать новый коллаген. Это приводит к перестройке стенки сосудов и, как следствие, к фиброзу.
На индукцию фиброза также влияют рКПГ – регулируют трансформирующий фактор роста β (Transforming Growth Factor β – TGF-β) [53]. Гликирование TGF-β увеличивает синтез коллагена 3, 4 (α-3), 5 и 6-го типов, а также ламинина и фибронектина в ВМ [54]. R. Petrova и соавт. обнаружили, что чрезмерная экспрессия рКПГ у трансгенных особей снижала внутриклеточную концентрацию кальция как во время систолы, так и во время диастолы [55]. Была также выявлена обратная связь между уровнем КПГ в перикардиальной жидкости и фракцией выброса левого желудочка [56, 57].
Метилгексилированные производные КПГ активируют мРНК кардиальных рКПГ, что стимулирует развитие сократительной дисфункции кардиомиоцитов. Накопление метилгексилированных производных КПГ приводит к деполяризации митохондриального мембранного потенциала, снижению инактивации гликоген синтазы киназы 3β в миокарде, что вызывает замедление регенерации (TR90) [58]. Стимуляция рецепторов γ, активируемых пероксисомными пролифераторами (Peroxisome Proliferator-Activated Receptors γ – PPAR-γ), способствует снижению уровня рКПГ.
В ряде работ были проанализированы эффекты агониста PPAR-γ (росиглитазон) у животных. Полученные данные свидетельствовали о важной роли рКПГ в инициации фиброза [59].
В исследовании, проведенном R.D. Semba и соавт., было подтверждено участие КПГ и их рецепторов в развитии сердечно-сосудистых заболеваний в период постменопаузы [60]. Высокий уровень КПГ (95% ДИ 1,08–3,48, р = 0,026) и рКПГ (95% ДИ 0,98–1,65, р = 0,07) также ассоциировался с высокой смертностью среди женщин старшей возрастной группы, имевших нарушения углеводного обмена. В другом исследовании, проведенном Y. Koyama и соавт., установлено, что сывороточные уровни рКПГ коррелировали с классами Функциональной классификации хронической сердечной недостаточности Нью-Йоркской ассоциации кардиологов и низкой фракцией выброса [61]. Выдвинуто предположение, что рКПГ являются независимым фактором развития диастолической дисфункции.
K. Sugaya и соавт. подтвердили участие КПГ в воспалительных процессах. В частности, в исследовании (длительность наблюдения – 18 лет) выявлена связь между высокими значениями сывороточного КПГ и увеличением количества летальных случаев у пациенток с СД 2 типа в исходе ишемической болезни сердца [30].
Особый интерес представляют результаты иммуногистохимического анализа и вестерн-блоттинга 60 атеросклеротических бляшек, полученных в результате каротидной эндартерэктомии. Так, при СД 2 типа уровень макрофагов, рКПГ, Т-лимфоцитов, HLA-DR+, NF-κB, COX-2/mPGES-1, липидов и MMP был достоверно выше (р
В исследовании in vivo дезактивирование рКПГ ассоциировалось со снижением степени повреждения миоцитов, о чем свидетельствовало уменьшение уровня ЛПНП, продуктов с низким содержанием гликозидов – CML и пентосидина, улучшение скорости функционального восстановления и синтеза аденозинтрифосфата [63]. Более того, согласно результатам иммуногистохимического исследования, у мышей с модифицированным рКПН, несмотря на наличие СД 2 типа, активность ключевых маркеров апоптоза, таких как каспаза-3 и цитохром С, была снижена.
Отмечено негативное влияние КПГ на рецепторы рианодина [4] и SER-CA2a [5] в кардиомиоцитах. Нарушение их функции приводит к изменениям гомеостаза кальция и последующему развитию диабетической кардиомиопатии [35, 36]. Фибриноген состоит из трех пар неидентичных цепей, стабилизированных несколькими дисульфидными связями. Известно, что концентрация фибриногена и скорость образования сгустка не зависят от наличия нарушений углеводного обмена [58], однако при диабете высокие уровни КПГ обусловливают нарушение гомеостаза и активацию атеросклеротических процессов. Гликирование фибриногена, активного участника свертывающей системы крови, приводит к замедлению фибринолиза и образованию в дальнейшем тромбогенной фибриновой сети [57].
Заключение
Ускоренное гликирование белков и накопление КПГ играют важную роль в патогенезе сердечно-сосудистых заболеваний у пациентов с СД. КПГ следует рассматривать в качестве маркеров развития воспалительных процессов и окислительного стресса.
Изучение механизмов регуляции взаимодействия КПГ и их рецепторов позволит разработать методы предотвращения развития осложнений, связанных с хронической гипергликемией.
Источник
