Особенности белкового обмена при сахарном диабете
НАРУШЕНИЯ УГЛЕВОДНОГО ОБМЕНА в основном заключаются в следующем:
1) затруднение транспорта глюкозы в мышечную и жировую ткань;
2) угнетение окисления глюкозы по пути фосфорилирования в связи со снижением активности ключевых ферментов, превращения глюкозы (гексокиназы, гликокиназы);
3) понижение синтеза гликогена в печени в связи со снижением активности гликокиназы;
4) усиление глюконеогенеза.
Следствием всех этих прцессов является развитие основного симптома сахарного диабета – гипергликемии.
Основной путь превращения глюкозы в физиологических условиях – это путь окислительного фосфорилирования, осуществляемый под действием инсулина. В условиях его дефицита процесс окисления глюкозы по пути фосфорилирования угнетается и увеличивается удельный вес других путей обмена глюкозы. В частности, начинает преобладать анаэробное расщепление глюкозы. В результате в тканях образуется в повышенном количестве молочная кислота. Выделение ее в кровь ведет к развитию гиперлактацедемии, усугубляющей диабетический ацидоз. Кроме того, усиливается превращение глюкозы по сорбитоловому пути и, соответственно, накапливаются продукты этого превращения (сорбитол и фруктоза).
Сорбитоловый путь превращения глюкозы характерен для хрусталика глаза, нервной ткани, эндотелия сосудов. Накопление сорбитола и фруктозы в тканях способствует развитию осложнений сахарного диабета (катаракта, полинейропатия, ангиопатия).
При диабете увеличивается также использование глюкозы в образовании гликопротеидов (белков, составляющих базальную мембрану сосудов), что играет важную роль в патогенезе микроангиопатий.
Гипергликемия вызывает гликозилирование различных белков: гемоглобин, альбумин, белки базальной мембраны сосудов, что приводит к изменению их свойств, повышению иммуногенности и имеет значение в развитии сосудистых поражений.
Повышение уровня глюкозы в крови выше почечного порога (9,5-10 ммоль/л) сопровождается выделением сахара с мочой – глюкозурией, которая тем выше, чем интенсивнее гипергликемия. Выделение глюкозы с мочой сопроваждается увеличением диуреза. Глюкоза увлекает за собой жидкость в связи с повышением осмотического давления в провизорной моче и снижением реабсорбции мочи в канальцах почек. На каждый грамм глюкозы выделяется 20-40 мл жидкости. Таков механизм полиурии. Полидипсия при диабете вторичного происхождения. Она связана с интенсивным обезвоживанием организма.
Одновременно нарушается ВОДНО-СОЛЕВОЙ ОБМЕН. Больной теряет калий и натрий, усиление диуреза приводит к дегидратации.
НАРУШЕНИЕ ЖИРОВОГО ОБМЕНА при дефиците инсулина сводится к снижению синтеза жира и усилению липолиза. В результате мобилизации жира из депо развивается гиперлипидемия. Избыточный жир откладывается в бедных гликогеном гепатоцитах, вызывая жировую инфильтрацию печени. В кровь выделяются в повышенных количествах неэстерифицированные жирные кислоты, заменяющие глюкозу в качестве энергетического материала.
В печени, в условиях пониженного содержания гликогена, уменьшено превращение ацетил-Кол, а в цикле Кребса образуются в повышенном количестве недоокисленные продукты жирового обмена – кетоновые тела (оксимасляная кислота, ацетоуксусная кислота, ацетон). Развивается характерный для декомпенсации сахарного диабета кетоацидоз.
НАРУШЕНИЕ БЕЛКОВОГО ОБМЕНА заключается в угнетении синтеза белка и повышенном его распаде. Вследствие угнетения синтеза белка в детском возрасте наблюдается задержка роста.
В печени белок интенсивно превращается в углеводы. В процессе этого превращения диспротеинемии в сторону преобладания глобулиновых фракций образуются продукты распада (аммиак, мочевина, аминокислоты). Поступая в кровь, они обуславливают гиперазотемию.
При сахарном диабете вследствие нарушения белкового обмена снижается продукция защитных белков, что приводит к снижению иммунитета. Компенсация нарушений углеводного обмена, как правило, значительно улучшает показатели белкового, жирового и водно-солевого обмена. Однако нередко в клинической практике приходится прибегать к специальному лечению этих нарушений.
Нарушения жирового обмена. При инсулин ов ой недостаточности уменьшаются поступление глюкозы в жировую ткань и образование жира из углеводов, снижается ресинтез триглицеридов из жирных кислот. Усиливается липолитический эффект СТГ, который в норме подавляется инсулином. При этом повышается выход из жировой ткани неэстерифицированных жирных кислот и .снижается отложение в ней жира, что ведет к исхуданию и повышению содержания в крови неэстерифицированных жирных кислот. Данные кислоты в печени ресинте-зируются в триглицериды, создается предпосылка для жировой инфильтрации печени. Этого не происходит, если в поджелудочной железе (в клетках эпителия мелких протоков) не нарушена продукция липокаина. Последний стимулирует действие липотроп-ных пищевых веществ, богатых метиони-ном (творог, баранина и др.). Метионин — донатор метильных групп для холина, входящего в состав лецитина, при посредстве которого жир выводится из печени. Сахарный диабет, при котором не нарушена продукция липокаина, называется островковым. Ожирения печени при этом не происходит. Если дефицит инсулина сочетается с недостаточной продукцией липокаина, развивается тотальный диабет, сопровождающийся ожирением печени. В митохондриях печеночных клеток из неэстерифицированных жирных кислот интенсивно образуются кетоновые тела.
Кетоновые тела. К ним относятся ацетон, ацетоуксусная и р-оксимасляная кислоты. Они сходны по строению и способны к взаимопревращениям (рис. 49). Кетоновые тела образуются в печени, поступают в кровь и оттуда — в легкие, мышцы, почки и другие органы и ткани, где окисляются в цикле трикарбоновых кислот до СОз и воды. В сыворотке крови должно содержаться 0,002—0,025 г/л кетоновых тел (в пересчете на ацетон).
В механизме накопления кетоновых тел при сахарном диабете имеют значение следующие факторы:
1) повышенный переход жирных кислот из жировых депо в печень и ускорение окисления их до кетоновых тел;
2) задержка ресинтеза жирных кислот из-за дефицита НАДФ;
3) нарушение окисления кетоновых тел, обусловленное подавлением цикла Кребса, от участия в котором в связи с усиленным глюконеогенезом «отвлекаются» щавелевоуксусная и а-кетоглютаровая кислоты.
При сахарном диабете концентрация кетоновых тел возрастает во много раз (гиперкетонемия) и они начинают оказывать токсическое действие. Кетоновые тела в токсической концентрации инактивируют инсулин, усугубляя явления инсулиновой недостаточности. Создается «порочный круг». Гиперкетонемия — это декомпенсация обменных нарушений при сахарном диабете. Наиболее высока концентрация ацетона, которая у большинства больных в 3—4 раза превышает концентрацию ацетоуксусной и (3-рксимасляной кислот. Ацетон оказывает повреждающее влияние на клетки, растворяет структурные липиды клеток, подавляет активность ферментов, резко угнетает деятельность центральной нервной системы. Гиперкетонемия играет важную роль в патогенезе очень тяжелого осложнения сахарного диабета — диабетической комы. Для нее характерна потеря сознания, частый пульс слабого наполнения, падение артериального давления, периодическое дыхание (типа Куссмауля), исчезновение рефлексов. Диабетическая кома сопровождается выраженным негазовым (метаболическим) ацидозом. Щелочные резервы плазмы крови исчерпываются, ацидоз становится некомпенсированным, рН крови падает до 7,1— 7,0 и ниже. Кетоновые тела выводятся с мочой в виде натриевых солей (кетонурия). При этом повышается осмотическое давление мочи, что способствует полиурии. Концентрация натрия в крови уменьшается. Кроме того, при дефиците инсулина снижается реабсорб-ция натрия в почечных канальцах. Поэтому при резком снижении уровня сахара в крови в результате интенсивной инсулино-терапии коматозного состояния может резко снизиться суммарное осмотическое давление крови. Возникает опасность развития отека мозга. При сахарном диабете нарушается холестериновый обмен. Избыток ацетоуксусной кислоты идет на образование холестерина — развивается гйперхолестеринемия.
Нарушения белкового обмена. Синтез белка при сахарном диабете снижается, так как:
1) выпадает или резко ослабляется стимулирующее влияние инсулина на энзи-матические системы этого синтеза;
2) снижается уровень энергетического обмена, обеспечивающего синтез белка в печени;
3) нарушается проведение аминокислот через клеточные мембраны.
При дефиците инсулина снимается тормоз с ключевых ферментов глюконеогенеза и происходит интенсивное* образование глюкозы из аминокислот и жира. При этом аминокислоты теряют аммиак, переходят в а-кетокислоты, которые идут на образование углеводов. Накапливающийся аммиак обезвреживается за счет образования мочевины, а также связывания его а-кето-глютаровой кислотой с образованием глута-мата. Возрастает потребление а-кетоглютаровой кислоты, при недостатке которой снижается интенсивность цикла Кребса. Недостаточность цикла Кребса способствует еще большему накоплению ацетил-КоА и, следовательно, кетоновых тел. В связи с замедлением тканевого дыхания при диабете уменьшается образование АТФ. При недостатке АТФ снижается способность печени синтезировать белки.
Таким образом, при инсулиновой недостаточности распад белка преобладает над синтезом. В результате этого подавляются пластические процессы, снижается продукция антител, ухудшается заживление ран, понижается устойчивость организма к инфекциям. У детей происходит задержка роста. При дефиците инсулина развиваются не только количественные, но и качественные нарушения синтеза белка, в крови выявляются измененные необычные белки-парапротеины, гликозилированные белки. С ними связывают повреждение стенки сосудов — ангиопатии. Ангиопатии играют важнейшую роль в патогенезе ряда тяжелых осложнений сахарного диабета (недостаточность коронарного кровообращения, ретинопатия и др.).
В человеческом организме постоянно протекают сложные биохимические реакции, отвечающие за работу наших органов и систем, состав крови, состояние мышц, костей, связок, нервов, слизистых оболочек. В этих реакциях участвуют вещества, поступающие с пищей и питьем – вода, углеводы, белки, жиры. Организм тратит их на свои нужды, перерабатывая тем или иным способом. И освобождается от отходов своей жизнедеятельности через почки, печень, кожу, легкие. Этот процесс протекает постоянно и называется обменом веществ или метаболизмом.
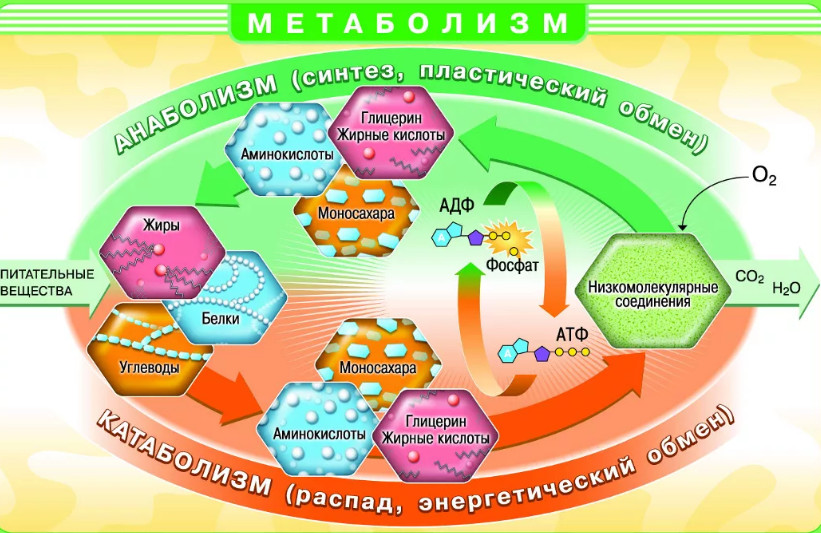
Метаболизм – совокупность взаимосвязанных биохимических реакций
У детей и молодых людей обменные реакции протекают быстро, так как растущему и формирующемуся организму нужно больше энергии и «строительного материала». С возрастом метаболизм замедляется.
Если у вас нет генетической предрасположенности к нарушению обмена веществ или это не произошло вследствие какого-либо заболевания, если вы ведете здоровый образ жизни, т.е. не переедаете, не курите, не злоупотребляете алкоголем, полноценно отдыхаете, следите за весом, то ваши органы в любом возрасте справятся со своими задачами и вы сможете адаптироваться к изменениям окружающих условий, физическим и эмоциональным нагрузкам.
При нарушении обмена веществ организм теряет способность правильно функционировать. Проявления нарушения метаболизма зависят от того, в какой биохимической цепочке произошел «сбой» и чем он вызван.
Метаболические процессы регулируется последовательно нервной, эндокринной и внутриклеточными регуляторными системами. Железы эндокринной системы вырабатывают особые вещества – гормоны, которые передают сигналы центральной нервной системы клеткам организма.
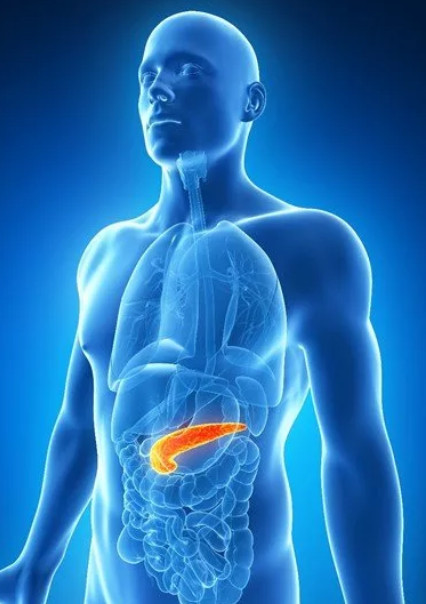
Поджелудочная железа вырабатывает гормон инсулин, регулирующий метаболизм углеводов, жиров и белков
Гормон поджелудочной железы инсулин играет ведущую роль в обмене углеводов, жиров и белков. Все эти виды метаболизма нарушаются, если железа не может вырабатывать инсулин в нужном количестве и качестве, или если клетки нашего тела перестают на него реагировать. Таким образом, у больных сахарным диабетом любого типа нарушен углеводный, жировой и белковый обмен.
Метаболические нарушения при сахарном диабете
Диабет 1 типа (СД1) развивается преимущественно у детей и молодых людей, чаще у мальчиков. Метаболические нарушения в данном случае связаны с недостатком выработки инсулина или ее полным прекращением. Заболевание стартует быстро, нередко – стремительно, проявляясь:
- резкой потерей веса в сочетании с полифагией (постоянным чувством голода) на первых стадиях болезни;
- учащенным мочеиспусканием, возможно ночное недержание мочи (энурез) – следствие глюкозурии (появления сахара в моче);
- сухостью во рту, жаждой – следствие гипергликемии (высокого содержания сахара в крови);
- сухостью кожи и слизистых оболочек, ломкостью ногтей;
- частыми простудами, высоким риском воспаления легких и туберкулезной инфекции;
- изменениями со стороны сердечно-сосудистой системы (миокардиодистрофией) – результат дефицита калия, аминокислот, фосфатов, негативного влияния на сердечную мышцу недостатка кислорода, токсинов;
- тошнотой, рвотой, жировой инфильтрацией печени и ее увеличением (гепатомегалией) с последующим развитием цирроза при отсутствии адекватного лечения;
- раздражительностью, утомляемостью.
Как улучшить обмен веществ при диабете 1 типа?
Поскольку тканевой обмен в данном случае не нарушен, контролировать обменные процессы у диабетиков 1 типа помогает грамотный подбор типа и дозы инсулина, а также схемы инсулинотерапии с учетом особенностей течения заболевания.

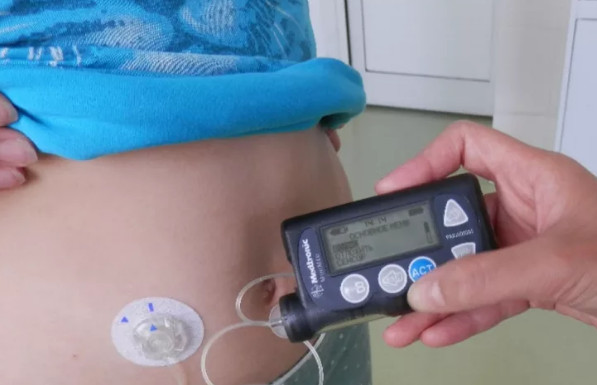
Инсулиновая помпа – электронное устройство, позволяющее гибко и плавно регулировать дозу инсулина
Метаболические нарушения при сахарном диабете 2 типа (СД2) развиваются постепенно, «исподтишка» и, как правило, начинают вызывать беспокойство только тогда, когда процесс уже зашел достаточно далеко.
Нарушение обмена веществ у больных сахарным диабетом второго типа сопровождается ожирением, поражением нервов и сосудов, печени, почек, кожи и слизистых, остеопрозом. Наиболее грозные и часто встречающиеся осложнения – инсульт, инфаркт, ретинопатия, нейропатия, нефропатия, жировой гепатоз, диабетическая стопа.
Корректировать состояние больных с этой формой диабета сложнее, так как у них развивается инсулинрезистентность, то есть гормон теряет способность «давать указания» механизмам клеточной регуляции метаболических процессов. Поэтому диабет второго типа также называют инсулиннезависимым, а инсулинотерапия таким пациентам назначается только в том случае, если проблема обнаружена на поздней стадии и поджелудочная железа не в состоянии самостоятельно выработать достаточное количество гормона.
В начале же заболевания основной упор делается на улучшение обмена веществ на тканевом уровне.
Как улучшить метаболизм у диабетика с СД2?
В настоящее время существует ряд лекарственных препаратов, возвращающих мышечным клеткам диабетиков чувствительность к инсулину. Если такая лекарственная терапия начата своевременно, врачам удается взять заболевание под контроль.
Параллельно с лекарствами для улучшения метаболизма больным диабетом второго типа назначаются периодические курсы физиотерапевтического лечения, специальная диета с низким количеством легко усваиваемых (быстрых) углеводов и животных жиров, дозированные физические нагрузки – ходьба (не мнее получаса в день), плавание. Также необходимо соблюдать режим труда и отдыха, хорошо высыпаться по ночам.
Важность качества ночного сна для больных с метаболическими нарушениями
Во время ночного сна наши мышцы отдыхают, а регуляторные системы восстанавливаются. Чтобы их восстановление было полным, и обменные процессы протекали как положено, мы должны:
- спать в тишине, в прохладном, хорошо проветриваемом помещении в темное время суток не менее 7-8 часов;
- во время ночного сна дышать свободно и ровно.

Качественный здоровый ночной сон помогает улучшить метаболизм и снижает риск развития диабета
Важность полноценного ночного отдыха для нормального метаболизма чрезвычайно велика. Например, если у человека с сонным апноэ отмечается снижение толерантности к глюкозе, то нормализация процесса дыхания во время ночного сна:
- становится основой для восстановления углеводного и жирового обмена;
- создает условия для похудения, увеличения физической выносливости.
В результате опасность развития сахарного диабета значительно уменьшается – старт заболевания удается, как минимум, отложить на долгие годы.
Наличие сахарного диабета (СД) 2–го типа обусловливает высокий риск сердечно–сосудистых осложнений, также в большинстве случаев это заболевание сочетается с другими патологиями сердечно–сосудистой системы, такими как артериальная гипертензия, ишемическая болезнь сердца и гиперхолестеринемия. Кроме того, длительная неудовлетворительная компенсация СД приводит к развитию в том числе макрососудистых осложнений, впоследствии являющихся причиной неблагоприятных исходов. Результаты UKPDS (the United Kingdom Prospective Diabetes Study) показали, что интенсивный контроль гликемии достоверно снижает риск микрососудистых осложнений диабета, но не оказывает значимого влияния на макрососудистые осложнения и общую смертность [1]. Эти выводы подтверждают необходимость комплексного контроля гликемии, артериального давления, а также уровня липидов крови. Для поддержания концентрации липидов крови на нужном уровне в первую очередь применяются статины, эффективность которых неоднократно доказана в крупных клинических исследованиях (табл. 1). В настоящее время возможности применения статинов далеко не ограничены гиперхолестеринемией, которая была первым показанием к назначению статинов. Одновременно расширился спектр заболеваний, при которых показана терапия статинами. В последнее время обсуждаются аспекты применения статинов в управлении СД 2–го типа (СД–2).
Особенности липидного спектра при СД–2 характеризуется «липидной триадой», которая включает увеличение концентрации триглицеридов, снижение уровня холестерина липопротеинов высокой плотности (ЛВП) и преобладание в крови мелких плотных частиц липопротеинов низкой плотности (ЛПНП) фенотипа В при пограничных значениях ХС ЛПНП [2]. Такое состояние является следствием следующих событий: в результате инсулинорезистентности и недостаточной секреции инсулина нарушается постпрандиальная регуляция липидов, повышается уровень свободных жирных кислот (СЖК) в крови, увеличивается выработка ЛОНП печенью и снижается их гидролиз липопротеинлипазой, что приводит к росту количества богатых триглицеридами циркулирующих липопротеидных частиц. Вторично снижается концентрация ХС ЛПВП из–за повышенного переноса эфиров ХС из ЛПВП в ЛОНП и хиломикроны в обмен на триглицериды.
Одним из основных проявлений нарушения липидного спектра крови у больных СД–2 является увеличение количества мелких, плотных ЛПНП фенотипа В, обладающих повышенной атерогенностью, причем концентрация этих частиц резко нарастает при уровне триглицеридов >132 мг/дл. В целом, 30–40% пациентов с СД–2 имеют уровни триглицеридов >200 мг/дл и 10% имеют триглицериды >400 мг/дл. Так как при диабете преобладают мелкие плотные ЛПНП с низким содержанием ХС, то концентрация ХС ЛПНП у больных диабетом может не отличаться от уровня этого показателя у лиц без диабета. Однако из–за повышенной атерогенности мелких частиц при одном и том же уровне ХС ЛПНП у больных диабетом «коронарный» риск существенно выше [3,4]. Доказано, что уровень мелких плотных ЛПНП является независимым фактором риска ИБС. Высокой атерогенности мелких плотных ЛПНП способствуют малые размеры частиц, что облегчает их проникновение в сосудистую стенку через слой эндотелия, а также гипергликемия. Мелкие плотные ЛПНП характеризуются повышенной окисляемостью, в условиях окислительного стресса, характерного для СД–2, эта способность выражена еще ярче. Активизируемые мелкими плотными ЛПНП, макрофаги захватывают окисленные мелкие плотные ЛПНП и превращаются в обогащенные холестерином «пенистые» клетки. Мелкие плотные ЛПНП обладают также способностью активизировать процесс апоптоза гладкомышечных клеток, уменьшая их содержание в составе атеросклеротической бляшки. Таким образом, создаются условия для формирования особого типа атеросклеротических бляшек со сниженным содержанием гладкомышечных клеток и повышенным содержанием в них активных макрофагов и большого липидного ядра. Это нестабильное образование состоит из эксцентрически расположенного липидного содержимого под тонкой рыхлой фиброзной оболочкой, которая может разорваться при высокой нагрузке. Подобный тип бляшки считается нестабильной атеросклеротической «бляшкой–убийцей» [5]. Следствием такого рода бляшек является развитие при СД–2 ранних и тяжелых осложнений ИБС при отсутствии выраженных поражений коронарных сосудов уже на ранних этапах формирования атеросклеротической бляшки [20].
Дислипидемия считается одним из наиболее важных прогностических факторов риска возникновения осложнений ССЗ у больных СД–2. В исследовании MRFIT риск смерти от ИБС среди больных диабетом был прямопропорционально связан с концентрацией общего холестерина и холестерина ЛПНП. Не было обнаружено порога, ниже которого уровень общего холестерина не коррелировал бы с уровнем риска смерти от ИБС. Данные исследования UKPDS также демонстрируют наличие взаимосвязи риска ИБС и концентрации холестерина ЛПНП у больных СД–2: увеличение концентрации холестерина ЛПНП на 1 ммоль/л сопровождается 1,57–кратным увеличением риска развития ИБС [6]. Осложнения ССЗ могут иметь другие последствия для больных СД–2 в сравнении с пациентами без диабета. СД–2 – независимый предиктор неблагоприятных исходов (смерть, инфаркт миокарда, повторная госпитализация в течение первого года) при остром коронарном синдроме. У больных СД–2 значительно чаще развивается острый инфаркт миокарда, чем у лиц без диабета, при этом размер инфаркта, как правило, больше, кроме того, чаще развиваются осложнения, такие, как застойная сердечная недостаточность и кардиогенный шок и хуже отдаленный прогноз после хирургической коронарной реваскуляризации. Известно, что после перенесенного инфаркта миокарда 40–50% больных СД умирает в течение ближайших пяти лет.
В настоящее время гиполипидемическими препаратами выбора в профилактике сердечно–сосудистых осложнений СД–2 являются статины. Их широкое применение при лечении дислипидемии у этой категории больных оправдано тем, что они обладают наиболее выраженным и мощным гипохолестеринемическим действием, имеют наименьшее число побочных эффектов и хорошо переносятся больными. Они не влияют на показатели углеводного обмена и не взаимодействуют с гипогликемическими препаратами [7].
Статины изучались в достаточно большом числе международных многоцентровых исследований, в которых оценивалось влияние терапии на такие события, как коронарная смерть, нестабильная стенокардия, острый инфаркт миокарда, повторные инвазивные вмешательства. Наиболее известное и цитируемое исследование по оценке влияния длительной терапии препаратом из группы статинов (симвастатином) на риск коронарных событий у больных ИБС – скандинавское исследование 4S (Scandinavian Simvastatin Survival Study), 1997 г. [8]. В него вошли 4444 больных с предшествующим инфарктом миокарда и/или стенокардией и высоким уровнем липидов (ХС 5,5–8 ммоль/л, ТГ менее 2,5 ммоль/л). Больные были рандомизированы на группы симвастатина в дозе 40 мг/сут. или плацебо, средняя продолжительность терапии 5,4 г. В результате исследования снижение риска общей смертности в группе симвастатина составило 30%, риска коронарной смерти – 42%. Симвастатин снизил общий холестерин на 25%, ЛПНП – на 35%, ЛПВП повысил на 8%. В последующем был произведен ретроспективный анализ в подгруппе больных СД (n=202), в которой применение симвастатина статистически значимо снизило риск основных коронарных событий (коронарной смерти и инфаркта миокарда) на 55%, а у больных ИБС без СД – на 32% [9].
Таким образом, в 4S было получено первое указание на то, что снижение общего ХС и ХС ЛПНП способно улучшить прогноз больных диабетом, страдающих ИБС. Снижение ХС ЛПНП сопровождалось уменьшением риска коронарных событий у обеих категорий больных, однако польза снижения липопротеинов у диабетиков оказалась выше, чем у лиц без диабета. Было отмечено также, что при диабете даже относительно невысокий исходный уровень ХС ЛПНП оказывается достаточным для развития клинических осложнений атеросклероза и что снижение концентрации общего ХС и ХС ЛПНП статинами снижает риск возникновения этих осложнений. Следует отметить также, что польза от лечения симвастатином может быть даже больше той, о которой можно судить на основании результатов испытания 4S, поскольку в это испытание не включались больные с тяжелым СД (50% больных СД контролировали гликемию с помощью диеты).
Анализ результатов применения статинов у пациентов с СД выявил необходимость более углубленного изучения их действия у этой категории больных. Предпосылкой к проведению исследования HPS (Heart Protection Study), 2003 г., послужил тот факт, что несмотря на высокий риск развития ССЗ и смерти от этих заболеваний при наличии СД липидоснижающая терапия не проводится, поскольку у таких больных уровень ХС ЛПНП в крови обычно не отличается от аналогичного показателя в общей популяции. В исследование HPS были включены 5963 больных СД, а также 14 753 больных с периферическим атеросклерозом без СД. Среди больных СД у 51% больных имелись признаки ИБС, у 49% (n=2912) отсутствовали признаки поражения сосудистого русла любой локализации. Уровень общего ХС в крови составлял не менее 3,5 ммоль/л (135 мг/дл). Пациенты были рандомизированы в группы симвастатина (40 мг/сут.) и плацебо. Средняя продолжительность лечения составила 5 лет. При анализе частоты возникновения первого неблагоприятного клинического исхода, связанного с поражением коронарных артерий, было показано, что в целом прием симвастатина по сравнению с плацебо статистически значимо снижал данный показатель на 27%. Степень снижения частоты развития такого неблагоприятного исхода оказалась одинаковой в подгруппе больных с СД и в подгруппе больных высокого риска, но без СД. При СД применение симвастатина по сравнению с плацебо статистически значимо снижало коронарную смертность на 20%, а частоту развития первого нефатального ИМ — на 37%. Риск сосудистых осложнений снизился на 33% среди больных СД без признаков атеросклероза и на 27% среди 2426 пациентов с СД, у которых исходный уровень ХС ЛПНП был ниже 3 ммоль/л. Степень снижения ЛПНП у пациентов с СД и без него была одинаковой. Таким образом, у больных с СД применение статинов статистически значимо снижает риск развития тяжелых ССЗ даже в отсутствие гиперхолестеринемии или клинических признаков ИБС [10].
Имеются результаты российских исследований эффективности и безопасности применения симвастатина у больных СД–2 пожилого возраста на примере препарата Вазилип [11]. Безопасность терапии статинами у данного контингента больных является актуальным вопросом, хотя довольно часто риск побочных явлений относительно эффективности использования статинов переоценен [12]. В результате исследования Вазилип показал выраженную гиполипидемическую активность: 60% больных достигли целевых уровней общего холестерина и ХС ЛПНП на фоне приема препарата в минимальной эффективной дозе 10–20 мг/сут. В течение 12 недель лечения не было отмечено тяжелых побочных реакций, требовавших отмены препарата.
Помимо многократно доказанной липидоснижающей эффективности статины (Вазилип) обладают рядом дополнительных полезных свойств. К другим эффектам статинов, способным повлиять на сердечно–сосудистый риск, относятся противовоспалительный, антиагрегантный и антиоксидантный. Перечисленные эффекты не зависят от гипохолестеринемического действия статинов, и значение их возрастает по мере получения все больших доказательств в пользу воспалительной теории атерогенеза [13]. В качестве подтверждения возможной роли плейотропных эффектов статинов в снижении риска сердечно–сосудистых событий многие рассматривают раннее проявление благоприятного клинического эффекта статинов: через 6 мес. после начала лечения в исследовании WOSCOPS, и через 7 мес. – в LIPID. Считается, что само по себе снижение уровня липидов сказалось бы на клиническом течении заболевания значительно позже [14]. Помимо влияния на риск осложнений ССЗ плейотропные эффекты статинов благоприятно сказываются на прогрессировании микрососудистых осложнений при СД. Эндотелиальная дисфункция лежит в основе сосудистых нарушений при СД и считается одной из ведущих причин поздних осложнений при СД–2. Статины обладают способностью улучшать функцию эндотелия, что подтверждено в международных и российских исследованиях. Одно из них было направлено на изучение эндотелиальной дисфункции у пациентов с СД–2 и артериальной гипертензией на фоне применения Вазилипа [15]. По результатам этого исследования 6–месячный прием препарата Вазилип оказал положительное воздействие на метаболизм оксида азота (NO) и содержание в крови ФНО–b – основных цитокинов, отражающих состояние эндотелия. В этом же исследовании в очередной раз получено доказательство высокой гиполипидемической эффективности препарата Вазилип у больных СД–2, причем достигнутый эффект сохранялся в течение всего времени наблюдения без изменения дозы препарата 10–20 мг/сут. Снижение концентрации ФНО–b в крови помимо улучшения эндотелиальной функции может способствовать повышению чувствительности тканей к инсулину, что крайне важно для больных СД–2. Кроме того, как показали результаты ряда российских исследований, статины способны повышать чувствительность периферических тканей к инсулину [16,17]. Следует отметить, что это свойство проявляется даже при использовании малых доз статинов и для этого не требуется продолжительного лечения. Таким образом, положительные эффекты применения статинов в управлении СД–2 заключаются не только в коррекции дислипидемии и снижении риска осложнений ССЗ, но и в улучшении функции эндотелия, антиагрегантном и антиоксидантном действии.
Cогласно EASD/European Society of Cardiologists Guidelines for Diabetes/Cardiovascular diseases, постоянное лечение статинами должно быть назначено большей части пациентов с СД–2 [18]. Основные положения, касающиеся холестеринснижающей терапии у больных СД–2, следующие:
• препаратами выбора при высоком уровне холестерина ЛПНП у больных СД являются статины;
• если у больного СД установлен диагноз ИБС, то терапию статинами надо начинать вне зависимости от исходного уровня холестерина ЛПНП до достижения целевых значений (<1,8–2,0 ммоль/л);
• терапию статинами больным СД–2 без установленной ИБС надо начинать, если уровень общего холестерина >3,5 ммоль/л;
• если лечение статинами в максимальных дозах не привело к достижению целевого уровня триглицеридов <2 ммоль/л, целесообразно присоединить терапию фибратами, никотиновой кислотой или эзетимибом.
Терапия статинами рекомендована Американской диабетологическая ассоциацией (АДА) независимо от исходного уровня липидов пациентам с сопутствующим ССЗ, пациентам старше 40 лет без ССЗ, если уровень ЛПНП более 2,6 ммоль/л, и пациентам без ССЗ, имеющим хотя бы один фактор риска развития ССЗ [19]. Согласно современным стратегиям липидоснижающей терапии у пациентов с СД–2, снижение холестерина ЛПНП считается первичной целью лечения (табл. 2). Для пациентов с СД–2 и ССЗ целевым уровнем холестерина ЛПНП считается 100 мг/дл (2,6 ммоль/л), также установлена цель 70 мг/дл (1,8 ммоль/л) для больных СД–2, имеющим высокий или очень высокий риск сердечно–сосудистых осложнений. Альтернативной терапевтической целью для пациентов, которым не удается достичь целевого уровня ЛПНП на максимально переносимых дозах статинов, является снижение уровня ЛПНП на 40% от исходного. Если уровень триглицеридов >500 мг/дл (5,5 ммоль/л), первоначально необходимо снизить концентрацию триглицеридов в крови <150 мг/дл (1,7 ммоль/л). Не менее важным компонентом гиполипидемической терапии считается повышение ЛПВП. Целевой уровень ЛПВП >40 мг/дл (1,0 ммоль/л) у мужчин и >50 мг/дл (1,3 ммоль/л) у женщин. Комбинированная терапия статинами и другими липидоснижающими препаратами может быть использована для достижения цели лечения, однако исследований комбинированной терапии, оценивающих ее безопасность и влияние на осложнения ССЗ, не проводилось.
Таким образом, в настоящее время есть убедительные научные доказательства и клинические данные, подтверждающие необходимость широкого использования статинов для активной первичной и вторичной профилактики атеросклероза у больных СД–2. Результаты исследований свидетельствуют о том, что гиполипидемическая терапия показана больным СД–2, даже если у них нет клинических признаков ИБС или высокого уровня ХС. Вазилип доказал свою эффективность у таких пациентов, а также хорошо зарекомендовал себя в ежедневной клинической практике.
Кроме того, терапия статинами может быть эффективна для предотвращения развития СД–2 и его микрососудистых осложнений, и потому должна занимать в лечении больных СД по меньшей мере такое же место, как контроль уровня глюкозы крови и артериального давления.
Литература
1. Stevens R.J., Kothari V., Adler A.I., Stratton IM. The UKPDS risk engine: a model for the risk of coronary heart disease in type II diabetes (UKPDS 56). Clin Sci (Lond) 2001;101:671—679.
2. Ho J.E., Paultre F., Mosca L. Is diabetes mellitus a cardiovascular disease risk equivalent for fatal stroke in women? Data from the Women’s Pooling Project. Stroke 2003;34:2812—2816.
3. Syvanne M., Taskinen M.–R. Lipids and lipoproteins as coronary risk factors in non–insulin–dependent diabetes mellitus. Lancet 1997;350 (Suppl. I):20–23.
4. Lehto S., Ronnemaa T., Haffner S.M., et al. Dyslipidemia and hyperglycemia predict coronary heart disease events in middle–aged patients with NIDDM. Diabetes 1997;46:1354–59
5. Sacks FM, Pfeffer MA, Moye LA, et al, for the Cholesterol and Recurrent Events Trial Investigators. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. N Engl J Med. 1996;335:1001–1009.
6. Berliner JA ey al: Atherosclerosis: Basic mechanisms, oxidation, inflammations, and genetics.Circulation, 1995; 91:2488.
7. Рекомендации ВНОК. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза (IV пересмотр)
8. Scandinavian Simvastatin Survival Study Group. Randomized trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994;344:1383–89.
9. Pyorala K., Pedersen T.R., Kjekshus J., et al. Cholesterol Lowering With Simvastatin Improves Prognosis of Diabetic Patients With Coronary Heart Disease: A subgroup analysis of the Scandinavian Simvastatin Survival Study (4S). Diabetes Care 1997;20:614–20.
10. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol–lowering with simvastatin in 5963 people with diabetes: a randomised placebo–controlled trial. Lancet 2003;361:2005–16.
11. Г?
