Островки лангерганса при сахарном диабете
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 апреля 2020;
проверки требует 1 правка.
Островки Лангерга́нса — скопления гормон-продуцирующих (эндокринных) клеток, преимущественно в хвостовой части поджелудочной железы. Открыты в 1869 году немецким патологоанатомом Паулем Лангергансом (1849—1888). Островки составляют приблизительно 1—2 % массы поджелудочной железы. Поджелудочная железа взрослого здорового человека насчитывает около 1 миллиона островков (общей массой от одного до полутора граммов), которые объединяют понятием орган эндокринной системы.
Историческая справка[править | править код]
Пауль Лангерганс, будучи студентом-медиком, работая у Рудольфа Вирхова, в 1869 году описал скопления клеток в поджелудочной железе, отличавшиеся от окружающей ткани, названные впоследствии его именем[2][3]. В 1881 году К. П. Улезко-Строганова впервые указала на эндокринную роль этих клеток[4]. Инкреаторная функция поджелудочной железы была доказана в Страсбурге (Германия) в клинике крупнейшего диабетолога Наунина Mering и Minkowski в 1889 году — открыт панкреатический диабет и впервые доказана роль поджелудочной железы в его патогенезе[3]. Русский учёный Л. В. Соболев (1876—1919) в диссертации «К морфологии поджелудочной железы при перевязке её протока при диабете и некоторых других условиях» показал, что перевязка выводного протока поджелудочной железы приводит ацинозный (экзокринный) отдел к полной атрофии, тогда как панкреатические островки остаются нетронутыми. На основании опытов Л. В. Соболев пришёл к выводу: «функцией панкреатических островков является регуляция углеводного обмена в организме. Гибель панкреатических островков и выпадение этой функции вызывает болезненное состояние — сахарное мочеизнурение»[3].
В дальнейшем благодаря ряду исследований, проведенных физиологами и патофизиологами в различных странах (проведение панкреатэктомии, получение избирательного некроза бета-клеток поджелудочной железы химическим соединением аллоксаном), получены новые сведения об инкреаторной функции поджелудочной железы.
В 1907 году Lane & Bersley (Чикагский университет) показали различие между двумя видами островковых клеток, которые они назвали тип A (альфа-клетки) и тип B (бета-клетки).
В 1909 году бельгийский исследователь Ян де Мейер предложил называть продукт секреции бета-клеток островков Лангерганса инсулином (от лат. insula — островок). Однако прямых доказательств продукции гормона, влияющего на углеводный обмен, обнаружить не удавалось[3].
В 1921 году в лаборатории физиологии профессора J. Macleod в Торонтском университете молодому канадскому хирургу Фредерику Бантингу и его ассистенту студенту-медику Чарлзу Бесту удалось выделить инсулин.
В 1955 году Сангеру и соавторам (Кембридж) удалось определить последовательность аминокислот и строение молекулы инсулина[3].
В 1962 году Марлин и соавторы обнаружили, что водные экстракты поджелудочной железы способны повышать гликемию. Вещество, вызывающее гипергликемию, назвали «гипергликемическим-гликогенолитическим фактором». Это был глюкагон — один из основных физиологических антагонистов инсулина[3].
В 1967 году Донатану Стейнеру и соавторам (Чикагский университет) удалось обнаружить белок-предшественник инсулина — проинсулин. Они показали, что синтез инсулина бета клетками начинается с образования молекулы проинсулина, от которой в последующем по мере необходимости отщепляется С-пептид и молекула инсулина[3].
В 1973 году Джоном Энсиком (Вашингтонский университет), а также рядом учёных Америки и Европы была проведена работа по очистке и синтезу глюкагона и соматостатина[3].
В 1976 году Gudworth & Bottaggo открыли генетический дефект молекулы инсулина, обнаружив два типа гормона: нормальный и аномальный. последний является антагонистом по отношению к нормальному инсулину[3].
В 1979 году благодаря исследованиям Lacy & Kemp и соавторов появилась возможность пересадки отдельных островков и бета-клеток, удалось отделить островки от экзокринной части поджелудочной железы и осуществить трансплантацию в эксперименте. В 1979—1980 гг. при трансплантации бета-клеток преодолён видоспецифический барьер (клетки здоровых лабораторных животных имплантированы больным животным другого вида)[3].
В 1990 году впервые выполнена пересадка панкреатических островковых клеток больному сахарным диабетом[3].
Типы клеток[править | править код]
Данная диаграмма демонстрирует структурные отличия между панкреатическими островками крысы (вверху) и человека (внизу) pars ventralis pancreas (брюшная часть) — слева; pars dorsalis pancreas (спинная часть) — справа. Различные типы клеток окрашены по-разному: альфа-клетки — красным, бета-клетки — синим, дельта-клетки — фиолетовым, ПП-клетки — зелёным, эпсилон-клетки — жёлтым. Бета-клетки грызуна, в отличие от человека сгруппированы в характерное инсулиновое ядро.
Альфа-клетки[править | править код]
- Альфа-клетки составляют 15…20 % пула островковых клеток — секретируют глюкагон (естественный антагонист инсулина).
Бета-клетки[править | править код]
- Бета-клетки составляют 75…80 % пула островковых клеток — секретируют инсулин (с помощью белков-рецепторов проводит глюкозу внутрь клеток организма, активизирует синтез гликогена в печени и мышцах, угнетает глюконеогенез).
Дельта-клетки[править | править код]
- Дельта-клетки составляют 3…10 % пула островковых клеток — секретируют соматостатин (угнетает секрецию многих желез);
ПП-клетки[править | править код]
- ПП-клетки составляют 3…5 % пула островковых клеток — секретируют панкреатический полипептид (подавляет секрецию поджелудочной железы и стимулирует секрецию желудочного сока).
Эпсилон-клетки[править | править код]
- Эпсилон-клетки составляют <1 % пула островковых клеток — секретируют грелин[5][6] («гормон голода» — возбуждает аппетит).
Строение островка[править | править код]
Панкреатический островок является сложно устроенным функциональным микроорганом с определённым размером, формой и характерным распределением эндокринных клеток. Клеточная архитектура островка влияет на межклеточное соединение и паракринную регуляцию, синхронизирует высвобождение инсулина.
Долгое время считалось, что островки человека и экспериментальных животных сходны как по строению, так и по клеточному составу. Работы последнего десятилетия показали, что у взрослых людей преобладающим типом строения островков является мозаичный, при котором клетки всех типов перемешаны по всему островку, в отличие от грызунов, для которых характерен плащевой тип строения клеток, при котором бета-клетки формируют сердцевину, а альфа-клетки находятся на периферии. Однако, эндокринная часть поджелудочной железы имеет несколько типов организации: это могут быть единичные эндокринные клетки, их небольшие скопления, небольшие островки (диаметром < 100 мкм) и крупные (зрелые) островки.
Небольшие островки имеют у человека и грызунов одинаковое строение. Зрелые островки Лангерганса человека обладают выраженной упорядоченной структурой. В составе такого островка, окруженного соединительнотканной оболочкой, можно выявить дольки, ограниченные кровеносными капиллярами. Сердцевину долек составляет массив бета-клеток, на периферии долек в непосредственной близости с кровеносными капиллярами находятся альфа- и дельта-клетки. Таким образом, клеточная композиция островка зависит от его размера: относительное число альфа-клеток увеличивается вместе с размером островка, в то время как относительное число бета-клеток уменьшается[7].
См. также[править | править код]
Примечания[править | править код]
- ↑ 1 2 Foundational Model of Anatomy
- ↑ Langerhans P. Beiträge zur mikroskopischen Anatomie der Bauchspeicheldrüse : Inaugural-Dissertation, zur Erlangung der Doctorwürde in der Medicine und Chirurgie vorgelegt der Medicinischen Facultät der Friedrich-Wilhelms-Universität zu Berlin und öffentlich zu vertheidigen am 18. Februar 1869 (нем.). — Berlin: Buchdruckerei von Gustav Lange, 1869.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 Клиническая диабетология / Ефимов А. С., Скробонская Н. А. — 1-е изд. — К.: Здоровья, 1998. — 320 с. — 3000 экз. — ISBN 5-311-00917-9.
- ↑ Жуковский М. А. Детская эндокринология. — 3-е изд. — М.: Медицина, 1995. — 656 с. — 8000 экз. — ISBN 5-225-01167-5.
- ↑ K. M. Andralojc, A. Mercalli, K. W. Nowak. et al. Ghrelin-producing epsilon cells in the developing and adult human pancreas (англ.). (недоступная ссылка)
- ↑ Epsilon cells (Cytokines&Cells Encyclopedia) (англ.). Архивировано 26 октября 2012 года.
- ↑ Прощина А. Е., Савельев С. В. Иммуногистохимическое исследование распределения α- и β-клеток в разных типах островков Лангерганса поджелудочной железы человека // Бюллетень экспериментальной биологии и медицины. — Изд. РАМН, 2013. — Т. 155, № 6. — С. 763—767. Архивировано 25 ноября 2015 года.
Ссылки[править | править код]
Комикс на конкурс «био/мол/текст»: Сахарный диабет первого типа, также известный как инсулинозависимый диабет, развивается из-за разрушения бета-клеток поджелудочной железы, продуцирующих инсулин — гормон, регулирующий уровень глюкозы в крови человека. В своей статье мы расскажем о том, как недавно открытый лимфоцит, несущий рецепторы как Т-, так и В-клеток, ошибочно подстрекает Т-клетки к атаке на инсулинпродуцирующие клетки.
Давайте познакомимся с героями нашей статьи
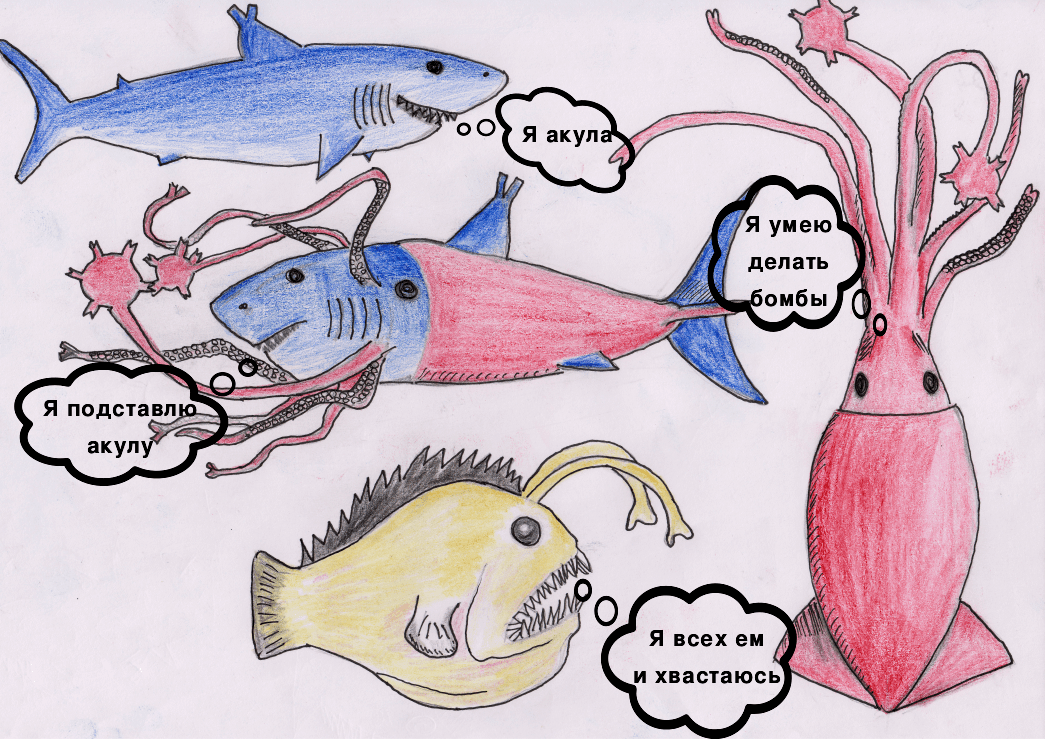
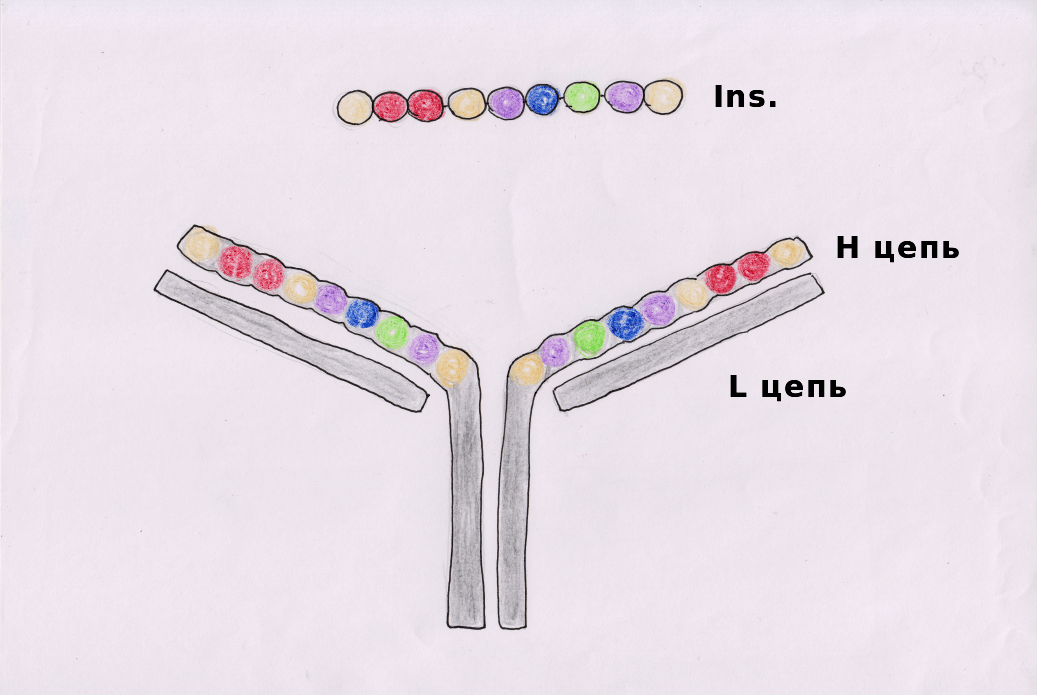
Акула — T-клетка.
Кальмар — В-клетка.
Удильщик — APC (антигенпрезентирующая клетка) с HLA I и HLA II (human leukocyte antigen).
Химера — DE-клетка (dual-receptor-expressing cell, «бирецепторная» клетка) с TCR (T-клеточным рецептором) и BCR (В-клеточным рецептором).
Для того чтобы разобраться, что же делает уникальный «бирецепторный» лимфоцит при диабете I типа (СД1), вкратце расскажем о том, как работает иммунная система.

Перед нами грозный хищник тканей организма — антигенпрезентирующая клетка (APC). Она поглощает фагоцитозом непрошенных гостей — патогенов, например, бактерии.

После переваривания она презентирует на специальном белке HLA II (human leucocyte antigen class II) часть белка патогена — антиген. Помимо HLA II существует HLA I. Об их значении и функциях подробнее рассказано в статье «Иммунитет: борьба с чужими и… своими» [1]. APC заплывает в лимфатический фолликул и привлекает туда наивные T-клетки, которые свободно циркулируют по организму.
В норме главная задача Т-лимфоцита — связывание антигена, который не встречается в организме, но попадает в него в течение патологических процессов. Разнообразие T-лимфоцитов очень велико. Оно обусловлено разнообразием Т-клеточных рецепторов, которое получается за счет рекомбинаций нескольких геномных участков и вставки случайных нуклеотидов в ген TCR [2]. Каждая из клеток немного отличается от остальных за счет гипермутабельности короткого фрагмента N-концевого домена рецептора и способна к узнаванию своего потенциального антигена. А значит, есть вероятность того, что APC встретит ту T-клетку, TCR которой будет связываться с антигеном, презентированным на HLA. Однако это также означает, что TCR может подойти и к пептиду, который есть у своих, нормальных клеток организма. Но нет. Такие Т-клетки обычно погибают в тимусе во время процесса, называемого негативной селекцией.
После связывания HLA II с TCR происходит пролиферация нужных T-клеток и выделение цитокинов, которые помогают им дифференцироваться. Для того чтобы эти T-клетки смогли связаться с HLA II, у них есть белок CD4, который «подтверждает» и стабилизирует связывание.

После дифференцировки CD4+ T-клетки выходят из фолликула и исполняют свою роль командира. Они выделяют цитокины, которые привлекают к месту инфекции другие клетки (базофилы, эозинофилы, тучные клетки и т.д.), и активируют макрофаги.
Тем временем наивные В-клетки (В-лимфоциты) ждут в фолликуле, когда приплывет антиген и они получат возможность принять участие в борьбе с патогеном.

Они действуют посредством поверхностных рецепторных молекул — В-клеточных рецепторов. В-клеточные рецепторы создаются с помощью высоко вариабельных генных перестроек. Наивная В-клетка ждет связывания своего BCR с антигеном. Она поглощает и представляет антиген на своем HLA II, и ждет встречи с CD4+ Т-клеткой, которая уже активировалась на тот же антиген. Прелесть рецепторов B-клеток (BCR) заключается в том, что благодаря случайной перестройке генов производится такое большое разнообразие рецепторов поверхности B-клеток, что практически любой чужеродный антиген, попадающий в организм, распознается ими.
T-лимфоцит помогает В-лимфоциту пролиферировать и начать продуцировать антитела, которые будут способны так же, как и В-клеточные рецепторы связывать антигены. Антитела связываются с антигенами на поверхности бактерий, а другим концом (Fc-концом) связываются с рецепторами на макрофагах (морская звезда на рисунке выше), после чего они фагоцитируют бактерию. Помимо этого, антитела на поверхности бактерий активируют систему комплемента, а также мешают бактерии прикрепляться к клеткам организма.
У 90% больных сахарным диабетом первого типа существует особый вариант HLA II (HLA-DQ8): он лучше связывается с антигеном, который несет относительный отрицательный заряд в определенных положениях (позициях 1 и 9). Инсулин считается аутоантигеном при СД1, то есть именно его распознают в качестве чужеродного агента иммунные клетки пациентов.

Обычно любой белок презентируется не целиком: клетки показывают только его наиболее иммуногенную часть. У инсулина такой частью являются аминокислоты 9–23 на В-цепи (B:9–23). Тем не менее презентация B:9–23 с помощью как нормального, так и мутантного (HLA-DQ8) HLA II для CD4+ T-клеток больных СД1 не приводит к их активации.
Недавно было открыто, что кровь людей, больных СД1, в сравнении со здоровой выборкой, оказывается обогащенной химерами Т- и В-клеток (Х-клетками) [3]. Антитела этих клеток имеют схожий с инсулином порядок зарядов аминокислотных остатков. Участки антител имеют лучшее сродство с инсулинспецифичными Т-клетками и активируют их, подстрекая развитие аутоиммунного ответа на инсулинпродуцирующие бета-клетки островков Лангерганса.

К сожалению, на данный момент неизвестно, какова природа возникновения химер Т- и В-клеток. Участие Х-клеток в развитии других заболеваний также остается загадкой.
Авторы предлагают проводить скрининг большего числа субъектов из группы риска и использовать данные об обогащении клонов Х-клеток в качестве прогностического признака. Также необходимо провести более качественный анализ RNA-seq, чтобы определить, являются ли Х-клетки отдельным новым типом клеток или присутствуют в организме в качестве субпопуляции одного из уже известных типов клеток.
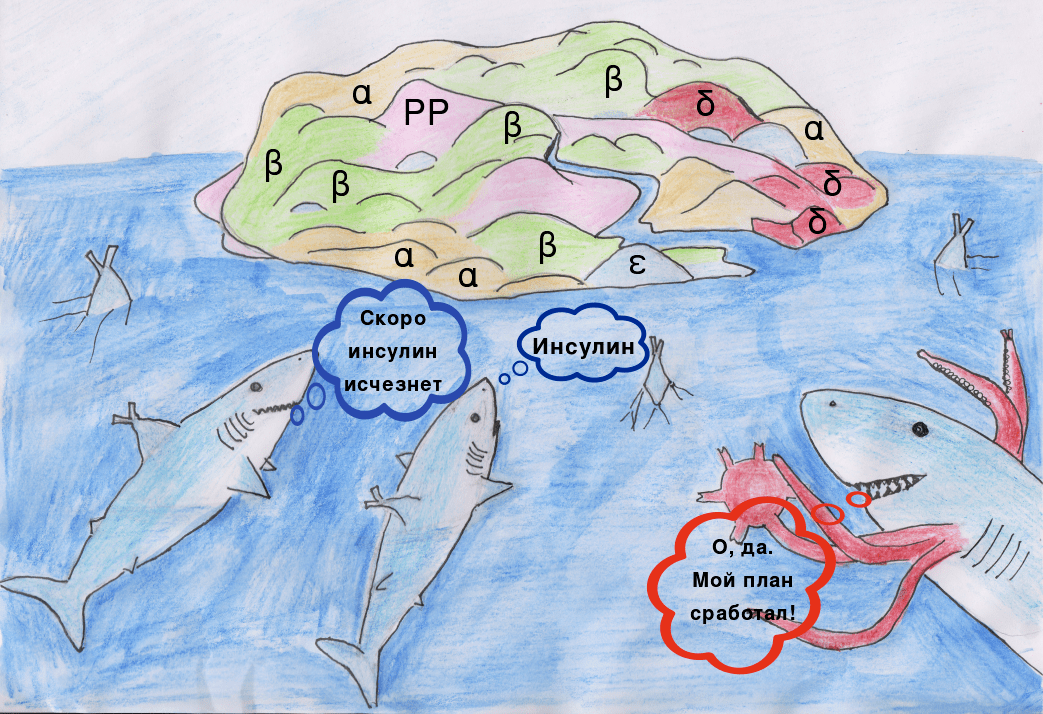
Число людей, на которых было сделано это открытие, мало, но если результаты подтвердятся, то это станет захватывающим шагом к лучшему пониманию аутоиммунной природы сахарного диабета первого типа. Будет интересно увидеть будущие результаты этих исследователей.
- Иммунитет: борьба с чужими и… своими;
- Антитело: лучший способ распознать чужого;
- Rizwan Ahmed, Zahra Omidian, Adebola Giwa, Benjamin Cornwell, Neha Majety, et. al.. (2019). A Public BCR Present in a Unique Dual-Receptor-Expressing Lymphocyte from Type 1 Diabetes Patients Encodes a Potent T Cell Autoantigen. Cell. 177, 1583-1599.e16;
- Jan Černý, Ilja Stříž. (2019). Adaptive innate immunity or innate adaptive immunity?. Clin. Sci.. 133, 1549-1565;
- Immunopaedia.org;
- Murphy K. and Weaver C. Janeway’s immunobiology (9th Edition). Garland Science, 2016. — 924 p..
Что такое панкреатические островки?
Панкреатические островки, также называемые островками Лангерганса, — это крошечные скопления клеток, диффузно рассеянные по всей поджелудочной железе. Поджелудочная железа – это орган, имеющий продольную форму длиною 15-20 см, который располагается позади нижней части желудка.
Панкреатические островки содержат несколько видов клеток, включая бета-клетки, которые вырабатывают гормон инсулин. Поджелудочная железа также создает ферменты, помогающие организму переваривать и усваивать еду.
Панкреатические островки содержат несколько видов клеток, включая бета-клетки, которые вырабатывают гормон инсулин.
Когда уровень глюкозы крови повышается после принятия пищи, поджелудочная железа отвечает на это высвобождением в кровоток инсулина. Инсулин помогает клеткам по всему организму поглощать глюкозу из крови и использовать ее для выработки энергии.
Сахарный диабет развивается, когда поджелудочная железа не вырабатывает достаточного количества инсулина, клетки организма не используют этот гормон с достаточной эффективностью или по обеим причинам. В результате глюкоза накапливается в крови, а не поглощается из нее клетками организма.
При диабете 1 типа бета-клетки поджелудочной железы прекращают выработку инсулита, так как иммунная система организма атакует их и уничтожает. Иммунная система защищает людей от инфекций, выявляя и разрушая бактерии, вирусы и другие потенциально вредные чужеродные вещества. Люди, имеющие диабет 1 типа, должны ежедневно принимать инсулин в течение всей жизни.
Сахарный диабет 2 типа обычно начинается с состояния, называемого инсулинорезистентностью, при котором организму не удается эффективно использовать инсулин. Со временем выработка этого гормона также сокращается, поэтому многим пациентам с диабетом 2 типа в конечном итоге приходиться принимать инсулин.
Что такое пересадка островков поджелудочной железы?
Существует два вида трансплантации (пересадки) панкреатических островков:
- Аллотрансплантация.
- Аутотрансплантация.
Аллотрансплантация островков Лангерганса – это процедура, во время которой островки из поджелудочной железы умершего донора очищают, обрабатывают и пересаживают другому человеку. В настоящее время аллотрансплантация панкреатических островков считается экспериментальной процедурой, так как технология их пересадки еще недостаточно успешна.
Для каждой аллотрансплантации панкреатических островков ученые используют специализированные ферменты, с помощью которых удаляют их из поджелудочной железы умершего донора. Затем островки очищают и подсчитывают в лаборатории.
Обычно реципиенты получают две инфузии, в каждой из которых содержится 400 000 – 500 000 островков. После имплантации бета-клетки этих островков начинают вырабатывать и выделять инсулин.
Аллотрансплантация островков Лангерганса проводится пациентам с диабетом 1 типа, у которых плохо контролируются уровни глюкозы в крови. Цель пересадки состоит в том, чтобы помочь этим больным достичь относительно нормальных показателей глюкозы крови с ежедневными инъекциями инсулина или без них.
Cнизить или устранить риск неосознанной гипогликемии (опасное состояние, при котором пациент не чувствует симптомов гипогликемии). Когда человек ощущает приближение гипогликемии, он может предпринять меры, чтобы поднять уровень глюкозы в крови до нормальных для него значений.
Аллотрансплантация панкреатических островков проводится только в больницах, получивших разрешение на клинические испытания этого метода лечения. Пересадки часто проводятся радиологами – врачами, которые специализируются на медицинской визуализации. Радиолог использует рентген и ультразвук, чтобы направлять введение гибкого катетера через небольшой разрез в верхней части брюшной стенки в портальную вену печени.
Портальная вена – это крупный кровеносный сосуд, несущий кровь в печень. Островки медленно вводят в печень через катетер, установленный в портальной вене. Как правило, эта процедура проводится под местной или общей анестезией.
Пациенты часто нуждаются две или больше трансплантации, чтобы получить количество функционирующих островков, достаточное для снижения или устранения потребности во введении инсулина.
Аллотрансплантация панкреатических островков. При аутотрансплантации островки экстрагируют из собственной поджелудочной железы пациента.
Аутотрансплантация панкреатических островков проводится после тотальной панкреатэктомии – хирургического удаления всей поджелудочной железы – у пациентов с тяжелым хроническим или длительно протекающим панкреатитом, который не поддается другим методам лечения. Эта процедура не считается экспериментальной. Аутотрансплантация островков Лангенрганса не проводится у пациентов с диабетом 1 типа.
Процедура проходит в больнице под общей анестезией. Сперва хирург удаляет поджелудочную железу, из которой потом экстрагируют панкреатические островки. В течение часа очищенные островки вводят через катетер в печень больного. Цель такой пересадки – обеспечить организм достаточным для выработки инсулина количеством островков Лангерганса.
Что происходит после трансплантации островков поджелудочной железы?
Островки Лангерганса начинают высвобождать инсулин вскоре после трансплантации. Тем не менее, полноценное их функционирование и рост новых кровеносных сосудов требуют времени.
Реципиентам до начала полноценной работы пересаженных островков приходиться продолжать инъекции инсулина. Они также могут принимать до и после трансплантации специальные препараты, способствующие успешному приживлению и длительному функционированию островков Лангерганса.
Тем не менее, аутоиммунный ответ, уничтоживший собственные бета-клетки пациента, может снова атаковать пересаженные островки. Хотя традиционным местом для инфузии донорских островков является печень, ученые проводят исследования альтернативных мест, включая мышечные ткани и другие органы.
Каковы преимущества и недостатки аллотрансплантации панкреатических островков?
Преимущества аллотрансплантации островков Лангерганса включают улучшение контроля глюкозы крови, снижение или устранение потребности в инъекциях инсулина для лечения диабета, предотвращение гипогликемии. Альтернативой трансплантации панкреатических островков является пересадка всей поджелудочной железы, которая чаще всего проводится вместе с пересадкой почки.
Преимущества трансплантации всей поджелудочной железы – меньшая зависимость от инсулина и более длительное функционирование органа. Основной недостаток пересадки поджелудочной железы состоит в том, что это очень сложная операция с высоким риском развития осложнений и даже смерти.
Аллотрансплантация панкреатических островков может также помочь избежать неосознанной гипогликемии. Научные исследования показали, что даже частично функционирующие после пересадки островки могут предотвратить это опасное состояние.
Улучшение контроля над уровнем глюкозы в крови с помощью аллотрансполантации островков также может замедлить или предотвратить прогрессирование вызванных диабетом проблем, таких как заболевания сердца и почек, поражения нервов и глаз. Длятся исследования по изучению этой возможности.
Недостатки аллотрансплантации панкреатических островков включают риски, связанные с самой процедурой – в частности, кровотечения или тромбозы. Пересаженные островки могут частично или полностью прекратить свое функционирование. Другие риски связаны с побочными эффектами иммуносупрессивных препаратов, которые вынуждены принимать пациенты для того, чтобы остановить отторжение иммунной системой пересаженных островков.
Если у пациента уже есть пересаженная почка и он уже принимает иммуносупрессивные препараты, дополнительными рисками являются только инфузия островков и побочные эффекты иммуносупрессивных препаратов, которые вводятся во время аллотрансплантации. Эти лекарственные средства не нужны при аутотрансплантации, так как вводимые клетки берутся из собственного организма пациента.
Какова эффективность трансплантации островков Лангерганса?
С 1999 по 2009 год в США было проведено аллотрансплантацию островков поджелудочной железы 571 пациенту. В некоторых случаях эта процедура проводилась в сочетании с пересадкой почки. Большая часть пациентов получили одну или две инфузии островков. В конце десятилетия среднее количество островков, получаемых во время одной инфузии, составляло 463 000.
Согласно статистическим данным, в течение года после трансплантации около 60% реципиентов получили независимость от инсулина, под чем подразумевается прекращение инъекций инсулина длительностью, как минимум, 14 дней.
На конец второго года после пересадки прекратить инъекции, как минимум, на 14 дней могли 50% реципиентов. Тем не менее, долгосрочную независимость т инсулина поддерживать трудно, и в конечном итоге большинство из пациентов были вынуждены снова принимать инсулин.
Были определены факторы, связанные с лучшими результатами аллотрансплантации:
- Возраст – 35 лет и старше.
- Более низкие уровни триглицеридов в крови перед трансплантацией.
- Более низкие дозы инсулина перед трансплантацией.
Тем не менее, научные данные свидетельствуют о том, что даже частично функционирующие пересаженные островки Лангерганса могут улучшить контроль над уровнем глюкозы в крови и снизить дозы вводимого инсулина.
В чем состоит роль иммуносупрессантов?
Иммуносупрессивные препараты необходимы для предотвращения отторжения – распространенной проблемы при любой трансплантации.
Ученые добились многих успехов в области трансплантации островков Лангерганса в течение послезних лет. В 2000 году канадские ученые опубликовали свой протокол трансплантации (Эдмонтонский протокол), который был адаптирован медицинскими и исследовательскими центрами всего мира и продолжает совершенствоваться.
Эдмонтонский протокол вводит использование новой комбинации иммуносупрессивных препаратов, включая даклизумаб, сиролимус и такролимус. Ученые продолжают развивать и изучать модификации этого протокола, включая улучшенные схемы лечения, которые способствуют увеличению успеха трансплантации. Эти схемы в различных центрах могут быть разными.
Примеры других иммуносупрессантов, используемых при трансплантации островков Лангерганса, включают антитимоцитарный глобулин, белатацепт, этанерцепт, алемтузумаб, базаликсимаб, эверолимус и мофетил микофенолата. Ученые также исследуют препараты, не принадлежащие к группе иммуносупрессантов, — например, экзенатид и ситаглиптин.
Иммуносупрессивные препараты имеют серьезные побочные эффекты, а их долгосрочное влияние до сих пор полностью не изучены. Немедленные побочные эффекты включают язвы в ротовой полости и проблемы в пищеварительном тракте (например, расстройство желудка и диарея). У пациентов могут также развиваться:
- Повышение уровней холестерина крови.
- Повышение артериального давления.
- Анемия (снижение количества эритроцитов и гемоглобина крови).
- Усталость.
- Снижение количества лейкоцитов в крови.
- Ухудшение функции почек.
- Повышенная восприимчивость к бактериальным и вирусным инфекциям.
Прием иммуносупрессантов также повышает риск развития некоторых видов опухолей и рака.
Ученые продолжают искать пути достижения толерантности иммунной системы к пересаженным островкам, при которой иммунитет не распознает их в качестве чужеродных.
Иммунная толерантность позволила бы поддерживать функционирование пересаженных островков без приема иммуносупрессивных препаратов. Например, один из методов заключается в трансплантации островков, инкапсулированных в специальное покрытие, которое может помочь предотвратить реакцию отторжения.
Какие препятствия стоят перед аллотрансплантацией панкреатических островков?
Нехватка подходящих доноров – главное препятствие для широкого применения аллотрансплантации островков Лангерганса. Кроме этого, не все донорские поджелудочные железы подходят для экстрагирования островков, так как они не отвечают всем критериям отбора.
Нужно учитывать также и то, что во время подготовки островков к пересадки они часто повреждаются. Поэтому каждый год проводиться очень мало трансплантаций.
Ученые изучают различные методы решения этой проблемы. Например, используют только часть поджелудочной железы от живого донора, применяют панкреатические островки свиней.
Ученые пересаживали островки свиней другим животным, включая обезьян, инкапсулируя их в специальное покрытие или применяя препараты для профилактики отторжения. Другой подход состоит в создании островков из клеток других типов – например, из стволовых клеток.
Кроме этого, широкому распространению аллотрансплантации островков препятствуют финансовые барьеры. Например, в США технология трансплантации считается экспериментальной, поэтому ее финансируют из исследовательских фондов, так как страховки не покрывают подобные методы.
Питание и диета
Человек, которому провели трансплантацию панкреатических островков, должен соблюдать диету, разработанную врачами и диетологами.
Иммуносупрессивные препараты, принимаемые после пересадки, могут стать причиной увеличения веса. Здоровое питание важно для контроля над массой тела, артериальным давлением, холестерином крови и уровнями глюкозы в крови.
Дорогие друзья. Статья не является медицинским советом и не может служить заменой консультации с врачом.
