Сахарный диабет 2 типа гемостаз
 О состоянии гемостаза у больных с различной хирургической патологией судили по данным развернутой коагулограммы. Больных обследовали при поступлении, перед операцией, через 1, 3, 5, 7 и 10 сут после нее. Определяли следующие показатели: время свертывания крови, время рекальцификации плазмы, протромбиновый индекс, тромбиновое время, фибриноген А, толерантность плазмы к гепарину, ретракцию сгустка и спонтанный фибринолиз.
О состоянии гемостаза у больных с различной хирургической патологией судили по данным развернутой коагулограммы. Больных обследовали при поступлении, перед операцией, через 1, 3, 5, 7 и 10 сут после нее. Определяли следующие показатели: время свертывания крови, время рекальцификации плазмы, протромбиновый индекс, тромбиновое время, фибриноген А, толерантность плазмы к гепарину, ретракцию сгустка и спонтанный фибринолиз.
Характер хирургических заболеваний, возраст и число больных сахарным диабетом с острыми и хроническими заболеваниями, тяжесть инсулиновой недостаточности, частота декомпенсации углеводного обмена и другие данные о больных, которых мы наблюдали, приведены ранее.
Изучение процесса гемостаза (системы PACK) показало, что у больных сахарным диабетом без хирургической патологии наблюдается гиперкоагуляция. У этих больных выявлено укорочение времени свертывания крови до 4,8 мин, рекальцификации — до (88,5+4,7) с, повышение количества фибриногена — до (3,57+0,1) г/л и протромбиновой активности — до (93,2+1,2)%. В то же время противосвертывающие механизмы и фибринолиз оставались на том же уровне, что и у лиц контрольной группы: фибринолиз составил (26±2)%, тромбиновое время — (22,3+0,7) с, толерантность плазмы к гепарину — (544,4±2,18) с.
Более значительные изменения системы гемостаза обнаружены у хирургических больных, страдающих сахарным диабетом. Уже при поступлении в клинику у большинства больных отмечена высокая степень свертывания крови вплоть до наклонности к претромбозу. На это указывало увеличение количества фибриногена А от 5,24 до 15,17 г/л, толерантности плазмы к гепарину — от 90 до 425 с. Свертываемость крови по Ли-Уайту составляла 4,2±0,2 мин. Фибринолитическая активность крови снижалась от 19,5 до 8,2% . Такой тип коагулограммы, по данным В.П.Балуды и соавт., соответствует декомпенсированному типу гемостаза I степени или подострому ДВС-синдрому. Важно подчекнуть, что предоперационная дезинтоксикация и противодиабетическая терапия почти не влияла на нормализацию гемостаза, так как наличие у больных гнойно-воспалительных заболеваний, некротического или гангренозного процессов не позволяли полностью стабилизировать метаболический ацидоз и гиперкалиемию, несмотря на снижение уровня глюкозы в крови и моче. Из этого вытекает важный вывод о том, что данные о свертывающих и противосвертывающих компонентах крови и активности фибринолиза можно использовать как косвенные показатели дисбаланса электролитного обмена и КОС.
Учитывая влияние операционной травмы, наркоза, кровопотери и других факторов, исследование гемостаза проводили через сутки после хирургического вмешательства. В целях усиления тормозных процессов в ЦНС, которая, как известно, влияет на процесс внутрисосудистого свертывания крови, больным перед операцией вводили обезболивающие средства (промедол) в сочетании с пипольфеном, димедролом и аминазином.
Уже через сутки после операции на фоне декомпенсированного или субкомпенсированного метаболического ацидоза и гиперкалиемии четко определялись активация коагулирующих и значительная депрессия антисвертывающих механизмов крови и фибринолиза. Наиболее выраженные сдвиги отмечались на 3—5 сутки после операции. Обнаруженные изменения гемостаза можно расценивать как гиперкоагуляционную фазу ДВС-синдрома. Тромбообразование наиболее вероятно именно в этой критической стадии послеоперационного периода.
Некоторые исследователи полагают, что гиперкоагулирующие проявления ДВС-синдрома связаны со сложными нарушениями равновесия свертывающих и антисвертывающих механизмов, с их активаторами, ингибиторами, а также с изменениями тромбоцитарно-сосудистого звена, системы комплемента, калликреинкининов, белкового состава крови.
В возникновении ДВС-синдрома ведущую роль играют депрессия антитромбина Ш-антикоагулянта широкого спектра действия, гепаринорезистентность и угнетение фибринолиза. В то же время развитию внутрисосудистого свертывания крови, как правило, предшествует поступление в кровяное русло прокоагулянтов (при травме, операции), нарушающих процесс гемостаза. При этом последовательно развивается 2 фазы ДВС-синдрома: гиперкоагуляционная и гипокоагуляционная. В 1-ой фазе наблюдаются гиперфибриногенемия, повышение внутрисосудистого свертывания крови, агрегация форменных элементов и блокада микроциркуляторного русла; во 2-ой могут развиться гипофибриногенемия, тромбоцитопения потребления, геморрагические проявления. Некоторые исследователи выделяют еще и 3-ю фазу — усиленный фибринолиз с массивным кровотечением. ДВС-синдром осложняет течение основного заболевания и нередко приводит к летальному исходу.
Анализируя показатели коагулограммы в динамике, мы установили, что только к 10-м суткам после хирургического вмешательства у больных сахарным диабетом вместе со стабилизацией электролитного обмена и уменьшением ацидоза появлялась тенденция к возврату показателей гемостаза к исходным величинам (но только под влиянием интенсивной корригирующей терапии). В то же время антисвертывающие механизмы и фибринолиз в течение длительного времени были в состоянии определенной депрессии; фибринолиз составлял (19,5±1,8%), толерантность плазмы к гепарину — (442+17). Тем не менее функциональное состояние системы гомеостаза через 12-24 сут уже можно было расценивать как компенсаторный тип ДВС-синдрома.
Наиболее значительные изменения противосвертывающей и фибринолитической систем крови наблюдались при декомпенсированном ацидозе и гиперкалиемии у тучных больных с тяжелой формой сахарного диабета и гнойно-воспалительными заболеваниями. Надо полагать, что торможение противосвертывающих механизмов у этих лиц связано со снижением продукции и содержания в крови свободного гепарина — мощного активатора всей системы гемостаза.
Анализ отдельных показателей коагулограмм позволяет получить представление не только о направленности процесса гемостаза, но и о функциональном состоянии ряда органов и систем у больных сахарным диабетом с хирургической патологией. Так, изучая протромбиновую активность крови в динамике, можно судить не только о коагуляционных свойствах крови, но и о функциональном состоянии печени и прежде всего об изменении белкового обмена.
Уменьшение фракций альбуминов, изменение альбумино-глобулиново-го коэффициента, увеличение содержания альфа- и бета-глобулинов наряду с изменениями протромбиновой активности указывают на белковый дисбаланс и определенные расстройства функции печени у большинства (76%) больных сахарным диабетом с хирургической патологией.
Отмечая высокую степень гиперфибриногенемии у больных до операции и после нее, следует согласиться с теми исследователями, которые считают ее защитной реакцией организма на токсическое раздражение ретикулоэндотелиальной системы печени или на травматическое повреждение тканей.
Нормализация процесса регенерации ран и устранение метаболических нарушений, улучшение реологических свойств крови, блокада тканевого и плазменного тромбопластина (с помощью обкалывания раны гепарином) и другие лечебные мероприятия позволяют уменьшить опасность развития тромбоэмболических осложнений.
Таким образом, хирургические заболевания, протекающие на фоне сахарного диабета, сопровождаются изменениями системы гемостаза по типу латентно протекающего ДВС-синдрома. В послеоперационном периоде отмечается усиление внутрисосудистого свертывания крови, вплоть до тромбообразования.
Вместе с тем реологические нарушения, обнаруживаемые даже при неосложненном сахарном диабете в виде синдрома гипервязкости, также способствует тромбообразованию. Гетерогенность механизмов этих нарушений при сахарном диабете должна рассматриваться как результат сложных функционально-биохимических и морфологических изменений микроциркуляторного русла.
Все патофизиологические изменения механизма гемостаза (особенно в послеоперационный период), требуют обязательной коррекции. Для этого назначают антикоагулянтную терапию, нормализующую систему PACK на всех этапах хирургического лечения больных сахарным диабетом.
Изменения гемокоагуляции и фибринолиза у больных сахарным диабетом имеют также индивидуальные особенности, связанные с тяжестью инсулиновой недостаточности, выраженностью ацидоза и др.
Наиболее неблагоприятные в прогностическом отношении изменения системы PACK наблюдаются у больных с влажной диабетической гангреной. Уменьшение времени свертывания крови по Ли-Уайту до (3,1+0,12) мин и времени полной рекальцификации до (72,1+3,6) с, высокая степень фибриногенемии — (7,3+0,6) г/л, повышение толерантности плазмы к гепарину до (347,5+21,9) с и снижение спонтанного фибринолиза до (10,4+1,4)% давали клинико-лабораторную картину претромбоза. Операционная травма увеличивала коагуляционную активность крови и подавляла фибринолиз.
Снижение фибринолитической активности системы PACK можно увязать с дисфункцией баро- и хеморецепторов внутренней оболочки сосудов микроциркуляторного русла, ангио- и невропатиями. Существенное влияние на фибринолиз оказывает расстройство липидного обмена (ожирение). По данным А.С.Ефимова и В.К. Гостищева и соавт., у всех больных сахарным диабетом обнаруживается гиперлипидемия — повышение концентрации триглицеридов, холестерина, свободных жирных кислот и бета-липопротеидов. Немалое значение имеет и включение в этот процесс кининовой, калликреиновой и простагландиновой систем организма. Декомпенсация PACK может проявляться клиникой тромбоза легочной артерии, брыжеечных сосудов, коронарных артерий и периферических вен. Послеоперационные тромбоэмболические осложнения могут развиться у 5—7% больных, которым после операции не проводили целенаправленную антикоагулянтную терапию.
Поскольку тромбообразование вносит существенный вклад в смертельный исход больных сахарным диабетом 2 типа, обоснован повышенный интерес к исследованию системы гемостаза при этом заболевании. Подтверждена вовлеченность трех систем в регуляцию гемостаза:
— система коагуляции;
— фибринолиз;
— тромбоциты.
Большинство исследований оценивает факторы свертывания, фибринолитические компоненты и функцию тромбоцитов при сахарном диабете 2 типа. Данные проспективных исследований указывают на антитромботические агенты как на безопасные и эффективные средства снижения риска кардиоваскулярных событий у больных сахарным диабетом 2 типа.
Относительно двух других систем непродолжительные исследования показали, что преимущественный эффект на предполагаемую гемостатическую среду может быть связан с интенсивным контролем гликемии определенными препаратами.
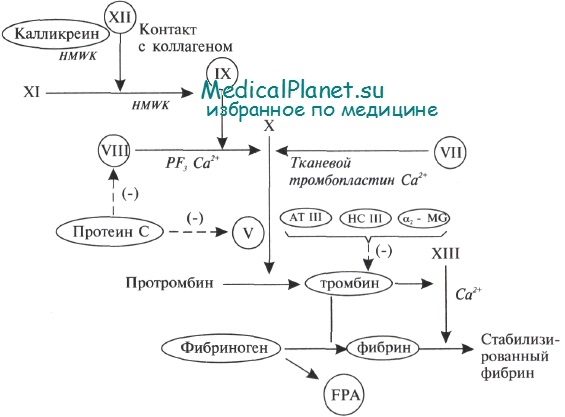
Схема коагуляции крови.
Кругом обведены факторы, способные изменяться при диабете. (-) = подавляющий эффект; ВМК — высокомолекулярный кининоген; ТФЗ — тромбоцитарный фактор 3; АШ — антитромбин III; КПП – кофактор гепарина III; а2МГ — а2 макроглобулин; ФА – фибринопептид А.
Система коагуляции при сахарном диабете 2 типа
Общая активация данной системы достаточно хорошо описана. На рисунке отмечены компоненты системы, которые, как было сообщено, могут изменяться при сахарном диабете 2 типа. Активация системы ведет к конверсии фибриногена в фибрин при действии тромбина. Данные исследований указывают, что фактор VII и фибриноген — кардиоваскулярные факторы риска у больных сахарным диабетом 2 типа.
Снижение гликемии под действием инсулина влияет на уровень этих факторов в плазме. Изменения, в основном, идут в ожидаемом направлении снижения тромбоза. Уровень фибриногена плазмы коррелирует с уровнем глюкозы крови и может снизиться при остром введении инсулина при сахарном диабете 2 типа. HbAlc коррелирует с уровнем фибринопептида А и тромбин-антитромбином (ТАТ).
Острое повышение глюкозы плазмы сопровождается повышением уровня фибринопептида А и снижением антитромбина III, а инфузия инсулина восстанавливает эти изменения. Введение инсулина снижает уровень фактора VII. При улучшении гликемического контроля было продемонстрировано снижение тромбообразования (для оценки in vitro использовалась постоянная перфузия).
Имеются немногочисленные данные продолжительных проспективных рандомизированных исследований в этой области. Исследование VA Cooperative Study in Type 2 Diabetes обнаружило достоверное повышение уровня фибриногена плазмы по отношению к базовому уровню через 1 год в группе, рандомизированной к интенсивной инсулинотерапии.
Интересно, что это непродолжительное исследование выявило недостоверную тенденцию повышения частоты кардиоваскулярных событий в группе интенсивного лечения. Интервенционные исследования предлагают прямое воздействие на фибриноген плазмы. Лечебные подходы, направленные на снижение уровня фибриногена (и васкулярного риска), включают отказ от курения, физическую активность, улучшение гликемического контроля, использование препаратов, снижающих синтез фибриногена (тиклопидин, пентоксифиллин, анаболические стероиды, фибраты).
Основные положения: система гемостаза при сахарном диабете 2 типа
— Гиперкоагуляция часто имеет место у больных сахарным диабетом 2 типа.
— У больных сахарным диабетом 2 типа задействованы три системы: система коагуляции, система фибринолиза и тромбоциты.
— Сахарный диабет 2 типа ассоциирован с общей активацией факторов свертывания крови.
— Два компонента этой системы, фактор VI и фибриноген определены как кардиоваскулярные факторы риска.
— Улучшение гликемического контроля на фоне инсулинотерапии изменяет активность факторов свертывания в направлении снижения тромбообразования.
— Ингибитор лизиса, ИАП-1, присутствует в избытке у большинства лиц с метаболическим синдромом, сахарным диабетом 2 типа и/или ожирением.
— 90 % ИАП-1 в организме транспортируется тромбоцитами.
— Повышенный уровень ИАП-1 снижается при уменьшении массы тела, физической активности, снижении гликемического индекса и приеме некоторых препаратов, включая метформин, тиазолидиндионы, гемфиброзил (если уровень ТГ повышен), ИАПФ и эстроген/прогестины (у женщин в менопаузе).
— При сахарном диабете изменяются функции тромбоцитов, включая повышение адгезии, агрегации и синтеза тромбоксана.
— 4 исследования по первичной и вторичной профилактике показали, что аспирин снижает частоту кардиоваскулярных осложнений (особенно ИМ) у больных СД 2 типа.
— В этих исследованиях не было повышенного риска кровоизлияний на глазном дне, в стекловидное тело и центральную нервную систему.
— Следует рекомендовать прием аспирина, покрытого кишечно-растворимой оболочкой в дозе 81—325 мг/сут больным сахарным диабетом 2 типа с высоким риском кардиоваскулярных осложнений. Исследования показывают, что это 98 % популяции больных сахарным диабетом 2 типа в США.
– Читать далее “Фибринолитическая система при сахарном диабете 2 типа”
Оглавление темы “Рекомендации по терапии сахарного диабета 2 типа”:
- Необходимость лечения нефропатии при сахарном диабете 2 типа. Эффективность
- Как лечить нефропатию при сахарном диабете 2 типа? Устранение белка в моче при диабете
- Контроль холестерина, липидов при сахарном диабете 2 типа? Какая норма ЛПНП, ЛПВП при диабете?
- Образ жизни при сахарном диабете 2 типа. Рекомендации по диете при диабете
- Эффективность контроля ЛПНП при сахарном диабете 2 типа
- Эффективность контроля триглицеридов и ЛПВП при сахарном диабете 2 типа
- Лечение дислипидемии при сахарном диабете 2 типа. Нормализация ЛПНП, ЛПВП, триглицеридов при диабете
- Меры повышения приверженности пациентов с диабетом 2 типа лечению
- Система гемостаза, коагуляции при сахарном диабете 2 типа
- Фибринолитическая система при сахарном диабете 2 типа
- Авторы
- Файлы
Солун М.Н., Киричук В.Ф., Дихт Н.И.
Проблема сахарного диабета (СД) остается одной из наиболее актуальных медико-социальных проблем современности, что обусловлено широким распространением данного заболевания практически во всех странах мира, тенденцией к увеличению его частоты, тяжестью многочисленных осложнений, трудно поддающихся лечению. В настоящее время от сосудистых поражений погибает 65-80% пациентов, при распространенности диабетических ангиопатий (ДА) до 84-100%.
Многие авторы и эксперты включают поражение сосудов в определение самого заболевания, так как начинается СД как болезнь обмена, а заканчивается как генерализованная сосудистая патология. Наряду с поражением сосудов сетчатки, почек, сердца в патологический процесс вовлекаются сосуды нижних конечностей (НК). Диабетическая ангиопатия нижних конечностей (ДАНК) возникает раньше и встречается чаще, чем ангиопатия другой локализации.
Основными пусковыми механизмами ДА являются генетические факторы и диабетические нарушения обмена веществ. Дальнейшее прогрессирование сосудистых поражений обусловлено нарушением нервно-гуморальной (гормональной) регуляции, гемореологии, оксигенации, гиперпродукцией контринсулярных гормонов и аутоиммунными сдвигами. Большое значение в патогенезе ДА отводится изменениям системы гемостаза и реологическим нарушениям. Известно, что внутрисосудистое тромбо-образование в физиологических условиях сдерживается различными механизмами, среди которых важное место занимает тромборезистентность сосудистой стенки, т.е. ее антитромбогенная активность. Последняя определяется функциональным состоянием сосудистого эндотелия, в котором синтезируется простациклин, являющийся мощным вазодилятатором и антиагрегантом и препятствующий действию тромбоксана А2, выделяемого тромбоцитами при их активации. Эндотелий накапливает также важнейший физиологический антикоагулянт – антитромбин III и синтезирует фактор Виллебранда, участвует в регуляции фибринолиза.
Имеется большое число работ, свидетельствующих о нарушении функции эндотелия сосудов, тромбоцитов, процессов фибринолиза и свертывания крови при СД. Повышение функциональной активности тромбоцитов и снижение антитромбогенных свойств сосудистой стенки у больных сахарным диабетом может явиться одним из патогенетических механизмов развития и прогрессирования диабетической ангиопатии, создать условия для возникновения внутрисосудистой агрегации тромбоцитов, их адгезии к сосудистой стенке и тромбогенеза. Однако результаты исследований функциональной активности тромбоцитов у больных сахарным диабетом, осложненным и не осложненным микроангиопатией противоречивы.
Это определяет целесообразность дальнейшего всестороннего и комплексного изучения состояния системы гемостаза и тромборезистентности сосудистой стенки и их роли в развитии и прогрессировании сосудистых осложнений при сахарном диабете.
Целью работы явилось изучение состояния сосудисто-тромбоцитарного звена (функциональной активности тромбоцитов и антитромбогенной активности сосудистой стенки) и некоторых показателей коагуляционного звена системы гемостаза у больных с диабетической ангиопатией нижних конечностей функциональной стадии
Под наблюдением в клинике эндокринологии находилось 250 больных, страдающих сахарным диабетом 1 типа, тяжелой формы. Среди больных было практически равное количество мужчин и женщин в возрасте от 16 до 50 лет, преимущественно от 16 до 35 лет (средний возраст 26,9 + 1,38 лет).
В контрольную группу вошли 15 практически здоровых лиц (8 женщин и 7 мужчин; средний возраст 27,6 + 1,24 лет), не имеющих отягощенного анамнеза по тромботическим и геморрагическим заболеваниям и синдромам.
У всех больных имелись клинические проявления ДАНК: слабость и повышенная утомляемость при ходьбе в ногах, чувство жжения, зябкости, онемения в стопах, судороги, постоянные боли в ногах ноющего, ломящего, колющего, выкручивающего характера в покое, в том числе и в ночное время, а также боли, возникающие и/или усиливающиеся при ходьбе. Объективные проявления ДАНК: нарушения трофики кожных покровов в виде истончения, сухости, шелушения, гиперкератоза, локального снижения температуры, атрофических пигментных пятен, а также дистрофия ногтей в виде ломкости и утолщенности, локальное выпадение волос и гипергидроз, ослабленная пульсация артерий стоп. Эти симптомы были более выражены у больных с длительностью СД свыше 10 лет.
Все больные были обследованы в эндокринологическом стационаре, куда поступали в связи с декомпенсацией обменных процессов и/или для лечения сосудистых осложнений. Наряду с общепринятыми традиционными методами клинического, лабораторного и инструментального обследования больных, мы использовали комплекс методов для верификации диагноза: реовазографию стоп и голеней, ультразвуковую допплерографию и термографию НК.
Диабетическая полинейропатия нижних конечностей диагностирована у 230 (92%) больных на основании клинической симптоматики и определения вибрационной, сенсорной чувствительности, мышечно-суставного чувства, сухожильных рефлексов. Из других поздних осложнений СД у обследованных нами пациентов чаще всего встречалась диабетическая ретинопатия, в основном, I стадии (непролиферативная ретинопатия), диабетическая нефропатия диагностирована у небольшого числа больных, причем стадии уремии ни у кого из них не было. У всех больных при обследовании был выявлен жировой гепатоз.
Базисная терапия СД включала физиологическую диету с индивидуальным расчетом количества хлебных единиц и инсулинотерапию. Обязательной частью лечения СД являлось обучение больных самоконтролю, в программу которого были включены занятия, посвященные профилактике поражения стоп.
У всех больных проводили лабораторное исследование состояния гемостаза и изучали антитромбогенную активность сосудистой стенки. Электрокоагулографическое исследование осуществляли на самопишущем коагулографе Н334. Агрегацию тромбоцитов определяли по методу Борна в модификации О´Брайена, в качестве индуктора агрегации использовали АДФ в конечной концентрации 2,5 мкМ; активированное парциальное тромбопластиновое время (АПТВ) – по методу Caen и соавт., содержание в плазме фибриногена – гравиметрическим методом по Р.А. Рутберг, количество растворимых фибрин-мономерных комплексов (РФМК) в плазме – орто-фенантролиновым тестом по методу В.А.Елыкомова; активность антитромбина III – по Hensen, Loeliger, общую фибринолитическую активность крови по методу Kowarzik, Buluck .
Для определения антитромбогенных свойств стенки сосудов (антиагрегационной, антикоагулянтной и фибринолитической активности) использовали окклюзионный метод.
Практически у всех больных СД при первичном исследовании выявлены нарушения в системе гемостаза в виде активации сосудисто-тромбоцитарного и прокоагулянтного звеньев гемостаза, снижения антикоагулянтной активности и замедления фибринолиза, т.е. ускорение процессов внутрисосудистого свертывания крови, приводящих не столько к хронометрической, сколько к выраженной структурной гиперкоагуляции.
Так, активация сосудисто-тромбоци-тарного звена гемостаза у больных с длительностью заболевания до 10 лет сопровождалась повышением степени агрегации тромбоцитов до 111,4 + 7,1% (в контроле – 100,3 + 6,9%, р>0,05) и максимальной скорости агрегации до 3,1 + 0,12 у.е.(по сравнению с контролем – 3,6 + 0,16 у.е., р>0,05). Об активации коагуляционного звена гемостаза свидетельствует укорочение АПТВ до 36,3 + 0,7с (в контроле – 40,2 + 0,8 с, р<0,05) и увеличение концентрации фибриногена до 3,1 + 0,07 г/л (в контроле – 2,7 + 0,05 г/л, р<0,05). Снижена антикоагулянтная активность плазмы за счет функционального угнетения активности антитромбина III (до 83,4 + 6,3%, при контроле – 100,3 + 9,2, р<0,05) и фибринолиза (замедление эуглобулинового лизиса до 217,2 + 21,3 мин., по сравнению с контролем 168,2 + 10,4 мин, р<0,05) с одновременным увеличением концентрации РФМК практически в 2 раза. По данным ЭлКГ отмечалось укорочение всех этапов образования фибринтромбоцитарной структуры (ФТС) (Т – 6,5 + 0,9 мин, при контроле 7,7 + 0,3 мин, р>0,05) и общая структурная гиперкоагуляция (структурный индекс – 1,0 + 0,08 у.е., по сравнению с контролем – 0,71 + 0,06 у.е., р<0,05).
У больных с длительностью СД более 10 лет повышение активности сосудисто-тромбоцитарного звена гемостаза сопровождалось увеличением степени агрегации тромбоцитов до 121,5 + 6,9% (в контроле – 100,3 + 6,9%, р<0,05) и максимальной скорости агрегации до 2,8 + 0,09 у.е. (по сравнению с контролем – 3,6 + 0,16 у.е., р<0,05). Происходит активация коагуляционного звена гемостаза, о чем свидетельствует укорочение АПТВ до 31,6 + 0,4 с (в контроле – 40,2 + 0,8 с, р<0,01) и увеличение концентрации фибриногена до 3,4 + 0,07 г/л (в контроле – 2,7 + 0,05 г/л, р<0,05). Снижена антикоагулянтная активность плазмы за счет уменьшения активности антитромбина III до 72,6 + 7,3% (в контроле – 100,3 + 9,2, р<0,05), происходит замедление эуглобулинового лизиса до 226,4 + 22,1 мин (по сравнению с контролем 168,2 + 10,4 мин, р<0,01) с одновременным увеличением концентрации РФМК до 5,3 + 0,04 г/л х 10‾І. По данным ЭлКГ – укорочение всех этапов образования фибринтромбоцитарной структуры (Т – 5,6 + 0,07 мин, при контроле 7,7 + 0,3 мин, р<0,05) и общая структурная гиперкоагуляция (Iстр – 1,0 + 0,06 у.е., по сравнению с контролем – 0,71 + 0,06 у.е., р<0,05).
Таким образом, у больных СД выявлены признаки исходной активации внутрисосудистого свертывания крови, степень выраженности которых зависит от длительности заболевания. Если у больных с длительностью СД до 10 лет можно было говорить только о тенденции к гиперкоагуляции, то при длительности заболевания более 10 лет все отклонения показателей гемостаза носили статистически достоверный характер.
При СД происходит изменение антитромбогенной активности сосудистой стенки: у больных с длительностью СД до 10 лет индекс антиагрегационной активности уменьшается до 1,15 + 0,07 у.е. (в контроле 1,45 + 0,07 у.е., р>0,05), а при длительности заболевания более 10 лет – до 1,03 + 0,04 у.е. (р<0,05).
У здоровых людей индекс антикоагулянтной активности равен 1,21 + 0,03 у.е.. У больных с длительностью СД до 10 лет он умеренно снижен – 1,17 + 0,05 у.е. (р>0,05). При длительности заболевания более 10 лет индекс антикоагулянтной активности сосудистой стенки равен 1,00+0,02 у.е, (р<0,05).
У здоровых людей индекс фибринолитической активности равен 1,44 + 0,06 у.е.. У больных СД до 10 лет фибринолитическая активность эндотелия сосудистой стенки умеренно снижена (индекс равен 1,30+0,03 у.е, при р>0,05), но сохранена. При длительности заболевания более 10 лет – индекс фибринолитической активности снижен до 1,11 + 0,08 у.е, при р<0,01, что свидетельствует о нарушении синтеза и освобождения в кровь тканевого активатора плазминогена.
У больных СД до 10 лет отмечено уменьшение индекса, характеризующего общую антитромбогенную активность сосудистой стенки до 1,13 + 0,04 у.е (по сравнению с контролем – 1,30 + 0,07 у.е, р>0,05). При длительности заболевания более 10 лет индекс равен 1,06 + 0,01 у.е., (р<0,05), что свидетельствует о резком снижении тромборезистентности стенки сосудов.
Полученные данные позволяют считать, что при длительности СД до 10 лет у больных с ДАНК частично сохраняются антитромбогенные свойства сосудистой стенки и установленные у этой категории больных изменения гемостаза в основном носят функциональный характер (имеются сдвиги в системе гемостаза при сниженной, но сохраненной функциональной активности сосудистой стенки по синтезу и секреции простациклина и других антиагрегантов, антитромбина III, тканевых активаторов плазминогена).
При длительности СД более 10 лет у больных с ДАНК резко снижена антитромбогенная активность сосудистой стенки, особенно ее способность к синтезу и секреции антикоагулянтов и антиагрегантов, при частично сохраненной способности к образованию и секреции тканевых активаторов плазминогена.
Заключение:
Практически у всех больных СД с диабетической ангиопатией нижних конечностей выявлены нарушения в системе гемостаза в виде активации сосудисто-тромбоцитарного и коагуляционного звеньев, снижения антикоагулянтной активности и замедления фибринолиза, степень выраженности которых зависит от длительности заболевания.
Значительное снижение тромборезистентности пораженных СД сосудов и активация процессов внутрисосудистого свертывания крови представляют высокую степень риска развития тромботических осложнений в сосудах микроциркуляции.
Библиографическая ссылка
Солун М.Н., Киричук В.Ф., Дихт Н.И. ОСОБЕННОСТИ МИКРОЦИРКУЛЯТОРНОГО ГЕМОСТАЗА ПРИ САХАРНОМ ДИАБЕТЕ // Фундаментальные исследования. – 2008. – № 6. – С. 67-69;
URL: https://fundamental-research.ru/ru/article/view?id=3217 (дата обращения: 12.10.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
