Сердечная недостаточность у больных сахарным диабетом

Сердечная недостаточность (СН) — клинический синдром, характеризующийся систолической, диастолической или комбинированной дисфункцией миокарда, классифицируется по стадиям и функциональным классам (табл. 1).
_575.gif)
СН — это клинический синдром, характеризующийся типичными симптомами (например, одышка, отеки лодыжек, усталость), что может сопровождаться признаками (например, повышенного давления в яремной вене, хрипы в легких, периферические отеки), вызванными структурной и/или функциональной патологией сердца, что приводит к уменьшению сердечного выброса и/или повышению внутрисердечного давления в состоянии покоя или при стрессе [5]. Рекомендуется выявлять СН со сниженной и сохраненной фракцией выброса (ФВ) левого желудочка (ЛЖ), а также СН со слегка сниженной ФВ ЛЖ (табл. 2).
.gif)
Распространенность СН в общей популяции равна 1–4%, а у 0,3–0,5% есть и СН, и СД 2 типа. Исследования популяций с СН показывают распространенность СД 2 типа 12–30%, растущую с возрастом [3]. СД является независимым предиктором смертности, вне зависимости от этиологии. СД является независимым фактором риска развития СН: риск развития СН у пациентов с СД по крайней мере в 2,5 раза выше, чем в общей популяции [3]. Согласно отечественным эпидемиологическим данным в структуре причин СН в РФ СД занимает 4-е место [2] (рис. 1). Риск СН у больных СД удваивается в течение каждого десятилетия после 45 лет [18]. СН наравне с поражением периферических артерий является наиболее частым вариантом дебюта сердечно-сосудистой патологии у пациентов с СД 2 типа [19].
Риск СН возрастает линейно с увеличением HbA1c. На каждый 1% увеличения HbA1c риск СН увеличивается на 8–12%. Риск развития СН у больных СД может быть более тесно связан с долгосрочным гликемическим контролем и длительностью СД, чем с HbA1c в случайный момент времени [18]. Четверть всех пациентов с СН имеют сопутствующий СД, и это число резко возрастает до 40% у пациентов, госпитализированных с острой декомпенсацией СН [18]. Общая распространенность СД при СН значительно выше, чем среди населения в целом (25% по сравнению с 9%). При этом СН с сохраненной фракцией выброса имеет несколько еще более высокую распространенность и составляет почти 40%. СД у пациентов с СН приводит к увеличению сердечно-сосудистой смертности (45% против 24% соответственно с и без СД в течение 5 лет), частоты повторных госпитализаций и времени пребывания в стационаре [18]. Госпитализация по поводу СН — один из самых значимых факторов риска сердечно-сосудистой смерти у пациентов с СД 2 типа: риск смерти в течение ближайших 18 месяцев повышается в 5 раз (ОР 4,96, 95% ДИ 3,29–7,47). При этом ОР смерти после перенесенного инфаркта миокарда (ИМ) — 3,12; после инсульта — 3,08 [6, 14]. Наиболее плохой прогноз имеют пациенты с СД и СН двух групп: с бессимптомной ишемической кардиомиопатией и пациенты с сохраненной ФВ ЛЖ [18].
Длительно сохраняющаяся гипергликемия может, даже в отсутствие других факторов риска (ИБС, АГ или пороки клапанов), поражать миокард, повышая риск его дисфункции. Снижение эластичности ЛЖ — ранний признак диабетической кардиомиопатии (ДКМП) — может быть обнаружено уже в начале развития СД [3, 10]. У пациентов с СД при клинических признаках СН и отсутствии ИБС, пороков сердца, АГ, врожденных, инфильтративных заболеваний сердца правомочно говорить о наличии ДКМП [9] (табл. 3).
![Характеристика клинических фенотипов ДКМП [9]](/FileStorage/ARTICLE/Lechacshij_vrach/2017-12/12_17/13208967/Lechacshij_vrach_042-2_(9011).gif)
Диастолическая дисфункция (ДД) регистрируется у пациентов с СД 2 типа без сопутствующей сердечно-сосудистой патологии в 50–75% случаев [8] и рассматривается исследователями как проявление диабетической кардиомиопатии [7]. Высокая частота коморбидности СН и СД объясняется общностью многих патогенетических факторов (рис. 2). Ввиду частого сочетания СД, АГ и ИБС остается спорным, в каких случаях ДД напрямую обусловлена гликометаболическим расстройством, а в каких — совместным действием всех этих факторов.
.gif)
.gif)
Диагностика СН у пациентов с СД основывается на общих принципах — оценке симптомов и признаков при физикальном и лабораторно-инструментальном обследовании (рис. 3).
Задачи при лечении ХСН: предотвращение развития симптомной ХСН (для I стадии ХСН); устранение симптомов ХСН (для стадий IIA–III); замедление прогрессирования болезни путем защиты сердца и других органов-мишеней (мозг, почки, сосуды) (для стадий I–III); улучшение качества жизни (для стадий IIA–III); уменьшение количества госпитализаций (и расходов) (для стадий I–III); улучшение прогноза (для стадий I–III) [2]. Три нейрогуморальных антагониста (иАПФ/БРА, бета-блокатор и антагонист минералокортикоидных рецепторов) представляют важные фармакологические средства лечения всех пациентов с систолической СН, включая больных СД [3]. Обычно они комбинируются с диуретиками для борьбы с застоем крови; к ним можно добавлять ивабрадин [3]. При СД рекомендуемые дозы препаратов, модифицирующих течение СН со сниженной ФВ или после инфаркта миокарда, — как в общей популяции (табл. 4).
.gif)
У пациентов с СД следует учитывать возможные метаболические эффекты препаратов (табл. 5). Среди основных средств лечения ХСН преимущество имеют иАПФ/БРА, которые уменьшают риск развития СД, с одной стороны, и уменьшают шансы на развитие ХСН у больных СД [2]. При СД рекомендуемые дозы диуретиков — как в общей популяции (табл. 6).
![Особенности терапии СН у пациентов с СД [1–3]](/FileStorage/ARTICLE/Lechacshij_vrach/2017-12/12_17/13208967/Lechacshij_vrach_044-2_(6281)_575.gif)
.gif)
_575.gif)
Лечение СН со сниженной ФВ у пациентов с СД проводится по общим принципам (рис. 4). Ресинхронизирующая терапия — метод, рекомендуемый для лечения СН, показавший снижение смертности у пациентов с III–IV функционального класса по NYHA и ФВ ЛЖ ≤ 35% на фоне фармакологической терапии при синусовом ритме с увеличением длительности QRS (≥ 130 мс). Несмотря на нехватку данных анализа подгрупп, нет оснований считать, что эффект ресинхронизации должен отличаться при наличии СД у пациентов [3]. Трансплантация сердца является принятым методом лечения СН конечной стадии. Наличие СД — это не противопоказание, но должны быть соблюдены строгие критерии отбора. Более высокая вероятность цереброваскулярной болезни, сниженной функции почек и повышенный риск инфекции должны быть учтены и могут сделать трансплантацию противопоказанной, что случается чаще у пациентов с СД, чем без него [3].
Лечение СН с сохраненной или слегка сниженной ФВ у пациентов с сахарным диабетом, как и в общей популяции, не разработано. Данные по снижению частоты госпитализаций и смертности противоречивы. При синусовом ритме существуют некоторые свидетельства снижения госпитализаций при применении небиволола, дигоксина, спиронолактона и кандесартана. При фибрилляции предсердий бета-блокаторы не продемонстрировали соответствующую эффективность, дигоксин не изучался; данные по иАПФ и БРА не достаточны. Антагонисты РАССА (иАПФ, БРА, АМР) не показали эффективность. В общей популяции у пожилых пациентов небиволол снижал комбинированную конечную точку (сердечно-сосудистую смерть и госпитализации) вне связи с исходным уровнем ФВ. Для устранения симптомов рекомендуется применение диуретиков. В целом для устранения/улучшения симптомов данного варианта СН необходимы специфические вмешательства.
Следует предполагать, что именно этот вариант СН является наиболее частым у пациентов с СД, что, безусловно, актуализирует исследования в этой когорте пациентов. Изучение возможностей профилактического и/или лечебного воздействия в контексте ДД, как одного из наиболее ранних маркеров формирования хронической сердечной недостаточности, остается актуальным.
Особенности гипогликемической терапии пациентов с СД 2-го типа и СН
Несмотря на сложность патогенетических взаимодействий между СД и СН, успешное лечение СД и его осложнений позволяет существенно уменьшить риск развития СН [2]. Как в профилактике наступления СН, так и в предупреждении развития неблагоприятных исходов нет данных о преимуществах жесткого контроля гликемии [16]. Обязательное условие — избегание гипогликемии: интенсивная гипогликемическая терапия при СН может быть опасна. У пациентов с СД и СН эффект HbA1c на уровень смертности характеризуется U-образной формой кривой. Самая высокая смертность наблюдается у больных с HbA1c > 7,8% и HbA1c < 7,1%. Оптимальный уровень HbA1c у больных СД и СН для снижения риска смерти составляет приблизительно 7,5% [18]. В целом у больных СД и СН гликемический контроль должен осуществляться постепенно и умеренно, предпочтение следует отдавать тем лекарственным средствам, которые безопасны и эффективны (табл. 7).
_575.gif)
В отличие от того, что считалось ранее, метформин безопасен у пациентов с СН и сниженной ФВ и должен быть препаратом выбора у пациентов с СН и СД 2 типа [5]. Положительные результаты лечения пациентов с ХСН и СД 2 типа метформином были получены в российском проспективном исследовании РЭМБО [2]. У пациентов со стабильным течением ХСН метформин может использоваться при условии сохранения функции почек, за исключением пациентов нестабильных или госпитализированных по поводу ХСН [9]. Хотя метформин у пациентов с СД 2 типа по результатам последнего метаанализа не продемонстрировал преимуществ в отношении снижения риска сердечно-сосудистой и общей смертности, инфаркта миокарда, мозгового инсульта [15], его применение при СН следует расценивать как безопасное [1].
У пациентов с симптомной ХСН, риском развития ХСН тиазолидиндионы не должны применяться [1, 3, 9, 20]. Результаты исследований иДПП-4 демонстрируют различные эффекты препаратов на риск ХСН. Саксаглиптин по результатам исследования SAVOR-TIMI 53 на 27% повышает риск госпитализаций по поводу СН вне зависимости от возраста пациентов. Механизм обнаруженного эффекта неизвестен, препарат следует применять с осторожностью у больных с выраженными стадиями СН [17]. По результатам исследования EXAMINE недостоверное повышение госпитализации по поводу СН отмечалось в общей группе пациентов, получавших алоглиптин (HR 1,19, 95% ДИ 0,90, 1,58; p = 0,22), а в подгруппе пациентов без СН в анамнезе (с исходно более высоким уровнем МНУП) достоверное повышение риска госпитализаций по поводу СН составило 76% (HR 1,76; 95% ДИ 1,07, 2,90; p = 0,026) [14]. По результатами РКИ эмпаглифлозин улучшает показатели, характеризующие течение СН у пациентов с СД 2 типа: снижает количество госпитализаций по поводу СН на 35%; снижает количество госпитализаций по поводу СН или смерть в связи с СН — на 39%, снижает число новых случаев СН (по критериям СН, избранным исследователями; в частности СН с ФВ ЛЖ < 35%) — на 30%; частоту композитных исходов — госпитализаций по поводу СН или назначение петлевых диуретиков на 37%; госпитализаций по поводу СН или сердечно-сосудистой смерти или назначение петлевых диуретиков на 36% [12]. Согласно отечественным рекомендациям эмпаглифлозин — препарат первого выбора у пациентов с СД 2 типа и СН (табл. 8).
.gif)
Заключение
Сахарный диабет является независимым фактором риска развития СН. СН наравне с поражением периферических артерий является наиболее частым вариантом дебюта сердечно-сосудистой патологии у пациентов с СД 2 типа. СД у пациентов с СН приводит к увеличению сердечно-сосудистой смертности, частоты повторных госпитализаций и времени пребывания в стационаре. Диагностика и лечение СН у пациентов с СД основывается на общих принципах. Среди основных средств лечения ХСН преимущество имеют иАПФ/БРА. У пациентов с СД следует учитывать возможные метаболические эффекты препаратов, применяемых для терапии СН. Оптимальный уровень HbA1c у больных СД и СН для снижения риска смерти составляет приблизительно 7,5%. У больных СД и СН гликемический контроль должен осуществляться постепенно и умеренно, отдавать предпочтение следует тем лекарственным средствам, которые безопасны и эффективны [4].
Литература
- Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под ред. И. И. Дедова, М. В. Шестаковой. 8-е изд. М., 2017 // Сахарный диабет. 2017; 20 (1 S): 1–112. DOI: 10.14341/DM20171 S8.
- Мареев В. Ю., Агеев Ф. Т., Арутюнов Г. П. и др. Национальные рекомендации ОССН, РКО и РНМОТ по диагностике и лечению ХСН (четвертый пересмотр) // Сердечная недостаточность. 2013; 14, № 7 (81): 379–472.
- Рекомендации по диабету, предиабету и сердечно-сосудистым заболеваниям. EASD/ESC. Рабочая группа по диабету, предиабету и сердечно-сосудистым заболеваниям европейского общества кардиологов (ESC) в сотрудничестве с европейской ассоциацией по изучению диабета (EASD) // Российский кардиологический журнал. 2014; 3 (107): 7–61.
- Друк И. В., Нечаева Г. И. Сахарный диабет 2-го типа для кардиологов. М.: ООО «МИА», 2017. 208 с.
- 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology ESC) // Eur. Heart J. DOI: 10.1093/eurheartj/ehw128.
- White W. B., Cannon C. P., Heller S. R. et al. Alogliptin after acute coronary syndrome in patients with type 2 diabetes // N Engl J Med. 2013. № 369. Р. 1327–1335.
- Bell D. S. Diabetic cardiomyopathy: a unique entity or a complication of coronary artery disease? // Diabetes Care. 1995; 18: 708–714.
- Boyer J. K., Thanigaraj S., Schechtman K. B., Peґrez J. E. Prevalence of Ventricular Diastolic Dysfunction in Asymptomatic, Normotensive Patients With Diabetes Melli-tus // Am J Cardiol. 2004; 93: 870–875.
- Cardiovascular Disease and Risk Management. ADA Position statement 2014 // Diabetes Care. 2015; 38 (Suppl. 1): S49–S57. DOI: 10.2337/dc15-S011.
- Seferovic P. M., Paulus W. J. Clinical diabetic cardiomyopathy: a two-faced disease with restrictive and dilated phenotypes // Eur Heart J. 2015; 36: 1718–1727.
- Leiter L. A. et al. for the SAVOR-TIMI 53 Steering Committee and Investigators Efficacy and Safety of Saxagliptin in Older Participants in the SAVOR-TIMI 53 Trial // Diabetes Care. 2015; 38 (6): 1145–1153.
- Zinman B. et al. for the EMPA-REG OUTCOME Investigators Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes // NEJM. 2015. DOI: 10.1056/NEJMoa1504720.
- Zannad F., Cannon C. P., Cushman W. C. et al. Heart failure and mortality outcomes in patients with type 2 diabetes taking alogliptin versus placebo in EXAMINE: a multicentre, randomised, double-blind trial // Lancet. 2015; 385: 2067–2076.
- Fitchett D., Zinman B., Wanner Ch. et al. Heart failure outcomes with empagliflozin in patients with type 2 diabetes at high cardiovascular risk: results of the EMPA-REG OUTCOME® trial // Eur. Heart J. 2016. DOI: 10.1093/eurheartj/ehv728.
- Griffin J., Leaver J. K., Irving G. J. Impact of metformin on cardiovascular disease: a meta-analysisof randomised trials among people with type 2 diabetes // Diabetologia. 2017; 60: 1620–1629.
- Turnbull F. M., Abraira C., Anderson R. J. et al. Intensive glucose control and macrovascular outcomes in type 2 diabetes // Diabetologia. 2009. № 52. Р. 2288–2298.
- Scirica B. M., Bhatt D. L., Braunwald E. et al. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus // N Engl J Med. 2013; 369 (14): 1317–1326.
- Campbell P., Krim S., Ventura H. The Bi-Directional Impact Of Two Chronic Illnesses: Heart Failure And Diabetes — A Review Of The Epidemiology And Outcomes // Cardiac Failure Review. 2015; 1 (1): 8–10.
- Shah A. D., Langenberg C., Rapsomaniki E. et al. Type 2 diabetes and incidence of cardiovascular diseases: a cohort study in 1·9 million people // Lancet Diabetes Endocrinol. 2015. № 3. Р. 105–113.
- Клинические рекомендации. Хроническая сердечная недостаточность (ХСН), 2016. https://www.scardio.ru/rekomendacii/rekomendacii_rko_close/.
И. В. Друк1, доктор медицинских наук, профессор
Г. И. Нечаева, доктор медицинских наук, профессор
ГБОУ ВПО ОмГМУ МЗ РФ, Омск
1 Контактная информация: drukinna@yandex.ru
Сердечная недостаточность и СД 2 типа/И. В. Друк, Г. И. Нечаева
Для цитирования: Лечащий врач №12/2017; Номера страниц в выпуске: 41-47
Теги: диабетические осложнения, сердце, коморбидность, гипогликемическая терапия
Купить номер с этой статьей в pdf
Введение
Сахарный диабет (СД) признан экспертами ВОЗ неинфекционной эпидемией и представляет собой серьезную медико-социальную проблему. В 2010 г. СД страдало около 6,4% (285 млн) жителей планеты. К 2030 г. ожидается увеличение количества больных до 7,7% (439 млн человек) [1]. Ишемическая болезнь сердца (ИБС) является основной причиной смерти больных СД [2], причем 90% этих больных страдает СД 2 типа (СД 2) [3].
Наличие СД сопряжено с возникновением всех форм ИБС — стенокардии, безболевой ишемии миокарда (БИМ), инфаркта миокарда (ИМ), внезапной сердечной смерти [4]. При этом макрососудистые осложнения, включая ИБС, инсульт, заболевания периферических сосудов, являются причиной смертности больных СД в 67% случаев [5]. Основываясь на имеющихся данных, можно рассматривать СД как своеобразное ССЗ [6]. В 50% случаев повышение риска развития сердечно-сосудистых поражений при СД 2 объясняется большей частотой и выраженностью традиционных факторов риска у больных СД [7]. Факторами риска у больных СД считаются: дислипидемия, артериальная гипертензия (АГ), курение, наследственная предрасположенность по ИБС, наличие микро- и макроальбуминурии.
Сахарный диабет и нарушения липидного обмена
Изучение особенностей распространенности, методов диагностики и лечения дислипидемии представляет особый интерес у больных СД. Сведения о распространенности дислипидемии у пациентов с СД 2 представлены в таблице 1 [8].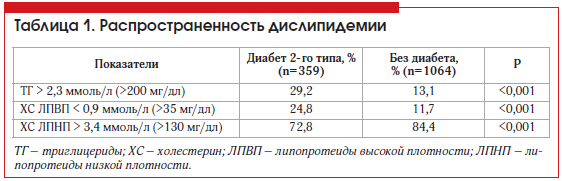
Следует особо отметить гипертриглицеридемию (ГТ) и уменьшение уровня холестерина (ХС) липопротеидов высокой плотности (ЛПВП) [10, 11]. У больных СД 2 выделяют гиперпродукцию «малых, плотных» липопротеидов низкой плотности (ЛПНП) [12]. При этом 69% больных СД имеют нарушения липидного обмена [13]. Атерогенное действие дислипидемии усиливается при присоединении диабетических нарушений углеводного обмена. Для больных, страдающих СД, наиболее характерна следующая липидная триада при СД: гипертриглицеридемия, увеличение процентного содержания «малых, плотных» ЛПНП, снижение концентрации ЛПВП. Данные изменения липидного спектра способствуют развитию атеросклероза независимо от повышения уровня общего ХС и общей фракции ХС ЛПНП.
Учитывая важную роль триглицеридов (ТГ) в развитии дислипидемии при СД 2, приводим классификацию уровней ТГ в сыворотке крови (табл. 2) [14]. 
Большое значение в развитии раннего коронарного атеросклероза имеет специфическое нарушение липидного обмена у больных СД 2 – диабетическая дислипидемия.
Сахарный диабет, ишемическая болезнь сердца и артериальная гипертония
Эпидемиологические данные свидетельствуют о существовании достоверной связи между уровнем гликозилированного гемоглобина и риском сердечно-сосудистой заболеваемости и смертности. При увеличении уровня гликозилированного гемоглобина на 1% риск развития ССЗ возрастает на 10% [15].
Инсулинорезистентность также играет важнейшую роль в патогенезе СД 2. Гиперинсулинемия тесно связана с метаболическим синдромом, который включает в себя инсулинорезистентность, АГ и ожирение и сопровождается высоким риском ССО.
Изменение концентрации липидов плазмы крови при СД 2 является предиктором ИБС. Установлено, что у лиц с высоким уровнем глюкозы в крови натощак и после нагрузки отмечается достоверно более высокая смертность от ССЗ [16]. Бессимптомная гипергликемия, особенно у женщин, является существенным фактором риска развития ИБС [17].
Влияние гиперинсулинемии и инсулинорезистентности на развитие атеросклероза связано с воздействием на процессы свертывания крови [18]. Отмечаются гиперкоагуляция и депрессия фибринолиза, что может способствовать внутрикоронарному тромбозу. У пациентов с СД 2 выявляется повреждение эндотелия и его дисфункция, что является дополнительным фактором повышенного риска развития ИБС.
Основная причина смертности больных СД – ССО, составляющие до 80%. Смертность от ИМ среди больных СД составляет 39% [19], от инсульта – превышает таковую у лиц без диабета [5]. При сочетании АГ и СД в 2–4 раза возрастает риск развития ИБС, что прямо коррелирует с длительностью СД [20]. АГ обнаруживается у 20–60% больных СД 2, она встречается в 1,5 раза чаще, чем у лиц без СД. Наличие АГ при СД увеличивает риск макрососудистых (ИБС, СН, инсульт) и микрососудистых (диабетическая ретинопатия, нефропатия) осложнений [21]. Важным является тот факт, что у больных АГ и СД преимущества антигипертензивной терапии более выражены, чем у больных без СД. В связи с этим строгий контроль АД у данной группы больных крайне необходим.
При СД возможно возникновение всех форм ИБС, как болевых, так и, особенно, безболевых. Наличие микроангиопатий и невропатий при СД способствует формированию безболевых вариантов ИБС (безболевые ИМ, атипичные приступы стенокардии), протекающих в форме нарушений сердечного ритма и сердечной недостаточности. У больных СД в 2 раза чаще встречается безболевой ИМ, что связывают с автономной кардиальной невропатией. При СД частой формой ИБС является БИМ. Она заключается в преходящих нарушениях метаболизма, функции, перфузии, электрической активности миокарда, которые не проявляются приступами стенокардии или их эквивалентами.
Клинические особенности ИБС у больных СД следующие:
– одинаковая частота у мужчин и женщин;
– высокая частота безболевых форм ИБС (БИМ, безболевой ИМ);
– частое развитие постинфарктных осложнений;
– смертность в остром (10 дней) и подостром (4–8 нед.) периодах ИМ в 2 раза превышает таковую у лиц без СД.
При наличии СД следует стремиться к возможной ликвидации всех эпизодов ишемии миокарда, а не только к купированию типичных приступов стенокардии (избавление от «общего ишемического бремени» — total ischemic burden). Этого можно достичь путем снижения частоты и продолжительности эпизодов депрессий сегмента ST при холтеровском мониторировании ЭКГ, которое должно шире использоваться у пациентов с СД для оценки эффективности антиишемического лечения.
Сахарный диабет и поражение почек
Наиболее ранний маркер поражения почек при СД – микроальбуминурия, она является предвестником диабетической нефропатии и существенным фактором риска формирования сердечно-сосудистой патологии. Стойкая альбуминурия на уровне 30–299 мг / 24 ч (или микроальбуминурия) служит маркером нефропатии и одновременно маркером риска развития ССО [22].
Сахарный диабет и сердечная недостаточность
Фремингемское исследование достаточно убедительно подтвердило повышение риска развития сердечной недостаточности (СН) у больных СД – у мужчин в 4 раза, у женщин – в 8 раз чаще, чем у лиц без СД. По данным российского исследования ЭПОХА, наличие СН является существенным предиктором развития СД в дальнейшем. В общей популяции распространенность СД составляет 2,9%, а среди больных с СН III–IV ФК – 15,8%. При ХСН наличие инсулин-независимого СД заметно ухудшает прогноз пациентов, особенно женщин (на 45%).
При СД миокард поражается независимо от наличия атеросклероза коронарных артерий (диабетическая кардиомиопатия). Изменения в сосудах сердца проявляются в виде микроангиопатий, нарушается микроциркуляция, отмечаются морфофункциональные изменения миокарда. Нарушается биоэлектрическая активность миокарда, снижается его сократительная способность с тенденцией к развитию декомпенсации кровообращения. При длительном течении СД, особенно 2 типа, атеросклеротические изменения касаются не только магистральных артерий, но и артерий среднего и малого калибра. Также у больных СД 2 выражена гипертрофия миокарда, способствующая нарушению коронарного кровообращения. Прогрессирование гипертрофии и дилатации левого желудочка (ЛЖ) снижает сократительную функцию, происходит напряжение стенок во время систолы, что способствует увеличению потребности миокарда в кислороде и развитию кардиосклероза. При СД нередко развивается гиперкинетический вариант центральной гемодинамики с увеличением объема циркулирующей крови, тахикардией [23].
Диабетическая кардиомиопатия проявляется гипертрофией кардиомиоцитов, миокардиальным фиброзом. Повышенное содержание коллагена в миокарде, гипертрофия ЛЖ приводят к потере эластичности с появлением жесткости, ригидности сердечной мышцы.
Таким образом, снижение сократительной способности миокарда при СД и ИБС обусловлено кардиальными и некардиальными факторами. Диабетическая миокардиодистрофия в своей основе связана с нарушением метаболизма кардиомиоцитов, имеют значение также диабетическая вегетоневропатия и микроангиопатия [24]. Кардиальные нарушения у больных СД 2 характеризуются также нарушением диастолической функции ЛЖ. В формировании поражения сердца при СД принимает участие ряд патогенетических механизмов: макроангиопатия с атеросклерозом коронарных артерий, нарушение метаболизма миокарда, расстройства микроциркуляции в форме диабетической микроангиопатии.
Поражение сердца при СД требует профилактического и лечебного воздействия.
Лечение дислипидемии у больных сахарным диабетом
Коррекция дислипидемии при СД осуществляется по тем же принципам, что и у больных ИБС. Статины являются препаратами первого выбора. При этом не стоит забывать о том, что улучшение прогноза у пациентов с СД, ИБС и СН предполагает обязательный жесткий метаболический контроль за целевыми уровнями глюкозы и АД. Контроль за гликемией является важной основой лечения больных СД. Клинические исследования DCCT [25], UKPDS [26] показали, что улучшение гликемического контроля сопровождается устойчивым снижением риска ретинопатии, нефропатии, а также достоверным снижением риска микрососудистых осложнений на 25% и недостоверной тенденцией к уменьшению риска ИМ на 16%.
Целью гиполипидемической терапии при СД является достижение уровня общего ХС < 4,5 ммоль/л, ХС ЛПНП < 2,6 ммоль/л. Оптимальный уровень ХС ЛПВП – 1,02 ммоль/л у мужчин и > 1,28 ммоль/л у женщин [27], концентрация ТГ < 1,7 ммоль/л. В плане снижения уровня ХС ЛПНП ведущая роль принадлежит статинам; фибраты (фенофибрат, гемфибразил, ципрофибрат и др.) особенно эффективны в уменьшении уровня ТГ и в увеличении уровня ХС ЛПВП. Пациентам со смешанной гиперлипидемией показано назначение комбинированной терапии (статины + фибраты).
По результатам нескольких метаанализов последних лет установлен диабетогенный эффект терапии статинами [28–30], который имеет дозозависимый характер и прямую связь с наличием факторов риска ССЗ. Вопрос о назначении статинов пациентам с СД имеет множество нюансов, требуя индивидуального подхода. Не оставляют сомнений положительные эффекты назначения статинов. У пациентов с СД предпочтение следует отдавать назначению статинов с наиболее выраженным гиполипидемическим эффектом – розувастатину и аторвастатину. Самый крупный метаанализ по оценке влияния снижения уровня ЛПНП на риск развития сердечно-сосудистых событий был выполнен в 2010 г. и включил в себя 26 клинических исследований с участием 170 тыс. пациентов [31]. Среднее время наблюдения составило 5,1 года. Анализ показал, что снижение уровня ЛПНП на 1 ммоль/л приводит к 10-процентному снижению риска общей смерти, 20-процентному снижению риска сердечно-сосудистой смертности, 11-процентному снижению риска сердечно-сосудистых событий. В 2015 г. приняты рекомендации Американской ассоциации по лечению СД (ADA), основные положения которых во многом повторяют положения, изложенные в IAS и ACC/AHA. При назначении терапии статинами учитывают наличие уровня риска ССЗ [32].
Лечение артериальной гипертонии у больных сахарным диабетом
Наиболее часто АГ и ССЗ развиваются на фоне уже существующего СД 2. Такое сочетание несет в себе риск быстрого развития и прогрессирования ССО, характерных как для АГ, так и для СД, поскольку органы-мишени для АГ и СД одни и те же: миокард, венечные артерии, сосуды мозга, почек и сетчатки. При подобном сочетании частота развития ИБС возрастает в 3,5–4 раза, острого нарушения мозгового кровообращения (ОНМК) – в 3 раза, хронической почечной недостаточности (ХПН) – в 30 раз, полной потери зрения вследствие ретинопатии – в 4–5 раз по сравнению с изолированным эффектом AГ.
Развитие АГ при СД 2 связано с активацией механизмов, регулирующих уровень АД, что прежде всего касается гиперактивации симпатической нервной системы (СНС). Под влиянием активации СНС нарушается обмен норадреналина, что приводит к выраженной тканевой гиперсимпатикотонии, симпатической стимуляции сердца, сосудов, почек, способствуя повышению АД.
Контроль уровня АД, по данным Международной федерации диабета (1999), способствует снижению риска ССО у больных СД 2 на 51%.
Целевой уровень АД у больных СД ниже, чем у пациентов без СД – 130/80 мм рт. ст., а при наличии выраженной нефропатии – 125/75 мм рт. ст. При достижении такого уровня удается затормозить прогрессирование сосудистых осложнений при СД. Препаратами первого выбора являются ингибиторы ангиотензинпревращающего фермента (иАПФ) и антагонисты рецепторов ангиотензина II (АРАII). Могут также использоваться медленнодействующие, пролонгированные антагонисты кальция (АК) (амлодипин, нормодипин, лацидипин и др.) и кардиоселективные β-адреноблокаторы (метопролол, карведилол, небиволол, бисопролол и др.).
У пациентов с СД с повышенной активностью СНС и АГ целесообразно применять препараты, снижающие ее активацию, в частности β-адреноблокаторы, которые широко используются при СД 2, особенно при его сочетании с АГ. Следовательно, β-адреноблокаторы, так же как и иАПФ, АРАII, предотвращают развитие кардиальных осложнений при СД 2. Ряд β-адреноблокаторов, имеющих свойства селективных β-адреноблокаторов, обладающих сосудорасширяющей и протективной активностью, показаны для применения у больных СД 2 и АГ. К таким препаратам относятся: бисопролол, небиволол, карведилол и др. Целесообразно также применение у больных СД 2 и АГ комбинации АРАII и антагониста кальция амлодипина.
Важность учета при длительной антигипертензивной терапии метаболических эффектов, и в частности развития СД, подчеркивается в последних европейских рекомендациях по АГ.
Лечение ХСН у больных сахарным диабетом
Патогенез и лечение ХСН у пациентов с СД имеют определенные особенности, которые следует учитывать при проведении рациональной терапии. Лечение СН у больных с СД в основном соответствует общепринятым принципам терапии ХСН. Однако непременной особенностью лечения подобных пациентов является тщательный динамический контроль за основными метаболическими показателями.
Основными средствами лечения СН при СД являются иАПФ и АРАII, эффективность которых превосходит, по данным российского исследования ФАСОН [33, 35], терапию декомпенсации кровообращения у пациентов бeз СД.
В метаанализе (исследование САРРР), посвященном сравнению эффективности иАПФ, β-адреноблокаторов, АК и диуретиков при лечении больных АГ и СД, было показано, что назначение иАПФ и АРАII достоверно снижает риск острого ИМ на 48%, ССО – на 32%.
Приоритетными являются современные кардиоселективные и неселективные β-адреноблокаторы со свойствами непрямых вазадилататоров (метопролол, небиволол, бисопролол, карведилол и др.). Гемодинамические эффекты карведилола заключаются в снижении общего периферического сопротивления сосудов (ОПСС) и преднагрузки, увеличении сердечного выброса без рефлекторной тахикардии. Кроме того, препарат обладает антиоксидантной и антиаритмической активностью, вазопротекторным эффектом. Перечисленные свойства делают карведилол весьма ценным при лечении больных с сочетанием СД и ХСН.
АК снижают частоту и продолжительность БИМ. Предпочтительнее использование вазоселективных и долгодействующих АК (амлодипин, фелодипин и др.), не вызывающих рефлекторную тахикардию, увеличение уровня катехоламинов и проишемический эффект. Кроме того, АК обладают антиатерогенным действием.
Среди диуретиков используются калийсберегающие средства (альдактон, верошпирон), индапамид; осторожно следует назначать петлевые и тиазидные диуретики – под контролем показателей углеводного обмена и уровня калия в крови.
Целесообразно применение метаболических средств – триметазидина и др.
