Сердечно сосудистая система при сахарном диабете
Введение
Сахарный диабет (СД) признан экспертами ВОЗ неинфекционной эпидемией и представляет собой серьезную медико-социальную проблему. В 2010 г. СД страдало около 6,4% (285 млн) жителей планеты. К 2030 г. ожидается увеличение количества больных до 7,7% (439 млн человек) [1]. Ишемическая болезнь сердца (ИБС) является основной причиной смерти больных СД [2], причем 90% этих больных страдает СД 2 типа (СД 2) [3].
Наличие СД сопряжено с возникновением всех форм ИБС — стенокардии, безболевой ишемии миокарда (БИМ), инфаркта миокарда (ИМ), внезапной сердечной смерти [4]. При этом макрососудистые осложнения, включая ИБС, инсульт, заболевания периферических сосудов, являются причиной смертности больных СД в 67% случаев [5]. Основываясь на имеющихся данных, можно рассматривать СД как своеобразное ССЗ [6]. В 50% случаев повышение риска развития сердечно-сосудистых поражений при СД 2 объясняется большей частотой и выраженностью традиционных факторов риска у больных СД [7]. Факторами риска у больных СД считаются: дислипидемия, артериальная гипертензия (АГ), курение, наследственная предрасположенность по ИБС, наличие микро- и макроальбуминурии.
Сахарный диабет и нарушения липидного обмена
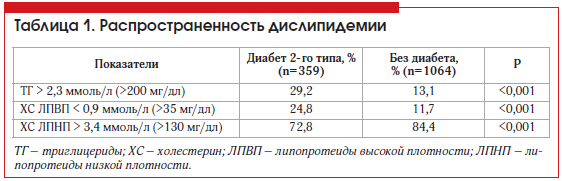
Изучение особенностей распространенности, методов диагностики и лечения дислипидемии представляет особый интерес у больных СД. Сведения о распространенности дислипидемии у пациентов с СД 2 представлены в таблице 1 [8].
Следует особо отметить гипертриглицеридемию (ГТ) и уменьшение уровня холестерина (ХС) липопротеидов высокой плотности (ЛПВП) [10, 11]. У больных СД 2 выделяют гиперпродукцию «малых, плотных» липопротеидов низкой плотности (ЛПНП) [12]. При этом 69% больных СД имеют нарушения липидного обмена [13]. Атерогенное действие дислипидемии усиливается при присоединении диабетических нарушений углеводного обмена. Для больных, страдающих СД, наиболее характерна следующая липидная триада при СД: гипертриглицеридемия, увеличение процентного содержания «малых, плотных» ЛПНП, снижение концентрации ЛПВП. Данные изменения липидного спектра способствуют развитию атеросклероза независимо от повышения уровня общего ХС и общей фракции ХС ЛПНП.
Учитывая важную роль триглицеридов (ТГ) в развитии дислипидемии при СД 2, приводим классификацию уровней ТГ в сыворотке крови (табл. 2) [14]. 
Большое значение в развитии раннего коронарного атеросклероза имеет специфическое нарушение липидного обмена у больных СД 2 – диабетическая дислипидемия.
Сахарный диабет, ишемическая болезнь сердца и артериальная гипертония
Эпидемиологические данные свидетельствуют о существовании достоверной связи между уровнем гликозилированного гемоглобина и риском сердечно-сосудистой заболеваемости и смертности. При увеличении уровня гликозилированного гемоглобина на 1% риск развития ССЗ возрастает на 10% [15].
Инсулинорезистентность также играет важнейшую роль в патогенезе СД 2. Гиперинсулинемия тесно связана с метаболическим синдромом, который включает в себя инсулинорезистентность, АГ и ожирение и сопровождается высоким риском ССО.
Изменение концентрации липидов плазмы крови при СД 2 является предиктором ИБС. Установлено, что у лиц с высоким уровнем глюкозы в крови натощак и после нагрузки отмечается достоверно более высокая смертность от ССЗ [16]. Бессимптомная гипергликемия, особенно у женщин, является существенным фактором риска развития ИБС [17].
Влияние гиперинсулинемии и инсулинорезистентности на развитие атеросклероза связано с воздействием на процессы свертывания крови [18]. Отмечаются гиперкоагуляция и депрессия фибринолиза, что может способствовать внутрикоронарному тромбозу. У пациентов с СД 2 выявляется повреждение эндотелия и его дисфункция, что является дополнительным фактором повышенного риска развития ИБС.
Основная причина смертности больных СД – ССО, составляющие до 80%. Смертность от ИМ среди больных СД составляет 39% [19], от инсульта – превышает таковую у лиц без диабета [5]. При сочетании АГ и СД в 2–4 раза возрастает риск развития ИБС, что прямо коррелирует с длительностью СД [20]. АГ обнаруживается у 20–60% больных СД 2, она встречается в 1,5 раза чаще, чем у лиц без СД. Наличие АГ при СД увеличивает риск макрососудистых (ИБС, СН, инсульт) и микрососудистых (диабетическая ретинопатия, нефропатия) осложнений [21]. Важным является тот факт, что у больных АГ и СД преимущества антигипертензивной терапии более выражены, чем у больных без СД. В связи с этим строгий контроль АД у данной группы больных крайне необходим.
При СД возможно возникновение всех форм ИБС, как болевых, так и, особенно, безболевых. Наличие микроангиопатий и невропатий при СД способствует формированию безболевых вариантов ИБС (безболевые ИМ, атипичные приступы стенокардии), протекающих в форме нарушений сердечного ритма и сердечной недостаточности. У больных СД в 2 раза чаще встречается безболевой ИМ, что связывают с автономной кардиальной невропатией. При СД частой формой ИБС является БИМ. Она заключается в преходящих нарушениях метаболизма, функции, перфузии, электрической активности миокарда, которые не проявляются приступами стенокардии или их эквивалентами.
Клинические особенности ИБС у больных СД следующие:
– одинаковая частота у мужчин и женщин;
– высокая частота безболевых форм ИБС (БИМ, безболевой ИМ);
– частое развитие постинфарктных осложнений;
– смертность в остром (10 дней) и подостром (4–8 нед.) периодах ИМ в 2 раза превышает таковую у лиц без СД.
При наличии СД следует стремиться к возможной ликвидации всех эпизодов ишемии миокарда, а не только к купированию типичных приступов стенокардии (избавление от «общего ишемического бремени» — total ischemic burden). Этого можно достичь путем снижения частоты и продолжительности эпизодов депрессий сегмента ST при холтеровском мониторировании ЭКГ, которое должно шире использоваться у пациентов с СД для оценки эффективности антиишемического лечения.
Сахарный диабет и поражение почек
Наиболее ранний маркер поражения почек при СД – микроальбуминурия, она является предвестником диабетической нефропатии и существенным фактором риска формирования сердечно-сосудистой патологии. Стойкая альбуминурия на уровне 30–299 мг / 24 ч (или микроальбуминурия) служит маркером нефропатии и одновременно маркером риска развития ССО [22].
Сахарный диабет и сердечная недостаточность
Фремингемское исследование достаточно убедительно подтвердило повышение риска развития сердечной недостаточности (СН) у больных СД – у мужчин в 4 раза, у женщин – в 8 раз чаще, чем у лиц без СД. По данным российского исследования ЭПОХА, наличие СН является существенным предиктором развития СД в дальнейшем. В общей популяции распространенность СД составляет 2,9%, а среди больных с СН III–IV ФК – 15,8%. При ХСН наличие инсулин-независимого СД заметно ухудшает прогноз пациентов, особенно женщин (на 45%).
При СД миокард поражается независимо от наличия атеросклероза коронарных артерий (диабетическая кардиомиопатия). Изменения в сосудах сердца проявляются в виде микроангиопатий, нарушается микроциркуляция, отмечаются морфофункциональные изменения миокарда. Нарушается биоэлектрическая активность миокарда, снижается его сократительная способность с тенденцией к развитию декомпенсации кровообращения. При длительном течении СД, особенно 2 типа, атеросклеротические изменения касаются не только магистральных артерий, но и артерий среднего и малого калибра. Также у больных СД 2 выражена гипертрофия миокарда, способствующая нарушению коронарного кровообращения. Прогрессирование гипертрофии и дилатации левого желудочка (ЛЖ) снижает сократительную функцию, происходит напряжение стенок во время систолы, что способствует увеличению потребности миокарда в кислороде и развитию кардиосклероза. При СД нередко развивается гиперкинетический вариант центральной гемодинамики с увеличением объема циркулирующей крови, тахикардией [23].
Диабетическая кардиомиопатия проявляется гипертрофией кардиомиоцитов, миокардиальным фиброзом. Повышенное содержание коллагена в миокарде, гипертрофия ЛЖ приводят к потере эластичности с появлением жесткости, ригидности сердечной мышцы.
Таким образом, снижение сократительной способности миокарда при СД и ИБС обусловлено кардиальными и некардиальными факторами. Диабетическая миокардиодистрофия в своей основе связана с нарушением метаболизма кардиомиоцитов, имеют значение также диабетическая вегетоневропатия и микроангиопатия [24]. Кардиальные нарушения у больных СД 2 характеризуются также нарушением диастолической функции ЛЖ. В формировании поражения сердца при СД принимает участие ряд патогенетических механизмов: макроангиопатия с атеросклерозом коронарных артерий, нарушение метаболизма миокарда, расстройства микроциркуляции в форме диабетической микроангиопатии.
Поражение сердца при СД требует профилактического и лечебного воздействия.
Лечение дислипидемии у больных сахарным диабетом
Коррекция дислипидемии при СД осуществляется по тем же принципам, что и у больных ИБС. Статины являются препаратами первого выбора. При этом не стоит забывать о том, что улучшение прогноза у пациентов с СД, ИБС и СН предполагает обязательный жесткий метаболический контроль за целевыми уровнями глюкозы и АД. Контроль за гликемией является важной основой лечения больных СД. Клинические исследования DCCT [25], UKPDS [26] показали, что улучшение гликемического контроля сопровождается устойчивым снижением риска ретинопатии, нефропатии, а также достоверным снижением риска микрососудистых осложнений на 25% и недостоверной тенденцией к уменьшению риска ИМ на 16%.
Целью гиполипидемической терапии при СД является достижение уровня общего ХС < 4,5 ммоль/л, ХС ЛПНП < 2,6 ммоль/л. Оптимальный уровень ХС ЛПВП – 1,02 ммоль/л у мужчин и > 1,28 ммоль/л у женщин [27], концентрация ТГ < 1,7 ммоль/л. В плане снижения уровня ХС ЛПНП ведущая роль принадлежит статинам; фибраты (фенофибрат, гемфибразил, ципрофибрат и др.) особенно эффективны в уменьшении уровня ТГ и в увеличении уровня ХС ЛПВП. Пациентам со смешанной гиперлипидемией показано назначение комбинированной терапии (статины + фибраты).
По результатам нескольких метаанализов последних лет установлен диабетогенный эффект терапии статинами [28–30], который имеет дозозависимый характер и прямую связь с наличием факторов риска ССЗ. Вопрос о назначении статинов пациентам с СД имеет множество нюансов, требуя индивидуального подхода. Не оставляют сомнений положительные эффекты назначения статинов. У пациентов с СД предпочтение следует отдавать назначению статинов с наиболее выраженным гиполипидемическим эффектом – розувастатину и аторвастатину. Самый крупный метаанализ по оценке влияния снижения уровня ЛПНП на риск развития сердечно-сосудистых событий был выполнен в 2010 г. и включил в себя 26 клинических исследований с участием 170 тыс. пациентов [31]. Среднее время наблюдения составило 5,1 года. Анализ показал, что снижение уровня ЛПНП на 1 ммоль/л приводит к 10-процентному снижению риска общей смерти, 20-процентному снижению риска сердечно-сосудистой смертности, 11-процентному снижению риска сердечно-сосудистых событий. В 2015 г. приняты рекомендации Американской ассоциации по лечению СД (ADA), основные положения которых во многом повторяют положения, изложенные в IAS и ACC/AHA. При назначении терапии статинами учитывают наличие уровня риска ССЗ [32].
Лечение артериальной гипертонии у больных сахарным диабетом
Наиболее часто АГ и ССЗ развиваются на фоне уже существующего СД 2. Такое сочетание несет в себе риск быстрого развития и прогрессирования ССО, характерных как для АГ, так и для СД, поскольку органы-мишени для АГ и СД одни и те же: миокард, венечные артерии, сосуды мозга, почек и сетчатки. При подобном сочетании частота развития ИБС возрастает в 3,5–4 раза, острого нарушения мозгового кровообращения (ОНМК) – в 3 раза, хронической почечной недостаточности (ХПН) – в 30 раз, полной потери зрения вследствие ретинопатии – в 4–5 раз по сравнению с изолированным эффектом AГ.
Развитие АГ при СД 2 связано с активацией механизмов, регулирующих уровень АД, что прежде всего касается гиперактивации симпатической нервной системы (СНС). Под влиянием активации СНС нарушается обмен норадреналина, что приводит к выраженной тканевой гиперсимпатикотонии, симпатической стимуляции сердца, сосудов, почек, способствуя повышению АД.
Контроль уровня АД, по данным Международной федерации диабета (1999), способствует снижению риска ССО у больных СД 2 на 51%.
Целевой уровень АД у больных СД ниже, чем у пациентов без СД – 130/80 мм рт. ст., а при наличии выраженной нефропатии – 125/75 мм рт. ст. При достижении такого уровня удается затормозить прогрессирование сосудистых осложнений при СД. Препаратами первого выбора являются ингибиторы ангиотензинпревращающего фермента (иАПФ) и антагонисты рецепторов ангиотензина II (АРАII). Могут также использоваться медленнодействующие, пролонгированные антагонисты кальция (АК) (амлодипин, нормодипин, лацидипин и др.) и кардиоселективные β-адреноблокаторы (метопролол, карведилол, небиволол, бисопролол и др.).
У пациентов с СД с повышенной активностью СНС и АГ целесообразно применять препараты, снижающие ее активацию, в частности β-адреноблокаторы, которые широко используются при СД 2, особенно при его сочетании с АГ. Следовательно, β-адреноблокаторы, так же как и иАПФ, АРАII, предотвращают развитие кардиальных осложнений при СД 2. Ряд β-адреноблокаторов, имеющих свойства селективных β-адреноблокаторов, обладающих сосудорасширяющей и протективной активностью, показаны для применения у больных СД 2 и АГ. К таким препаратам относятся: бисопролол, небиволол, карведилол и др. Целесообразно также применение у больных СД 2 и АГ комбинации АРАII и антагониста кальция амлодипина.
Важность учета при длительной антигипертензивной терапии метаболических эффектов, и в частности развития СД, подчеркивается в последних европейских рекомендациях по АГ.
Лечение ХСН у больных сахарным диабетом
Патогенез и лечение ХСН у пациентов с СД имеют определенные особенности, которые следует учитывать при проведении рациональной терапии. Лечение СН у больных с СД в основном соответствует общепринятым принципам терапии ХСН. Однако непременной особенностью лечения подобных пациентов является тщательный динамический контроль за основными метаболическими показателями.
Основными средствами лечения СН при СД являются иАПФ и АРАII, эффективность которых превосходит, по данным российского исследования ФАСОН [33, 35], терапию декомпенсации кровообращения у пациентов бeз СД.
В метаанализе (исследование САРРР), посвященном сравнению эффективности иАПФ, β-адреноблокаторов, АК и диуретиков при лечении больных АГ и СД, было показано, что назначение иАПФ и АРАII достоверно снижает риск острого ИМ на 48%, ССО – на 32%.
Приоритетными являются современные кардиоселективные и неселективные β-адреноблокаторы со свойствами непрямых вазадилататоров (метопролол, небиволол, бисопролол, карведилол и др.). Гемодинамические эффекты карведилола заключаются в снижении общего периферического сопротивления сосудов (ОПСС) и преднагрузки, увеличении сердечного выброса без рефлекторной тахикардии. Кроме того, препарат обладает антиоксидантной и антиаритмической активностью, вазопротекторным эффектом. Перечисленные свойства делают карведилол весьма ценным при лечении больных с сочетанием СД и ХСН.
АК снижают частоту и продолжительность БИМ. Предпочтительнее использование вазоселективных и долгодействующих АК (амлодипин, фелодипин и др.), не вызывающих рефлекторную тахикардию, увеличение уровня катехоламинов и проишемический эффект. Кроме того, АК обладают антиатерогенным действием.
Среди диуретиков используются калийсберегающие средства (альдактон, верошпирон), индапамид; осторожно следует назначать петлевые и тиазидные диуретики – под контролем показателей углеводного обмена и уровня калия в крови.
Целесообразно применение метаболических средств – триметазидина и др.
Для сахарного диабета характерно генерализованное поражение сосудистой стенки (диабетическая ангиопатия). В свою очередь диабетическая ангиопатия подразделяется на диабетическую микро- и макроангиопатию (атеросклероз в сочетании с диабетическими микроангиопатиями).
Для сахарного диабета независимо от его типа наиболее характерна микроангиопатия. Последняя представляет собой генерализованное дегенеративное поражение мелких сосудов, в первую очередь капилляров, а также артериол и венул. Микроангиопатии могут наблюдаться не только при явном диабете, но и при нарушенной толерантности к глюкозе (скрытый диабет), даже при достоверных классах риска (потенциальный диабет). Капилляры и артериолы наиболее интенсивно поражаются в особо предрасположенных местах; почечные клубочки (нефропатия), сетчатка глаза (ретинопатия), дистальные отделы нижних конечностей (периферическая ангиопатия).
Дегенеративные поражения мелких сосудов встречаются также в исчерченной мышечной ткани, коже, плаценте, нервных стволах (нейропатия). При сахарном диабете основные изменения происходят в базальной мембране капилляров. В патологический процесс вовлекаются все капилляры, имеющие базальную мембрану, что обозначается как “универсальная капилляропатия”. Это подтверждают электронно-микроскопические исследования различных участков тела, при которых обнаруживают сосудистые изменения, аналогичные диабетическим поражениям клубочков почек и сетчатки. Общим для микроангиопатий являются аневризматические изменения капилляров, утолщение стенки артериол, капилляров и венул за счет накопления в базальной мембране сосудов ПАС-положительных веществ (гликопротеиды, нейтральные мукополисахариды), пролиферация эндотелия и перителия, десквамация эндотелия в просвет сосудов, тучноклеточная реакция в периваскуллрной ткани. При диабетической макроангиопатии, которую рассматривают как ранний и распространенный атеросклероз, патологические изменения происходят в сосудах среднего и крупного калибра, что находит отражение не только в нарушении регуляторного механизма сосудистой стенки, но и в возникновении в ней дистрофических нарушений.
Для сахарного диабета характерна комбинированная ангиопатия, т.е. сочетание микро- и макроангиопатии, протекающая с преобладанием того или иного сосудистого синдрома. В молодом возрасте преобладает микроангиопатия, а после 30- 40 лет – макроангиопатия. Последняя проявляется в быстро прогрессирующем атеросклерозе. Атеросклеротические изменения у больных сахарным диабетом чаще всего возникают в коронарных артериях. Клинически эти поражения редко обнаруживаются до 50 лет. Патогенез диабетической ангиопатии не вполне ясен. Чаще микроангиопатии встречаются у лиц с длительным и тяжелым, недостаточно компенсированным сахарным диабетом. Они могут возникать и при компенсированном течении сахарного диабета, но отсутствовать при тяжелом сахарном диабете с длительным течением. Большое значение в происхождении диабетической микроангиопатии и нейропатии придают нарушениям углеводного, липидного и белкового обмена. Основную роль в их патогенезе отводят гипергликемии. Под ее влиянием происходит увеличение количества гликированных белков в мембране клеток всех органов и систем и в первую очередь сосудов. Считают, что главными процессами, лежащими в основе патогенеза диабетической ангиопатии и нейропатии, являются гликирование белков организма, нарушение клеточной функции в инсулинзависимых тканях, а также изменение реологических свойств крови и гемодинамики.
Вследствие значительного увеличения в эритроцитах гликированного (глюкозосодержащего) гемоглобина НBА1с наряду с уменьшением в них 2,3-дифосфоглицерофосфата развивается тканевая гипоксия, способствующая изменению структуры базальной мембраны и нарушению ее функции. НBА1с представляет собой одну из фракций гемоглобина и обладает повышенным сродством к кислороду. В результате этого в капиллярах затрудняются отщепление кислорода от гемоглобина и переход кислорода в ткани с развитием гипоксии тканей и в первую очередь базальных мембран сосудов. Установлено, что между уровнями НBА1с и гипергликемии существует прямая корреляционная зависимость. Она отмечена также между степенью гипоксии и тяжестью сосудистых поражений. Полагают, что тканевая гипоксия является следствием ангиопатии. Об этом свидетельствует, во-первых, то, что выраженность ангиопатии влияет на глубину тканевой гипоксии, а во-вторых, лечение, направленное на улучшение микроциркуляции, сопровождается и уменьшением гипоксии. В патогенезе микроангиопатии и особенно нейропатии придают значение активизации (на фоне гипергликемии) ферментного полиолового пути метаболизма глюкозы. Глюкоза, поступая в клетки инсулиннезависимых тканей, не подвергается фосфорилированию, а превращается под влиянием фермента альдозоредуктазы в циклический спирт – сорбит, который под влиянием фермента сорбитдегидрогеназы переходит во фруктозу. Последняя утилизируется клетками без участия инсулина. Накопление в клетках избыточного количества фруктозы и сорбита способствует повышению в них осмотического давления. В силу своей гидрофобности сорбитол и фруктоза приводят к развитию гидропического отека клеток и нарушению транспорта через мембрану клеток АТФ, аминокислот и т.д., способствуя в конечном итоге расстройствам микроциркуляции. Фактором, способствующим активации полиолового пути метаболизма глюкозы и повышению активности фермента альдозоредуктазы, является избыточная секреция гормона роста.
В процессе развития микроангиопатии имеет значение нарушение гемостаза с изменением реологических свойств крови. Это происходит в результате повышения содержания гликированных белков в мембране эритроцитов, тромбоцитов и эндотелии капилляров. Повышается агрегация тромбоцитов при увеличении ими продукции тромбоксана. Наряду с этим в клетках эндотелия уменьшается синтез простациклина. Понижается фибринолитическая активность крови, происходит увеличение в ней фактора Виллебранда. Все эти нарушения способствуют тромбообразованию. Развитию диабетической микроангиопатии способствуют также снижение скорости кровотока, повышение вязкости крови. Нередко наблюдаемую при сахарном диабете гиперкоагуляцию рассматривают как важный диагностический признак не только в развитии сосудистых поражений, но и как показатель возможности возникновения тромбозов и геморрагии. Установлено, что повышение свертывающей активности крови прогрессирует с возрастом, зависит от длительности заболевания и степени выраженности диабетической микроангиопатии. Одним из факторов, обусловливающих развитие диабетической микроангиопатии, является нарушение липидного обмена. Повышается концентрация липопротеидов низкой и очень низкой плотности по сравнению с липопротеидами высокой плотности, увеличивается содержание продуктов гликирования липопротеидов низкой и высокой плотности. Нарушению структуры и функции клеточных мембран способствует также усиление процессов перекисного окисления липидов (ПОЛ). Усиление ПОЛ при сахарном диабете является одним из существенных факторов в повреждении эритроцитов и эндотелия сосудов и в формировании диабетических ангиопатий (А.С.Ефимов, В. Г. Науменко). ПОЛ – физиологический процесс. Свободнорадикальное окисление непрерывно протекает в норме во всех тканях, и свободнорадикальные процессы при их низкой интенсивности являются одним из типов нормальных метаболических процессов (А. И.Журавлев). В процессе перекисного окисления липидов образуются гидроперекиси, свободные радикалы, перекисные радикалы, малоновый диальдегид, низкомолекулярные легколетучие углеводороды (этан, пентан), липофусциноподобные пигменты и др. В физиологических условиях перекиси являются необходимыми участниками биосинтеза простагландинов, стероидных гормонов, тромбоксанов, реакций окислительного фосфорили-рования, процессов распространения возбуждения и торможения по нервным волокнам и в тканях центральной нервной системы. Показано, что перекисные радикалы, образуясь в результате соединения свободных радикалов с молекулой кислорода, взаимодействуют с молекулами жирных кислот. В результате этого взаимодействия образуются высокотоксичные гидроперекиси и новый свободный радикал. Ингибиторами свободнорадикального окисления являются антиоксиданты (витамин Е, инсулин и др.). Установлено, что только они обладают способностью реагировать с перекисными радикалами липидов и прерывать цепную реакцию окисления.
При сахарном диабете снижается антиокислительная активность, нарушается регуляция ПОЛ, в связи с чем продукты перекисного окисления образуются в избытке и оказывают цито-токсическое действие. Так, образующиеся в избытке свободные радикалы оказывают цитотоксическое действие на эндотелиапьные клетки сосудов, что ведет к повреждению сосудистой стенки. Малоновый диальдегид тормозит синтез простациклина, являющегося физиологическим ингибитором агрегации тромбоцитов. Наряду со снижением синтеза простациклина происходит и повышение синтеза тромбоксанов. В результате этого повышаются агрегация тромбоцитов и тромбообразование. Под влиянием тромбоксанов происходит прилипание тромбоцитов к клеткам эндотелия, вследствие чего нарушается микроциркуляция.
Определенную роль в происхождении микроангиопатии играет иммуногенный фактор. В зависимости от индивидуального иммунитета и аллергической реакции продукты обмена (парапротеины, парагл и копротеиды), а в ряде случаев и белковая молекула инсулина приобретают свойства антигенов. К этим антигенам в организме образуются антитела с последующей реакцией антиген – антитело (реакция преципитации) в капиллярах, что приводит к их повреждению в результате выпадения комплекса антиген – антитело по ходу капилляров. Происходят повышение уровня и изменение состава иммуноглобулинов и в первую очередь IgA и IgG. Иммунологические сдвиги могут происходить независимо от тяжести заболевания и применения инсулина. Это в известной степени объясняет развитие ангиопатий не только при легкой форме сахарного диабета, но и при нарушенной толерантности к глюкозе и достоверных классах риска.
Определенную роль в происхождении диабетической микроангиопатии играют частые и резкие перепады содержания сахара в крови. Последние приводят к мобилизации адреналина, который в свою очередь вызывает спазм сосудов и гипоксию сосудистых стенок. Это нарушает проницаемость сосудистых стенок и в последующем ведет к их утолщению. Развитию диабетической микроангиопатии способствует также диета, богатая жирами и бедная белками. У больных с ожирением микроангиопатии обнаруживаются почти в 2 раза чаще, чем у больных с нормальной массой тела. Возникновение микроангиопатии связано и со сложным гормональным воздействием, в котором играет роль гиперфункция системы гипоталамус – гипофиз – кора надпочечников (избыточная продукция СТГ, АКЛТ, глюкокортикоидов и минералокортикоидов). Вначале гиперпродукция этих гормонов является компенсаторной реакцией в ответ на метаболический стресс, но впоследствии при длительном и стойком их повышении повреждаются сосуды. У женщин, страдающих сахарным диабетом, во время беременности чаще возникают ретинопатия и нефропатия. Это может быть до известной степени обусловлено гиперфункцией в период беременности системы гипоталамус – гипофиз – кора надпочечников.
Сердечно-сосудистая система при сахарном диабете и др. материалы.
См. также статьи:
- Сахарный диабет
- Симптомы сахарного диабета
