Сердечно сосудистые осложнения сахарного диабета
Введение
Сахарный диабет (СД) признан экспертами ВОЗ неинфекционной эпидемией и представляет собой серьезную медико-социальную проблему. В 2010 г. СД страдало около 6,4% (285 млн) жителей планеты. К 2030 г. ожидается увеличение количества больных до 7,7% (439 млн человек) [1]. Ишемическая болезнь сердца (ИБС) является основной причиной смерти больных СД [2], причем 90% этих больных страдает СД 2 типа (СД 2) [3].
Наличие СД сопряжено с возникновением всех форм ИБС — стенокардии, безболевой ишемии миокарда (БИМ), инфаркта миокарда (ИМ), внезапной сердечной смерти [4]. При этом макрососудистые осложнения, включая ИБС, инсульт, заболевания периферических сосудов, являются причиной смертности больных СД в 67% случаев [5]. Основываясь на имеющихся данных, можно рассматривать СД как своеобразное ССЗ [6]. В 50% случаев повышение риска развития сердечно-сосудистых поражений при СД 2 объясняется большей частотой и выраженностью традиционных факторов риска у больных СД [7]. Факторами риска у больных СД считаются: дислипидемия, артериальная гипертензия (АГ), курение, наследственная предрасположенность по ИБС, наличие микро- и макроальбуминурии.
Сахарный диабет и нарушения липидного обмена
Изучение особенностей распространенности, методов диагностики и лечения дислипидемии представляет особый интерес у больных СД. Сведения о распространенности дислипидемии у пациентов с СД 2 представлены в таблице 1 [8].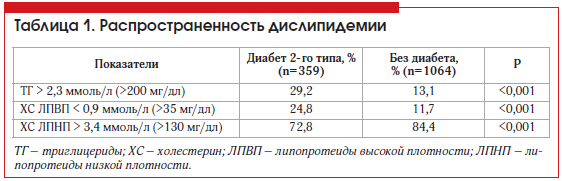
Следует особо отметить гипертриглицеридемию (ГТ) и уменьшение уровня холестерина (ХС) липопротеидов высокой плотности (ЛПВП) [10, 11]. У больных СД 2 выделяют гиперпродукцию «малых, плотных» липопротеидов низкой плотности (ЛПНП) [12]. При этом 69% больных СД имеют нарушения липидного обмена [13]. Атерогенное действие дислипидемии усиливается при присоединении диабетических нарушений углеводного обмена. Для больных, страдающих СД, наиболее характерна следующая липидная триада при СД: гипертриглицеридемия, увеличение процентного содержания «малых, плотных» ЛПНП, снижение концентрации ЛПВП. Данные изменения липидного спектра способствуют развитию атеросклероза независимо от повышения уровня общего ХС и общей фракции ХС ЛПНП.
Учитывая важную роль триглицеридов (ТГ) в развитии дислипидемии при СД 2, приводим классификацию уровней ТГ в сыворотке крови (табл. 2) [14]. 
Большое значение в развитии раннего коронарного атеросклероза имеет специфическое нарушение липидного обмена у больных СД 2 – диабетическая дислипидемия.
Сахарный диабет, ишемическая болезнь сердца и артериальная гипертония
Эпидемиологические данные свидетельствуют о существовании достоверной связи между уровнем гликозилированного гемоглобина и риском сердечно-сосудистой заболеваемости и смертности. При увеличении уровня гликозилированного гемоглобина на 1% риск развития ССЗ возрастает на 10% [15].
Инсулинорезистентность также играет важнейшую роль в патогенезе СД 2. Гиперинсулинемия тесно связана с метаболическим синдромом, который включает в себя инсулинорезистентность, АГ и ожирение и сопровождается высоким риском ССО.
Изменение концентрации липидов плазмы крови при СД 2 является предиктором ИБС. Установлено, что у лиц с высоким уровнем глюкозы в крови натощак и после нагрузки отмечается достоверно более высокая смертность от ССЗ [16]. Бессимптомная гипергликемия, особенно у женщин, является существенным фактором риска развития ИБС [17].
Влияние гиперинсулинемии и инсулинорезистентности на развитие атеросклероза связано с воздействием на процессы свертывания крови [18]. Отмечаются гиперкоагуляция и депрессия фибринолиза, что может способствовать внутрикоронарному тромбозу. У пациентов с СД 2 выявляется повреждение эндотелия и его дисфункция, что является дополнительным фактором повышенного риска развития ИБС.
Основная причина смертности больных СД – ССО, составляющие до 80%. Смертность от ИМ среди больных СД составляет 39% [19], от инсульта – превышает таковую у лиц без диабета [5]. При сочетании АГ и СД в 2–4 раза возрастает риск развития ИБС, что прямо коррелирует с длительностью СД [20]. АГ обнаруживается у 20–60% больных СД 2, она встречается в 1,5 раза чаще, чем у лиц без СД. Наличие АГ при СД увеличивает риск макрососудистых (ИБС, СН, инсульт) и микрососудистых (диабетическая ретинопатия, нефропатия) осложнений [21]. Важным является тот факт, что у больных АГ и СД преимущества антигипертензивной терапии более выражены, чем у больных без СД. В связи с этим строгий контроль АД у данной группы больных крайне необходим.
При СД возможно возникновение всех форм ИБС, как болевых, так и, особенно, безболевых. Наличие микроангиопатий и невропатий при СД способствует формированию безболевых вариантов ИБС (безболевые ИМ, атипичные приступы стенокардии), протекающих в форме нарушений сердечного ритма и сердечной недостаточности. У больных СД в 2 раза чаще встречается безболевой ИМ, что связывают с автономной кардиальной невропатией. При СД частой формой ИБС является БИМ. Она заключается в преходящих нарушениях метаболизма, функции, перфузии, электрической активности миокарда, которые не проявляются приступами стенокардии или их эквивалентами.
Клинические особенности ИБС у больных СД следующие:
– одинаковая частота у мужчин и женщин;
– высокая частота безболевых форм ИБС (БИМ, безболевой ИМ);
– частое развитие постинфарктных осложнений;
– смертность в остром (10 дней) и подостром (4–8 нед.) периодах ИМ в 2 раза превышает таковую у лиц без СД.
При наличии СД следует стремиться к возможной ликвидации всех эпизодов ишемии миокарда, а не только к купированию типичных приступов стенокардии (избавление от «общего ишемического бремени» — total ischemic burden). Этого можно достичь путем снижения частоты и продолжительности эпизодов депрессий сегмента ST при холтеровском мониторировании ЭКГ, которое должно шире использоваться у пациентов с СД для оценки эффективности антиишемического лечения.
Сахарный диабет и поражение почек
Наиболее ранний маркер поражения почек при СД – микроальбуминурия, она является предвестником диабетической нефропатии и существенным фактором риска формирования сердечно-сосудистой патологии. Стойкая альбуминурия на уровне 30–299 мг / 24 ч (или микроальбуминурия) служит маркером нефропатии и одновременно маркером риска развития ССО [22].
Сахарный диабет и сердечная недостаточность
Фремингемское исследование достаточно убедительно подтвердило повышение риска развития сердечной недостаточности (СН) у больных СД – у мужчин в 4 раза, у женщин – в 8 раз чаще, чем у лиц без СД. По данным российского исследования ЭПОХА, наличие СН является существенным предиктором развития СД в дальнейшем. В общей популяции распространенность СД составляет 2,9%, а среди больных с СН III–IV ФК – 15,8%. При ХСН наличие инсулин-независимого СД заметно ухудшает прогноз пациентов, особенно женщин (на 45%).
При СД миокард поражается независимо от наличия атеросклероза коронарных артерий (диабетическая кардиомиопатия). Изменения в сосудах сердца проявляются в виде микроангиопатий, нарушается микроциркуляция, отмечаются морфофункциональные изменения миокарда. Нарушается биоэлектрическая активность миокарда, снижается его сократительная способность с тенденцией к развитию декомпенсации кровообращения. При длительном течении СД, особенно 2 типа, атеросклеротические изменения касаются не только магистральных артерий, но и артерий среднего и малого калибра. Также у больных СД 2 выражена гипертрофия миокарда, способствующая нарушению коронарного кровообращения. Прогрессирование гипертрофии и дилатации левого желудочка (ЛЖ) снижает сократительную функцию, происходит напряжение стенок во время систолы, что способствует увеличению потребности миокарда в кислороде и развитию кардиосклероза. При СД нередко развивается гиперкинетический вариант центральной гемодинамики с увеличением объема циркулирующей крови, тахикардией [23].
Диабетическая кардиомиопатия проявляется гипертрофией кардиомиоцитов, миокардиальным фиброзом. Повышенное содержание коллагена в миокарде, гипертрофия ЛЖ приводят к потере эластичности с появлением жесткости, ригидности сердечной мышцы.
Таким образом, снижение сократительной способности миокарда при СД и ИБС обусловлено кардиальными и некардиальными факторами. Диабетическая миокардиодистрофия в своей основе связана с нарушением метаболизма кардиомиоцитов, имеют значение также диабетическая вегетоневропатия и микроангиопатия [24]. Кардиальные нарушения у больных СД 2 характеризуются также нарушением диастолической функции ЛЖ. В формировании поражения сердца при СД принимает участие ряд патогенетических механизмов: макроангиопатия с атеросклерозом коронарных артерий, нарушение метаболизма миокарда, расстройства микроциркуляции в форме диабетической микроангиопатии.
Поражение сердца при СД требует профилактического и лечебного воздействия.
Лечение дислипидемии у больных сахарным диабетом
Коррекция дислипидемии при СД осуществляется по тем же принципам, что и у больных ИБС. Статины являются препаратами первого выбора. При этом не стоит забывать о том, что улучшение прогноза у пациентов с СД, ИБС и СН предполагает обязательный жесткий метаболический контроль за целевыми уровнями глюкозы и АД. Контроль за гликемией является важной основой лечения больных СД. Клинические исследования DCCT [25], UKPDS [26] показали, что улучшение гликемического контроля сопровождается устойчивым снижением риска ретинопатии, нефропатии, а также достоверным снижением риска микрососудистых осложнений на 25% и недостоверной тенденцией к уменьшению риска ИМ на 16%.
Целью гиполипидемической терапии при СД является достижение уровня общего ХС < 4,5 ммоль/л, ХС ЛПНП < 2,6 ммоль/л. Оптимальный уровень ХС ЛПВП – 1,02 ммоль/л у мужчин и > 1,28 ммоль/л у женщин [27], концентрация ТГ < 1,7 ммоль/л. В плане снижения уровня ХС ЛПНП ведущая роль принадлежит статинам; фибраты (фенофибрат, гемфибразил, ципрофибрат и др.) особенно эффективны в уменьшении уровня ТГ и в увеличении уровня ХС ЛПВП. Пациентам со смешанной гиперлипидемией показано назначение комбинированной терапии (статины + фибраты).
По результатам нескольких метаанализов последних лет установлен диабетогенный эффект терапии статинами [28–30], который имеет дозозависимый характер и прямую связь с наличием факторов риска ССЗ. Вопрос о назначении статинов пациентам с СД имеет множество нюансов, требуя индивидуального подхода. Не оставляют сомнений положительные эффекты назначения статинов. У пациентов с СД предпочтение следует отдавать назначению статинов с наиболее выраженным гиполипидемическим эффектом – розувастатину и аторвастатину. Самый крупный метаанализ по оценке влияния снижения уровня ЛПНП на риск развития сердечно-сосудистых событий был выполнен в 2010 г. и включил в себя 26 клинических исследований с участием 170 тыс. пациентов [31]. Среднее время наблюдения составило 5,1 года. Анализ показал, что снижение уровня ЛПНП на 1 ммоль/л приводит к 10-процентному снижению риска общей смерти, 20-процентному снижению риска сердечно-сосудистой смертности, 11-процентному снижению риска сердечно-сосудистых событий. В 2015 г. приняты рекомендации Американской ассоциации по лечению СД (ADA), основные положения которых во многом повторяют положения, изложенные в IAS и ACC/AHA. При назначении терапии статинами учитывают наличие уровня риска ССЗ [32].
Лечение артериальной гипертонии у больных сахарным диабетом
Наиболее часто АГ и ССЗ развиваются на фоне уже существующего СД 2. Такое сочетание несет в себе риск быстрого развития и прогрессирования ССО, характерных как для АГ, так и для СД, поскольку органы-мишени для АГ и СД одни и те же: миокард, венечные артерии, сосуды мозга, почек и сетчатки. При подобном сочетании частота развития ИБС возрастает в 3,5–4 раза, острого нарушения мозгового кровообращения (ОНМК) – в 3 раза, хронической почечной недостаточности (ХПН) – в 30 раз, полной потери зрения вследствие ретинопатии – в 4–5 раз по сравнению с изолированным эффектом AГ.
Развитие АГ при СД 2 связано с активацией механизмов, регулирующих уровень АД, что прежде всего касается гиперактивации симпатической нервной системы (СНС). Под влиянием активации СНС нарушается обмен норадреналина, что приводит к выраженной тканевой гиперсимпатикотонии, симпатической стимуляции сердца, сосудов, почек, способствуя повышению АД.
Контроль уровня АД, по данным Международной федерации диабета (1999), способствует снижению риска ССО у больных СД 2 на 51%.
Целевой уровень АД у больных СД ниже, чем у пациентов без СД – 130/80 мм рт. ст., а при наличии выраженной нефропатии – 125/75 мм рт. ст. При достижении такого уровня удается затормозить прогрессирование сосудистых осложнений при СД. Препаратами первого выбора являются ингибиторы ангиотензинпревращающего фермента (иАПФ) и антагонисты рецепторов ангиотензина II (АРАII). Могут также использоваться медленнодействующие, пролонгированные антагонисты кальция (АК) (амлодипин, нормодипин, лацидипин и др.) и кардиоселективные β-адреноблокаторы (метопролол, карведилол, небиволол, бисопролол и др.).
У пациентов с СД с повышенной активностью СНС и АГ целесообразно применять препараты, снижающие ее активацию, в частности β-адреноблокаторы, которые широко используются при СД 2, особенно при его сочетании с АГ. Следовательно, β-адреноблокаторы, так же как и иАПФ, АРАII, предотвращают развитие кардиальных осложнений при СД 2. Ряд β-адреноблокаторов, имеющих свойства селективных β-адреноблокаторов, обладающих сосудорасширяющей и протективной активностью, показаны для применения у больных СД 2 и АГ. К таким препаратам относятся: бисопролол, небиволол, карведилол и др. Целесообразно также применение у больных СД 2 и АГ комбинации АРАII и антагониста кальция амлодипина.
Важность учета при длительной антигипертензивной терапии метаболических эффектов, и в частности развития СД, подчеркивается в последних европейских рекомендациях по АГ.
Лечение ХСН у больных сахарным диабетом
Патогенез и лечение ХСН у пациентов с СД имеют определенные особенности, которые следует учитывать при проведении рациональной терапии. Лечение СН у больных с СД в основном соответствует общепринятым принципам терапии ХСН. Однако непременной особенностью лечения подобных пациентов является тщательный динамический контроль за основными метаболическими показателями.
Основными средствами лечения СН при СД являются иАПФ и АРАII, эффективность которых превосходит, по данным российского исследования ФАСОН [33, 35], терапию декомпенсации кровообращения у пациентов бeз СД.
В метаанализе (исследование САРРР), посвященном сравнению эффективности иАПФ, β-адреноблокаторов, АК и диуретиков при лечении больных АГ и СД, было показано, что назначение иАПФ и АРАII достоверно снижает риск острого ИМ на 48%, ССО – на 32%.
Приоритетными являются современные кардиоселективные и неселективные β-адреноблокаторы со свойствами непрямых вазадилататоров (метопролол, небиволол, бисопролол, карведилол и др.). Гемодинамические эффекты карведилола заключаются в снижении общего периферического сопротивления сосудов (ОПСС) и преднагрузки, увеличении сердечного выброса без рефлекторной тахикардии. Кроме того, препарат обладает антиоксидантной и антиаритмической активностью, вазопротекторным эффектом. Перечисленные свойства делают карведилол весьма ценным при лечении больных с сочетанием СД и ХСН.
АК снижают частоту и продолжительность БИМ. Предпочтительнее использование вазоселективных и долгодействующих АК (амлодипин, фелодипин и др.), не вызывающих рефлекторную тахикардию, увеличение уровня катехоламинов и проишемический эффект. Кроме того, АК обладают антиатерогенным действием.
Среди диуретиков используются калийсберегающие средства (альдактон, верошпирон), индапамид; осторожно следует назначать петлевые и тиазидные диуретики – под контролем показателей углеводного обмена и уровня калия в крови.
Целесообразно применение метаболических средств – триметазидина и др.
Сахарный диабет типа 2-го типа (СД2-го типа)— тяжелое прогрессирующее хроническое заболевание, представляющее собой независимый фактор риска развития сердечной недостаточности (СН) исердечно-сосудистых осложнений. ВXXIв. неуклонный рост СД2-го типа ичастоты его серьезных последствий вызывает большую тревогу мировой медицинской общественности. Поданным Всемирной федерации диабета (IDF) на2010г., вРоссийской Федерации насчитывается около 9624900 человек, страдающих СД, изкоторых 80–90%— пациенты сСД2-го типа. Попредварительным данным, число больных к2025г. достигнет 333млн человек. Кмоменту диагностики СД2-го типа уполовины пациентов уже присутствуют осложнения, приводящие кснижению качества жизни, ранней инвалидизации ипреждевременной смерти. Как известно, основная причина летальных исходов у52% пациентов сСД— сердечно-сосудистые заболевания [1]. Помимо всего прочего, СД2-го типа— это ведущая причина потери зрения, развития терминальных стадий почечной недостаточности, нетравматических ампутаций.
На сегодняшний день СД 2-го типа рассматривают как эквивалент присутствия у пациента клинически выраженного сердечно-сосудистого заболевания (ССЗ), что говорит о необходимости уделять этой проблеме особое внимание. При диабете ССЗ встречаются в 2–5 раз чаще, чем у лиц без данной патологии. При этом высок риск развития таких состояний, как ишемическая болезнь сердца (ИБС), инфаркт миокарда (ИМ), артериальная гипертензия (АГ), острое нарушение мозгового кровообращения (ОНМК). Так, 69% больных СД имеют дислипидемию, 80% — АГ, 50–75% — диастолическую дисфункцию, 12–22% — хроническую сердечную недостаточность (ХСН). Смертность от ИМ среди больных с СД в 1,5–2 раза выше, чем среди людей, не страдающих этим заболеванием, как в острой стадии ИМ, так и при продолжительном наблюдении [2]. Внезапная сердечная смертность среди всей кардиоваскулярной летальности составляет 50%. Центральное место в этом занимает аритмогенный характер СД [3]. Распространенность синусовой тахикардии при СД 2-го типа составляет 43,1% (без сопутствующего СД — 27,3%), пароксизмальных форм фибрилляции предcердий, увеличивающих риск смерти в 1,8–2 раза, у пациентов с СД — 2–8,6% (против единичных) [5, 6], суправентрикулярной экстрасистолии — 15,5% (против 9,1%) [3, 4]. Что касается структуры нарушения ритма у пациентов с обсуждаемым заболеванием, то она выглядит следующим образом: 90–97% — суправентрикулярная экстрасистолия, 60–68% — желудочковая экстрасистолия, 12–30% — пароксизмальная тахикардия [7].
Для выявления лиц с высоким риском СД необходимо разделить их на три категории:
- общая популяция;
- лица с предполагаемыми нарушениями (ожирение, артериальная гипертензия (АГ) или СД в семейном анамнезе);
- пациенты с распространенными ССЗ.
С высоким уровнем доказательности и огромным количеством исследований в рекомендациях Европейского общества кардиологов и Европейской ассоциации СД (European Society of Cardiology — EASC and the European Association for the study of diabetes — EASD) [8] представлены следующие факты:
Присутствует взаимосвязь между гипергликемией и ССЗ. В исследовании DECODE было выявлено, что повышение уровня гликемии более 8 ммоль/л увеличивает риск развития сердечно-сосудистой патологии в 2 раза. При этом максимальный уровень смертности был отмечен в группе повышенного уровня глюкозы в крови через 2 ч после еды (>11,1 ммоль/л). В то время как снижение этого показателя всего лишь на 2 ммоль/л уменьшало риск смертельного исхода при СД на 20–30%. Аналогичное 12-летнее исследование, включавшее 95 783 человека, выявило, что повышение уровня гликемии до 7,8% сопровождалось ростом риска ССЗ в 1,58 раза [21].
Согласно Европейскому проспективному исследованию EPIC-Norfolk, повышение гликированного гемоглобина на 1% увеличивает риск ССЗ в 1,31 раза (p<0,001). Подобные результаты были получены и в исследованиях ARIC и UKPDS: снижение HbA1c на 1% уменьшало риск ИМ на 14%, инсульта — на 12% [9]. Помимо этого в исследовании ADVANCE (Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation) [9] увеличение гликированного гемоглобина на 1% (начальный уровень HbA1c от 6,5%) почти в 2 раза повышало риск микрососудистых осложнений, а при исходном уровне HbA1c от 7% уже возрастал риск и макрососудистых заболеваний на 38% [10]. В то же время снижение этого показателя на 1% нивелировало риск микрососудистых событий на 26% [11], а макрососудистых — на 22%, а также произошло снижение сердечно-сосудистой и общей смертности на 25% и 22% соответственно [12, 13].
Кроме этого, связь гипергликемии с ССЗ подтвердило исследование UKPDS (UK Prospective Diabetes Study — проспективное исследование СД в Англии). Риск развития ХСН при СД составляет около 3% в год и прямо пропорционален уровню HbA1c [14]. Его снижение на 1% уменьшает риск смерти на 21%, ОИМ — на 14%, микрососудистых событий — на 14% и заболеваний периферических сосудов — на 43%. Исследователи доказали тот факт, что контроль гликемии снижал риск любого клинического исхода на 12%, а микрососудистых событий — на 25%. А если контроль гликемии сопровождался и поддержанием нормального уровня АД, риск развития любого осложнения уменьшался на 24%, смерти от длительного осложнения СД — на 37%, микрососудистых последствий — на 37%, ОНМК — на 44%.
- Частота ССЗ у мужчин с СД в 2–3 раза, а у женщин в 3–5 раз выше, чем у лиц без СД.
- Постпрандиальная гипергликемия — более значимый фактор риска развития сердечно-сосудистых событий, нежели уровень гликемии натощак. Поэтому логично, что постпрандиальная гликемия повышает риск развития ССЗ у пациентов с удовлетворительными показателями гликемического профиля натощак.
- СД и ССЗ представляют собой взаимоотягощающие заболевания.
Вообще увеличение сердечно-сосудистой смертности на фоне СД можно объяснить множеством причин кроме гипергликемии: гипогликемия, лабильность показателей гликемии, дезорганизация автономной нервной системы со снижением парасимпатической защиты, специфические изменения миокарда (гипертрофия кардиомиоцитов, накопление гликогена, огромное количество незрелых эластических волокон, диффузный склероз интерстициальной ткани, липидная инфильтрация клеток миокарда, значительное расширение саркоплазматического ретикулума, микромитохондриоз, гиперплазия аппарата Гольджи, локальный миоцитолиз и т. д.) [15]. Нельзя не заострить внимание на раннем развитии атеросклероза с формированием очаговых зон фиброза [16, 17]. Сам по себе СД 2-го типа ускоряет и усугубляет прогрессирование атеросклероза, который в большинстве случаев возникает до установления диагноза СД и появления начальной клиники. В структуре смертности пациентов с СД 2-го типа примерно 60–75% занимает смерть от коронарного атеросклероза и 10–25% — от церебрального и периферического [18,19].
В частности, атеросклероз при СД имеет определенные особенности: начало его развития — на 8–10 лет раньше в сравнении с теми людьми, у которых диабет отсутствует, и может быть диагностирован еще у пациентов на стадии нарушения толерантности к глюкозе. Атеросклеротическое поражение — это двусторонний процесс, чаще всего локализованный в сосудах среднего диаметра. Оно быстро прогрессирует и протекает у лиц с СД в более тяжелой форме.
Известно, что распространенность ИБС среди пациентов с СД 2-го типа выше в 2–4 раза, АГ — в 3 раза, ОИМ — в 4–7 раз выше, чем среди лиц без этого заболевания. В крупном исследовании была показана разница развития инфаркта миокарда у пациентов с и без СД 2-го типа (n=2332, из них с СД 2-го типа — 1059). За 7 лет наблюдения у лиц без этих заболеваний в анамнезе риск ИМ составил 3,5%, у больных с СД без клинических проявлений ИБС — 20,2%, а у пациентов с СД, перенесших ИМ, — 45%. Делая вывод, можно сказать, что риск неблагоприятного исхода у лиц с СД 2-го типа так же высок, как и у больных ИБС с постинфарктным кардиосклерозом [20].
Стоит отметить, что клинические проявление ИБС при СД имеют ряд особенностей [37]. Во-первых, одинаковая частота возникновения заболевания у мужчин и женщин, тогда как у лиц, не имеющих СД, ИБС чаще развивается у мужчин [38]. Во-вторых, у больных СД чаще имеют место безболевые («немые») формы ИБС, вплоть до безболевого ИМ, что объясняется наличием автономной нейропатии, из чего вытекает поздняя постановка диагноза, несвоевременное назначение лечения и, как следствие, более высокая частота развития осложнений [39]. Течение ИБС часто заканчивается внезапной аритмической смертью, а среди больных СД риск такого исхода увеличивается в 2 раза.
Артериальная гипертензия. В популяции лишь треть больных АГ поддерживают АД ниже 140/90 мм рт. ст., а человек, страдающий СД, имеет повышенный риск сердечно-сосудистой патологии. Поэтому эта проблема весьма актуальна, ведь среди пациентов с диабетом 70–80% имеют сопутствующую АГ. Обусловлена подобная распространенность развитием сходных метаболических и сосудистых нарушений. Оба эти заболевания — мощные независимые факторы риска быстрого развития большого количества случаев кардиоваскулярной патологии, атеросклероза, поражений сосудов глазного дна, почек и периферических сосудов. Сочетание обсуждаемого «дуэта» резко увеличивает риск развития терминальных стадий диабетических осложнений — ХПН, слепоты, ампутации нижних конечностей. Так, при СД 2-го типа без АГ риск ИБС и инсульта в 2–3 раза выше, чем у лиц без СД, риск почечной недостаточности — в 15–20 раз выше, слепоты — в 10–20 раз, гангрены — в 20 раз. Однако при сопутствующей АГ риск всех вышеперечисленных осложнений возрастает еще в 2–3 раза.
Еще одним основополагающим механизмом преждевременного и ускоренного прогрессирования ССЗ при СД служит инсулинорезистентность (ИР) [18, 22, 23]. ИР независимо от других значимых факторов риска кардиальных осложнений значительно увеличивает предрасположенность к возникновению ССЗ [19, 24, 25].
Висцеральное ожирение — это не только мощный корригируемый фактор риска СД 2-го типа, но и основной предиктор сопряженных с ожирением множества заболеваний. Это маркер метаболического синдрома, который совмещает в себе гормональные и метаболические нарушения, объединенные общим патофизиологически процессом, ИР [26].
Большое количество исследований доказало взаимосвязь метаболических механизмов и чувствительности периферических тканей к инсулину [27]. ИР — фактор развития и прогрессирования АГ, ИБС, ИМ, а, помимо прочего, и рака шейки матки, толстой и прямой кишки, яичников, молочных желез и заболеваний опорно-двигательного аппарата. Также в настоящее время есть данные о причастности ИР к развитию структурных и функциональных изменений миокарда. Проведены исследования, доказывающие взаимосвязь ИР и гипертрофии ЛЖ или увеличения его массы у лиц без СД [28, 29]. В одном исследовании 140 пациентов с СД уровень тощакового плазменного инсулина оказался самым сильным независимым показателем массы ЛЖ у всех обследуемых лиц. В исследовании на крысах было выявлено, что ИР влияет на увеличение повреждения сократительной функции миокарда [30]. В более крупном исследовании (число участников — 2623) ИР была ассоциирована только с увеличенной массой ЛЖ, и эта взаимосвязь объяснялась ожирением [31].
Также нельзя не затронуть тему гипогликемии. Ее влияние на увеличение сердечно-сосудистой смертности полноценно обосновано множеством различных механизмов. Во-первых, происходит изменение реологии — увеличение коагуляции крови и количества эритроцитов, приводящих к увеличению вязкости крови. Во-вторых, повышается концентрация эндотелина и С-реативного белка, активируется симпатоадреналовая система (увеличивается ЧСС и АД), усиливается вазоконстрикция и уменьшается вазодилатация (гипоксия, нарушение кровоснабжения миокарда, аритмии) [32]. Помимо этого в условиях недостатка глюкозы происходит снижение АТФ, провоцирующее гипоксию и снижение ритма сердца с удлинением интервала QT [33, 34]. Ну и, естественно, перенесенная гликемия снижает адаптацию организма к стрессу.
В исследовании Bode 101 пациенту проводили суточное мониторирование глюкозы в течение 12 дней. Больные, включенные в это исследование, не были осведомлены о результатах измерений глюкозы, а ведь они стали уникальными, поскольку было очевидно, что пациенты с 9-кратным контролем в течение суток по глюкометру пребывали в эугликемическом диапазоне всего 65% времени. Почти треть времени больные находились в гипергликемическом состоянии. Кроме того, были получены данные об эпизодах гипогликемии, на долю которых приходилось около 8% времени. Значимым служит то, что зарегистрированные случаи гипогликемии чаще происходили в ночные часы, что, по данным современной литературы, очень опасно в плане развития сердечно-сосудистых катастроф. В подтверждение можно привести пример суточного мониторирования гликемии пациента 70 лет с СД 2-го типа после перенесенного ИМ. Пациент находился на базисно-болюсной инсулинотерапии. У этого больного было установлено повышение уровня глюкозы в крови в утреннее время вследствие бессимптомных длительных ночных гликемий, не без влияний которых через 2 дня после обследования у него развился повторный ИМ.
В 2009 г. в Ливерпульском университете проводилось исследование по влиянию гипогликемии на динамику ЭКГ. 25 пациентам одномоментно проводили мониторирование ЭКГ и гликемии. Получено, что 13 эпизодов ночной гипогликемии сопровождались удлинением интервала QT до 445±23 мс, тогда как при нормогликемии он оставался нормальным. Сходные данные были получены еще в нескольких исследованиях, где было зафиксировано, что гипогликемия сопровождается удлинением интервала QT и депрессией сегмента ST.
Нарушения гликемии у пациентов с СД не ограничены только гипер- или гипогликемиями, они включают также и вариабельность показателя глюкозы крови. Много исследований показало, что лабильность уровня гликемии — это независимый фактор увеличения смертности у пациентов. В недавнем исследовании Krinsley говорилось о связи вариабельности гликемического профиля и смертельных исходов. Летальность при низкой вариабельности составила 12,1% и увеличивалась до 19,9%, 27,7% и 37,8% во втором, третьем и четвертом квартилях [42]. В 2008 г. Ceriello и соавт. выявили, что пики гликемии у пациентов с СД 2-го типа приводят к более значительному высвобождению 3-нитрозина-маркера оксидативного стресса и 8-изопростагландина F2a (маркера оксидативного стресса), чем при стабильно высоком уровне гликемии. Соответственно, это повышало риск ССЗ по сравнению с постоянной гипергликемией [43].
Кстати, затронув тему окислительного стресса, необходимо осветить и его вклад в развитие ССЗ. Множество работ последних лет указывают на связь таких заболеваний, как атеросклероз, ИБС, АГ, СД 2-го типа, с ухудшением эндотелийзависимой вазодилатации, опосредованной уменьшением эндотелиальной продукции или биодоступности оксида азота (NO). При окислительном стрессе происходит повышенное образование свободных радикалов (реактивных производных кислорода) и/или снижение антиоксидантной активности, что нарушает баланс окислительно-восстановительных реакций и приводит к серьезным изменениям клеточной функции с последующим повреждением структуры клеток. При участии свободных радикалов также усиливается перекисное окисление липидов, вследствие чего наступает дисбаланс между продукцией вазодилатирующих, ангиопротективных, антипролиферативных факторов, с одной стороны, и вазоконстрикторных, протромботических, пролиферативных факторов, с другой. А это все может играть важную роль в снижении коронарного резерва у больных АГ с ангиографически неповрежденными коронарными артериями.
Кроме этого, СД — это причина непосредственного поражения сердечной мышцы (диабетической кардиомиопатии), приводящей к развитию ХСН и нарушению функции левого желудочка. Помимо упоминавшегося ранее атеросклероза поражение миокарда вызывают специфические изменения: микроангиоптии и нейропатии. ХСН и СД 2-го типа присутствуют у трети пациентов. ХСН в 2–3 раза чаще развивается у лиц с СД, нежели без него. В российском исследовании ЭПОХА звучало следующее: наличие сердечной недостаточности — предиктор развития в дальнейшем СД. Среди больных ХСН III–IV функционального класса — 15,8% лиц с СД.
По данным Фремингемского исследования, СН встречается в 4 раза чаще у мужчин и в 8 раз чаще у женщин с СД 2-го типа в возрасте до 65 лет, чем в общей популяции [35]. Ежегодно СН развивается у 3,3% больных СД 2-го типа, не имевших ранее признаков СН [36]. В исследованиях SOLVD (Studies of Left Ventricular Dysfunction) и RESOLVD (Randomized Evaluation for Strategies of Left Ventricular Dysfunction) СД был независимым фактором риска повышенной смертности. В DIGAMI СН стала наиболее частой причиной летального исхода среди пациентов с СД 2-го типа и ИМ в анамнезе и обусловила 66% смертельных случаев в год.
Большинством исследователей признается, что первым доклиническим признаком нарушения сердечной деятельности при СД 2-го типа служит диастолическая дисфункция левого желудочка [40, 41]. Исследование, проведенное в России под руководством А. М. Мкртумяна, С. В. Подачиной и М. А. Свиридовой, подтвердило зависимость диастолической дисфункции и состояния эндотелиальной функции от длительности СД. Распространенность этих состояний была намного выше при стаже СД более 5 лет — 50% и 75% соответственно. В то время как у лиц, страдающих СД менее 5 лет, частота диастолической дисфункции составила 37%, а эндотелиальной — 50%.
Помимо связи уровня гликемического контроля с ССЗ существуют и другие предикторы. Исследователи рассматривают роль диабетической автономной полинейропатии (ДАН) в качестве отягощающего фактора. ДАН увеличивала риск внезапной сердечной смерти, что было продемонстрировано в исследованиях UK-HEART, ATRAMI и в др.
Следствия влияния ДАН:
- Развитие безболевой ишемии за счет поражения афферентных волокон. По данным P. Kempler, при холтеровском мониторировании выявлено 64,7% «немой» ишемии миокарда у пациентов с СД в сочетании с ДАН, в то время как при ее отсутствии — 4,1%.
- Повышение риска развития аритмии за счет снижения протективного действия парасимпатической системы [44].
- Нарушение суточного профиля АД в виде его недостаточного снижения в ночные часы, что является фактором риска поражения органов-мишеней и внезапной смерти. Отличия между СД 1-го и СД 2-го типа связаны с различиями в течении ДАН: при СД 2-го типа симптомы появляются, предшествуя моменту манифестации заболевания. Вероятней всего, это связано с более длительной продолжительностью метаболических нарушений при СД 2-го типа. Ранняя диагностика ДАН позволит верифицировать пациентов с высоким риском безболевой ишемии миокарда и внезапной смерти.
В заключение следует отметить, что СД представляет колоссальную проблему для здоровья населения всех стран мира, ведь рост заболеваемости позволил говорить о глобальной эпидемии. Ведение пациентов с СД и ССЗ представляет большую сложность как для кардиолога и терапевта, так и эндокринолога. На сегодняшний день крайне актуально создание совместными усилиями четких оптимальных и безопасных алгоритмов ведения подобных больных. И при этом во всех случаях подход к каждому человеку должен быть индивидуальным. В связи с этим врачу любой специальности необ
