Стартовая терапия сахарного диабета 2 типа
Сахарный диабет – одно из самых известных заболеваний эндокринной системы. Впервые его описал греческий врач Деметриос (II век до н. э.) из Апамании, обратив внимание на самые частые и яркие симптомы данного состояния, а именно на потерю жидкости (полиурию) и постоянную, неутолимую жажду (полидипсию). Деметриос описал данное заболевание греческим словом διαβήτης (диабет), которое означает «проникать сквозь». Считалось, что основным в патогенезе заболевания является неспособность организма удерживать жидкость, поэтому человек, страдающий этим заболеванием, непрерывно теряет жидкость и восполняет ее, «как сифон».
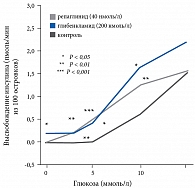
Рис. 1. Репаглинид-стимулированная секреция инсулина лишь частично глюкозозависимая
Рис. 2. Разница в секреции инсулина при внутривенном и пероральном приеме глюкозы (инкретиновый эффект)
Рис. 3. Постпрандиальные уровни эндогенного ГПП-1 снижены у больных СД типа 2
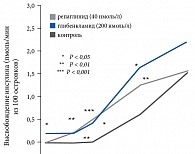
Рис. 4. Более выраженное снижение HbA1c у пациентов с более высокими исходными значениями
Рис. 5. Алгоритм стартовой терапии СД типа 2 при плохой переносимости метформина
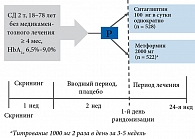
Рис. 6. Ситаглиптин vs Метформин при СД типа 2: дизайн исследования
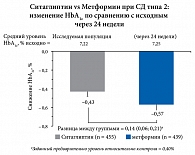
Рис. 7. Уровень HbA1c через 24 недели лечения

Рис. 8. Нежелательные явления со стороны ЖКТ
Прошло не одно столетие, прежде чем врачи разделили сахарный диабет на два ведущих типа: тип 1 «инсулинзависимый» и тип 2 «инсулиннезависимый». Наступление «инсулиновой» эры позволило значительно продлить жизнь пациентам, страдающим сахарным диабетом типа 1 (СД тип 1). Но гораздо больше пациентов, страдающих сахарным диабетом типа 2 (СД тип 2). В конце прошлого и начале нынешнего столетия распространенность СД типа 2 приняла масштабы всемирной эпидемии. Так, если в 2000 г. численность больных СД типа 2 в мире составляла около 160 млн человек, то к 2010 году, по прогнозам эпидемиологов, число больных должно было достигнуть 215 млн, а к 2025‑му – более 300 млн человек [1]. Но к началу 2010 года в мире уже было 285 млн заболевших преимущественно СД типа 2. В России всего в 2000 г. оценочно было 8 млн больных СД, а к 2025 г. их количество может увеличиться до 12 млн человек [2, 3].
Патогенез данного заболевания изучен достаточно хорошо. Ведущим фактором в развитии СД типа 2 является инсулинорезистентность (ИР). Антилиполитический эффект инсулина значимо повышается на фоне ИР, что приводит к избыточному накоплению жира, в основном по абдоминальнальному типу. Причем увеличивается количество свободных жирных кислот (СЖК) и глицерина, а, как известно, СЖК являются основным источником формирования атерогенных липопротеинов очень низкой плотности. В печени на фоне инсулинорезистентности повышается процесс глюконеогенеза, и как результат – повышение уровня гликемии натощак. Достоверно установлено, что ИР предшествует клинической манифестации СД типа 2, которая происходит при нарушении функциональной способности более 40% β-клеток. Формирование сосудистых осложнений, которые являются главной причиной инвалидизации пациентов, происходит именно на этом этапе развития заболевания. Пороговыми значениями гликемии, при которых повышается риск развития микро- и макрососудистых осложнений СД типа 2, являются: гликемия натощак > 6,5 ммоль/л, гликемия через 2 часа после еды > 8 ммоль/л, гликированный гемоглобин (HbA1 c) > 7%. Именно поэтому ранняя диагностика и своевременное назначение адекватного лечения являются столь необходимыми. Прежде всего, пациентам рекомендовано изменить привычный образ жизни. На первом этапе необходимо научить пациента правилам рационального питания с исключением из рациона легкоусвояемых углеводов и ограничением употребления жиров. Объяснить необходимость проведения адекватных физических нагрузок и контроля массы тела.
Но только изменение образа жизни не способствует достижению целевых уровней гликемии. Так, по результатам UKPDS 75% пациентов, соблюдающих только принципы изменения образа жизни, к сожалению, в большинстве случаев не достигают целевого уровня HbA1 c
Препараты, производные сульфонилмочевины (ПСМ), появились на фармацевтическом рынке таблетированных сахароснижающих средств одними из первых, именно это объясняет столь большую доказательную базу по их эффективности и безопасности. С момента открытия в 1950‑х годах ПСМ являются наиболее широко используемыми при лечении СД типа 2. Ежегодно у 5–10% больных при применении препаратов сульфонилмочевины в виде монотерапии развивается вторичная резистентность [5]. Еще одним частым побочным эффектом ПСМ является развитие гипогликемии. По данным разных авторов, частота ее развития колеблется от 1,8% до 59%, а частота развития тяжелой гипогликемии, требующей оказания пациенту посторонней помощи, составляет 1,9–3,5%. Чаще всего такое состояние возникает у пожилых людей. Иногда тяжелая гипогликемия становится причиной летального исхода в этой группе больных. Вследствие тяжелой гипогликемии могут развиваться судороги, транзиторная гемиплегия, аритмия, инфаркт миокарда и инсульт [6, 7]. Также необходимо учитывать, что риск возникновения гипогликемии увеличивается у пациентов с заболеванием почек, при условии элиминации ПСМ почками (или в случае, если их активные метаболиты выводятся через почки) [8]. Риск развития гипогликемии ограничивает возможность жесткого контроля концентрации глюкозы в крови пациента. Невозможность эффективного гликемического контроля препаратами сульфонилмочевины также можно объяснить прогрессирующим снижением секреции инсулина β-клетками [11], несоблюдением режима питания и объема физических нагрузок, избыточным весом, развитием инфаркта миокарда, инфекционными заболеваниями, а также приемом некоторых препаратов [9]. В проведенных in vitro исследованиях показано, что ПСМ могут стимулировать секрецию инсулина β-клетками поджелудочной железы, независимо от внеклеточной концентрации глюкозы, действуя как секретагоги, частично за счет прямого воздействия на клеточный экзоцитоз [12, 13]. Для оптимального гликемического контроля необходима глюкозозависимая стимуляция β-клеток, которая могла бы обеспечить максимальный контроль постпрандиальной гликемии.
С учетом обозначенной выше необходимости была создана группа меглитинидов, принципиально иной класс химических соединений, имеющий особенные фармакокинетические и фармакодинамические характеристики. Однако секреция инсулина под влиянием репаглинида является лишь частично глюкозозависимой (рис. 1).
Что же можно рекомендовать пациентам с впервые выявленным СД типа 2 при непереносимости метформина?
Первые упоминания о неких факторах секретируемых желудочно-кишечным трактом (ЖКТ), высказанных Старлингом, восходят к 1902 г., когда был открыт секретин. В 1930 году Лаббар (Labbarre) ввел термин инкретин, обозначив им гормональную активность кишечника, которая повышает эндокринную секрецию поджелудочной железы. Лишь в 1960 г. стало возможным подтвердить это предположение, когда научились определять уровень инсулина в крови. Был исследован секреторный ответ поджелудочной железы на пероральное и внутривенное введение глюкозы. Доказано, что при одинаковом повышении уровня гликемии секреция инсулина значительно выше при пероральном приеме глюкозы (рис. 2).
Эти результаты свидетельствовали о том, что не только взаимодействие глюкозы с β-клеткой, но и интестинальные факторы участвуют в стимуляции секреции инсулина [38]. Самыми важными гормонами-инкретинами являются: глюкозозависимый инсулинотропный полипептид (ГИП, GIP), прежде известный как желудочный ингибиторный полипептид (ЖИП) и глюкагонподобный пептид –1 (ГПП-1, GLP-1) [39, 40]. У людей без нарушения углеводного обмена до 70% постпрандиальной секреции инсулина обусловлено именно эффектом инкретинов [41, 42], который значительно снижен у больных СД типа 2 и НТГ (рис. 3) [41, 43, 44]. Инсулинотропная активность ГПП-1 четко зависит от уровня гликемии, реализуется путем взаимодействия ГПП-1 со специфическими рецепторами, расположенными на мембране β-клетки [45–47]. Необходимо отметить, что ГПП-1 активирует ген глюкокиназы и ген, кодирующий транспортер глюкозы GLUT 2, которые ответственны за внутриклеточный механизм секреции инсулина [48, 49].
Инфузия ГПП-1 вызывает снижение концентрации глюкозы крови до уровня гликемии натощак [41, 50–51]. Как только уровень гликемии снижается и приближается к нормальным значениям, влияние ГПП-1 на секрецию инсулина прекращается [49]. Клинически важным следствием зависимости эффектов ГПП-1 от уровня глюкозы крови является то, что ГПП-1 не может вызывать гипогликемию. Кроме того, ГПП-1 глюкозозависимым механизмом подавляет секрецию глюкагона панкреатическими β-клетками [48–49]. Наиболее изученным представителем инкретинов является ГПП-1, период его полувыведения составляет 1–2 мин., что делает невозможным применение его в качестве натурального препарата, в клинической практике используются его миметики и аналоги – эксенатид, лираглютид. Инактивация ГПП-1 в организме происходит вследствие отщепления аминокислоты аланина под действием дипептидил пептидазы 4 (ДПП-4). Ингибиторы ДПП-4 продлевают период полужизни инкретинов, благодаря чему усиливается их инсулинотропное действие.
В настоящее время созданы препараты – ингибиторы ДПП-4, защищающие эндогенный ГПП-1 от деградации и удлиняющие его способность снижать постпрандиальную гликемию. Мощным и полностью обратимым ингибитором ДПП-4 является ситаглиптин (Янувия). Благодаря подобному эффекту Янувия способствует повышению в крови уровня интактных инкретинов, влекущих за собой усиление глюкозозависимого инсулинового ответа. Одновременно препарат подавляет секрецию глюкагона. По данным литературы, ситаглиптин обладает протективным влиянием в отношении культуры β-клеток, путем подавления апоптоза и потенциирования пролиферации новых β-клеток [52–54]. Проведены эксперименты на крысах линии Wistar и на мышах с применением стрептозотоцининдуцированного сахарного диабета с нарушением архитектоники островков Лангерганса (распределение β- и α-клеток), с уменьшением числа β-клеток. Назначение ингибиторов DDP-4 позволило улучшить функциональное состояние β-клеток и частично восстановить микроархитектонику островков Лангерганса. В ходе аналогичных экспериментов на мышиной модели с нарушениями секреции и чувствительности к инсулину, при питании богатой жирами пищей лечение ситаглиптином в течение 3 месяцев увеличивало число инсулино-позитивных β-клеток. Кроме того, общая масса β-клеток и отношение числа β-клеток к α-клеткам нормализовалась. При этом восстановилась нормальная архитектура островков [54–59]. У человека, маркерами функции β-клеток служат отношение проинсулин к инсулину и коэффициент HOMA-β, которые значимо улучшаются на фоне терапии препаратом ситаглиптина. Следует отметить, что ситаглиптин достаточно быстро абсорбируется, достигнутая постоянная концентрация в плазме сохраняется в течение 2 дней после однократного приема, метаболизируется в организме, и около 90% принятого препарата экскретируется почками в неизменном виде [60]. По продолжительности действия ситаглиптин превосходит вилдаглиптин [61].
В исследованиях III фазы ситаглиптин изучался в плацебо-контролируемом исследовании, в качестве как монотерапии, так и с добавлением метформина или пиоглитазона. Проведено также клиническое исследование с использованием сульфонилмочевины в качестве препарата сравнения на фоне приема метформина. Рандомизированное двойное слепое плацебо-контролируемое исследование по оценке ОГТТ после однократного приема ситаглиптина. В него были включены 58 пациентов (42 мужчины, 16 женщин; средний возраст 50 лет) с впервые выявленным СД типа 2, HbA1 c 6,5%–11,7% (среднее 8,3%). Произведено распределение по группам: 1‑я группа – пациенты, однократно принявшие ситаглиптин в дозе 25 мг, 2‑я группа – пациенты, однократно принявшие ситаглиптин в дозе 200 мг, и 3‑я контрольная группа, принявшая плацебо. Проведена оценка однократного приема ситаглиптина в двух различных дозах на уровень гликемии (изменение ППК глюкозы) после ОГТТ, а также безопасность и переносимость однократного приема ситаглиптина у пациентов с СД типа 2. Отмечено, что однократный прием ситаглиптина в дозе 200 мг максимально снижал уровень глюкозы после ОГТГ, достоверное улучшение показателей выявлено и при приеме 25 мг препарата по сравнению с плацебо. Основной эффект данной группы заключается в усилении действия ГПП-1 за счет увеличения концентрации данного гормона на фоне снижения инактивации. По данным проведенного исследования, выявлено увеличение концентрации ГПП-1 практически в 2 раза по сравнению с плацебо, причем данный эффект наблюдался в обеих группах и незначительно отличался от дозы принятого препарата. Однократный прием ситаглиптина стимулировал инсулиновый ответ приблизительно на 20% по отношению к плацебо, без активной разницы между концентрацией препарата. Значимая разница между дозами принимаемого препарата была выявлена при оценке ответа при однократном приеме ситаглиптина на подавление секреции глюкагона после ОГТТ. Отмечено, что при приеме 25 мг ситаглиптина секреция глюкагона снижается приблизительно на 7%, а при приеме 200 мг – на 14% по сравнению с плацебо. Оценка клинической безопасности сопоставима с группой плацебо. При однократном приеме препарата тяжелой гипогликемии не наблюдалось.
Необходимо отметить проведенное 24‑недельное плацебо-контролируемое исследование по монотерапии у пациентов с СД типа 2. По дизайну данного протокола пациенты принимали ситаглиптин в дозе 100 мг в сутки или плацебо. Проводился контроль веса, уровня гликемии натощак, гликированного гемоглобина, оценивалось отношение проинсулин/инсулин натощак, рассчитывался индекс HOMA-β, оценивались возможные побочные действия, в том числе и частота развития гипогликемических состояний. Как было написано выше, большинство пациентов, страдающих СД типа 2, имеют избыточную массу тела или ожирение разной степени выраженности. Очень важно, чтобы препарат, способствующий нормализации гликемии, не способствовал увеличению веса, а в идеале приводил к снижению и нормализации ИМТ. При оценке 24‑недельного приема ситаглиптина в дозе 100 мг в сутки не выявлено прибавки массы, отмечено незначительное снижение данного показателя. Подтверждено протективное действие препарата на состояние β-клеток, так как выявлено значимое снижение соотношения проинсулин/инсулин с соответствующим приростом по индексу HOMA-β. Эти показатели достоверно подтверждают способность данного препарата позитивно воздействовать на функцию β-клеток, возможно, на предотвращение апоптоза в них. При анализе показателей гликемии натощак и уровня НвА1с выявлены значимые положительные результаты. Стоит обратить внимание, что в среднем уровень НвА1с снизился на 0,8%, однако интересен факт, что чем выше уровень исходного НвА1с, тем более выражено снижение данного показателя после 24‑недельной терапии ситаглиптином 100 мг.
Но и при «условно хорошем» уровне НвА1с (7%), по сравнению с группой плацебо, более чем у 40% пациентов выявлена положительная динамика. Гипогликемическое состояние бы-ло выявлено у 1,3% пациентов в группе, принимавшей ситаглиптин, и у 0,8% в группе плацебо. Не зафиксировано ни одного тяжелого случая гипогликемии. Из побочных нежелательных явлений достоверно чаще встречались желудочно-кишечные расстройства, которые проявлялись в виде: запоров – 3,8% и диареи – 4,6%, что можно объяснить индивидуальной чувствительностью к данному препарату и что случалось несопоставимо реже, чем аналогичные проявления при приеме препаратов из группы метформина.
Зная основные патогенетические механизмы возникновения и развития СД типа 2 и эффекты действия препаратов ингибиторов ДПП-4 (ситаглипина), можно говорить о необходимости применения данной терапии как патогенетического лечения данного заболевания. Вышеприведенные результаты клинических исследований по эффективности и безопасности применения ситаглиптина позволяют рекомендовать данный препарат как препарат выбора для стартовой терапии у пациентов с СД типа 2 с непереносимостью метформина.
Как отразится на состоянии углеводного обмена подобная стартовая терапия СД типа 2? Объективная невозможность у части пациентов с СД типа 2 начать стартовую терапию по предложенному Консенсусу ADA/EASD без ущерба может быть замещена ситаглиптином. Об этом свидетельствуют результаты 24‑недельного исследования с участием более 1000 пациентов. В этом исследовании проведено сравнение эффективности ситаглиптина и метформина в снижении уровня HbA1c, их эффективность и переносимость у пациентов с СД типа 2 с неадекватным контролем гликемии. Помимо этого, дополнительной целью было сравнение воздействия ситаглиптина и метформина на ЖКТ за 24 недели лечения. Пациенты путем рандомизации были распределены в 2 группы лечения и получали либо ситаглиптин 100 мг 1 раз в сутки, либо метформин 2000 мг/сут. (с постепенной титрацией дозы) (рис. 6).
Результаты исследования показали, что метформин не обладает преимуществом по сравнению с ситаглиптином в нормализации HbA1c (разница между группами не была статистически достоверной): как ситаглиптин, так и метформин вызывали клинически значимое снижение HbA1c (рис. 7).
Анализ безопасности и переносимости обоих препаратов показал, что лечение как ситаглиптином, так и метформином в целом переносилось хорошо: частота развития гипогликемии была низкой при применении обоих препаратов; при применении ситаглиптина отмечалась более низкая частота развития НЯ со стороны ЖКТ по сравнению с метформином. Это проявлялось в снижении частоты диареи и тошноты (рис. 8). Лечение как ситаглиптином, так и метформином вызывает некоторое снижение веса тела у больных сахарным диабетом типа 2.
Дата публикации 14 июня 2018Обновлено 23 июля 2019
Определение болезни. Причины заболевания
Эпидемия сахарного диабета (СД) длится уже достаточно долго.[9] По данным Всемирной организации здравоохранения (ВОЗ) в 1980 году на планете было около 150 миллионов человек, страдающих от СД, а в 2014 году — около 421 миллионов. К сожалению, тенденция к регрессу заболеваемости за последние десятилетия не наблюдается, и уже сегодня можно смело заявить, что СД является одним из распространённых и тяжёлых болезней.
Сахарный диабет II типа — хроническое неинфекционное, эндокринное заболевание, которое проявляется глубокими нарушениями липидного, белкового и углеводного обменов, связанного с абсолютным или же относительным дефицитом гормона, производимого поджелудочной железой.
У пациентов с СД II типа поджелудочная железа продуцирует достаточное количество инсулина — гормона, регулирующего углеводный обмен в организме. Однако из-за нарушения метаболических реакций в ответ на действие инсулина возникает дефицит этого гормона.
Инсулиннозависимый СД II типа имеет полигенную природу, а также является наследственным заболеванием.
Причиной возникновения данной патологии является совокупность определённых генов, а её развитие и симптоматика определяется сопутствующими факторами риска, такими как ожирение, несбалансированное питание, низкая физическая активность, постоянные стрессовые ситуации, возраст от 40 лет.[1]
Нарастающая пандемия ожирения и СД II типа тесно связаны и представляют основные глобальные угрозы здоровью в обществе.[3] Именно эти патологии являются причинами появления хронических заболеваний: ишемической болезни сердца, гипертонии, атеросклероза и гиперлипидемии.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением – это опасно для вашего здоровья!
Симптомы сахарного диабета 2 типа
Чаще всего симптоматика при СД II типа выражена слабо, поэтому данное заболевание можно обнаружить благодаря результатам лабораторных исследований. Поэтому людям, относящимся к группе риска (наличие ожирения, высокого давления, различных метаболических синдромов, возраст от 40 лет), следует проходить плановое обследование для исключения или своевременного выявления болезни.
К основным симптомам СД II типа следует отнести:
- перманентную и немотивированную слабость, сонливость;
- постоянную жажду и сухость во рту;
- полиурию — учащённое мочеиспускание;
- усиленный аппетит (в период декомпенсации (прогрессирования и ухудшения) болезни аппетит резко снижается);
- кожный зуд (у женщин часто возникает в области промежности);
- медленно заживающие раны;
- затуманенное зрение;
- онемение конечностей.
Период декомпенсации заболевания проявляется сухостью кожи, снижением упругости и эластичности, грибковыми поражениями. В связи с аномально повышенным уровнем липидов возникает ксантоматоз кожи (доброкачественные новообразования).
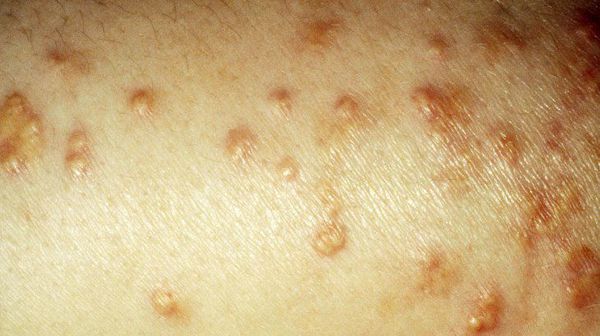
У больных СД II типа ногти подвержены ломкости, потере цвета или же появлению желтизны, а 0,1 – 0,3% пациентов страдают липоидным некробиозом кожи (отложения жиров в разрушенных участках коллагенового слоя).
Помимо симптомов самого СД II типа дают о себе знать также симптомы поздних осложнений заболевания: язвы на ногах, снижение зрения, инфаркты, инсульты, поражения сосудов ног и другие патологии.
Патогенез сахарного диабета 2 типа
Основная причина возникновения СД II типа — это инсулинорезистентность (утрата реакции клеток на инсулин), обусловленная рядом факторов внешней среды и генетическими факторами, протекающая на фоне дисфункции β-клеток. Согласно исследовательским данным, при инсулинорезистентности снижается плотность инсулиновых рецепторов в тканях и происходит транслокация (хромосомная мутация) ГЛЮТ-4 (GLUT4).
Повышенный уровень инсулина в крови (гиперинсулинемия) приводит к уменьшению количества рецепторов на клетках-мишенях. Со временем β -клетки перестают реагировать на повышающийся уровень глюкозы. В итоге образуется относительный дефицит инсулина, при котором нарушается толерантность к углеводам.
Дефицит инсулина приводит к снижению утилизации глюкозы (сахара) в тканях, усилению процессов расщипления гликогена до глюкозы и образования сахара из неуглеводных компонентов в печени, тем самым повышая продукцию глюкозы и усугубляя гимергликемию — симптом, характеризующийся повышенным содержанием сахара в крови.
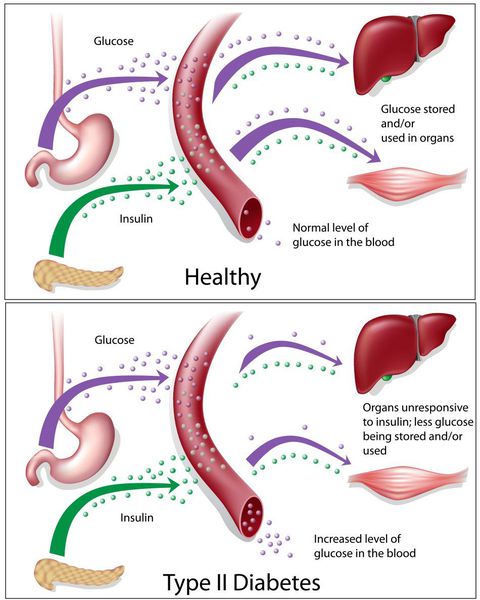
Окончания периферических двигательных нервов выделяют кальцитонин-подобный пептид. Он способствует подавлению секреции инсулина путём активизации АТФ-зависимых калиевых каналов (K+) в мембранах β-клеток, а также подавлению поглощения глюкозы скелетными мышцами.
Избыточный уровень лептина — главного регулятора энергетического обмена — способствует подавлению секреции инсулина, приводя к возникновению инсулинорезистентности скелетных мышц к жировой ткани.
Таким образом инсулинорезистентность включается в себя различные метаболические изменения: нарушение толерантности к углеводам, ожирение, артериальная гипертензия, дислипопротеидемия и атеросклероз. Главную роль в патогенезе этих нарушений играет гиперинсулинемия, как компенсаторное следствие инсулинорезистентности.[6]
Классификация и стадии развития сахарного диабета 2 типа
В настоящее время российские диабетологи классифицируют СД по степени тяжести, а также по состоянию углеводного обмена. Однако Международная Федерация диабета (МФД) довольно часто вносит изменения в цели лечения диабета и классификации его осложнений. По этой причине российские диабетологи вынуждены, постоянно изменять принятые в России классификации СД II типа по тяжести и степени декомпенсации заболевания.
Существуют три степени тяжести заболевания:
- I степень — наблюдаются симптомы осложнений, дисфункция некоторых внутренних органов и систем. Улучшение состояния достигается путём соблюдения диеты, назначается применение препаратов и инъекций.
- II степень — достаточно быстро появляются осложнения органа зрения, происходит активное выделение глюкозы с мочой, появляются проблемы с конечностями. Медикаментозная терапия и диеты не дают эффективных результатов.
- III степень – происходит выведение глюкозы и белка с мочой, развивается почечная недостаточность. В этой степени патология не поддаётся лечению.
По состоянию углеводного обмена выделяют следующие стадии СД II типа:
- компенсированная — нормальный уровень сахара в крови, достигнутый с помощью лечения, и отсутствие сахара в моче;
- субкомпенсированая — уровень глюкозы в крови (до 13,9 ммоль/л) и в моче (до 50 г/л) умеренный, при этом ацетон в урине отсутствует;
- декомпенсированная — все показатели, характерные для субкомпенсации, значительно повышены, в моче обнаруживается ацетон.
Осложнения сахарного диабета 2 типа
К острым осложнениям СД II типа относятся:
- Кетоацидотическая кома — опасное состояние, при котором происходит тотальная интоксикация организма кетоновыми телами, а также развивается метаболический ацидоз (увеличение кислотности), острая печёночная, почечная и сердечно-сосудистая недостаточность.
- Гипогликемическая кома — состояние угнетения сознания, развивающееся при резком уменьшении содержания глюкозы в крови ниже критической отметки.
- Гиперосмолярная кома — данное осложнение развивается в течение нескольких дней, в результате которого нарушается метаболизм, клетки обезвоживаются, резко увеличивается уровень глюкозы в крови.
Поздними осложнениями СД II типа являются:
- диабетическая нефропатия (патология почек);
- ретинопатия (поражение сетчатки глаза, способное привести к слепоте);
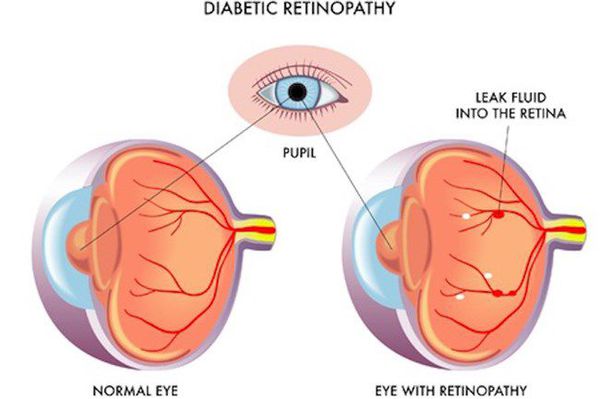
- полинейропатия (поражение периферических нервов, при котором конечности теряют чувствительность);
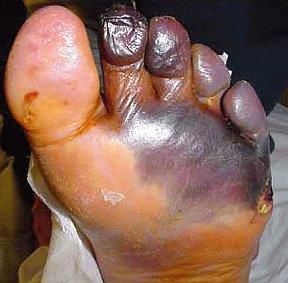
- синдром диабетической стопы (образование на нижних конечностях открытых язв, гнойных нарывов, некротических (отмирающих) тканей).
Диагностика сахарного диабета 2 типа
Для того чтобы диагностировать СД II типа необходимо оценить симптомы болезни и провести следующие исследования:
- Определение уровня глюкозы в плазме крови. Кровь берётся из пальца, натощак. Положительный диагноз СД II типа устанавливается в случае наличия глюкозы свыше 7,0 ммоль/л при проведении анализа два или более раза в разные дни. Показатели могут изменяться в зависимости от физической активности и употребления пищи.
- Тест на гликированный гемоглобин (HbAc1). В отличие от показателей уровня сахара в крови, уровень HbAc1 меняется медленно, поэтому данный анализ является надёжным методом диагностики, а также последующего контроля заболевания. Показатель выше 6,5% свидетельствует о наличии СД II типа.
- Анализ мочи на глюкозу и ацетон. У пациентов с СД II типа в суточной моче содержится глюкоза, её определяют только при условии повышенного уровня глюкозы в крови (от 10 ммоль/л). Присутствие в урине трёх-четырёх «плюсов» ацетона также свидетельствует о наличии СД II типа, тогда как в моче здорового человека данное вещество не обнаруживается.
- Анализ крови на толерантность к глюкозе. Предполагает определение концентрации глюкозы спустя два часа после приёма натощак стакана воды с растворённой в нём глюкозой (75 г). Диагноз СД II типа подтверждается, если первоначальный уровень глюкозы (7 ммоль/л и более) после выпитого раствора повысился минимум до 11 ммоль/л.
Лечение сахарного диабета 2 типа
Лечение СД II типа предполагает решение основных задач:
- компенсировать недостаток инсулина;
- скорректировать гормонально-метаболические нарушения;
- осуществление терапии и профилактики осложнений.
Для их решения применяется следующие методы лечения:
- диетотерапия;
- физические нагрузки;
- применение сахароснижающих препаратов;
- инсулинотерапия;
- хирургическое вмешательство.
Диетотерапия
Диета при СД II типа, как и обычная диета, предполагает оптимальное соотношение основных веществ, содержащихся в продуктах: белки должны составлять 16% суточного рациона, жиры — 24%, а углеводы — 60%. Отличие диеты при диабете II типа заключается в характере потребляемых углеводов: рафинированные сахара заменяются медленно усваиваемыми углеводами. Так как данное заболевание возникает у полных людей, потеря веса является важнейшим условием, нормализующим содержание глюкозы в крови. В связи с этим рекомендована калорийность диеты, при которой пациент еженедельно будет терять 500 г массы тела до момента достижения идеального веса. Однако при этом еженедельное уменьшение веса не должно превышать 2 кг, в противном случае это приведёт к избыточной потере мышечной, а не жировой ткани. Количество калорий, необходимое для суточного рациона пациентов с СД II типа, рассчитывается следующим образом: женщинам нужно умножить идеальный вес на 20 ккал, а мужчинам — на 25 ккал.
При соблюдении диеты необходимо принимать витамины, так как во время диетотерапии происходит избыточное выведение их с мочой. Нехватку витаминов в организме можно компенсировать при помощи рационального употребления полезных продуктов, таких как свежая зелень, овощи, фрукты и ягоды. В зимние и весенние периоды возможен приём витаминов в дрожжевой форме.
Физическая нагрузка
Верно подобранная система физических упражнений, с учётом течения заболевания, возраста и присутствующих осложнений, способствует значительному улучшению состояния больного СД. Эта методика лечения хороша тем, что необходимость применения инсулита практически отпадает, так как во время физических нагрузок глюкоза и липиды сгорают без его участия.
Лечение сахароснижающими препаратами
На сегодняшний день используют производные сахароснижающих препаратов:
- сульфонилмочевины (толбутамид, глибенкламид);
- бигуаниды, снижающие глюконеогенез в печени и повышающие чувствительность мышц и печени к инсулину (метформин);
- тиазолидиндионы (глитазоны), схожие по свойствам с бигуанидами (пиоглитазон, росиглитазон);
- ингибиторы альфа-глюкозидаз, снижающие темпы всасывания глюкозы в желудочно-кишечном тракте (акарбоза);
- агонисты рецепторов глюкагоноподобного пептида-1, стимулирующие синтез и секрецию инсулина, снижающие продукцию глюкозы печенью, аппетит и массу тела, замедляющие эвакуацию пищевого комка из желудка (эксенатид, лираглутид);
- ингибиторы депептидил-пептидазы-4, также стимулирующие синтез и секрецию инсулина, снижающие продукцию глюкозы печенью, не влияющие на скорость эвакуации пищи из желудка и оказывающие нейтральное действие на массу тела (ситаглиптин, вилдаглиптин);
- ингибиторы натрий-глюкозного котранспортера 2 типа (глифлозины), снижающие реабсорбцию (поглощение) глюкозы в почках, а также массу тела (дапаглифлозин,эмпаглифлозин).
Инсулинотерапия
В зависимости от тяжести болезни и возникающих осложнений врач назначает приём инсулина. Данный метод лечения показан примерно в 15-20% случаев. Показаниями к применению инсулинотерапии являются:
- быстрая потеря веса без видимой на то причины;
- возникновение осложнений;
- недостаточная эффективность других сахароснижающих препаратов.
Хирургическое лечение
Несмотря на множество гипогликемических препаратов, остаётся не решённым вопрос об их правильной дозировке, а также о приверженности пациентов к выбранному методу терапии. Это, в свою очередь, создаёт трудности при достижении длительной ремиссии СД II типа. Поэтому всё большую популярность в мире получает оперативная терапия данного заболевания — бариатрическая или метаболическая хирургия. МФД считает данный метод лечения пациентов с СД II типа эффективным. В настоящее время в мире проводится более 500 000 бариатрических операций в год. Существует несколько видов метаболической хирургии, самыми распространёнными являются шунтирование желудка и мини гастрошунтирование.[4]
Шунтирование желудка по Ру
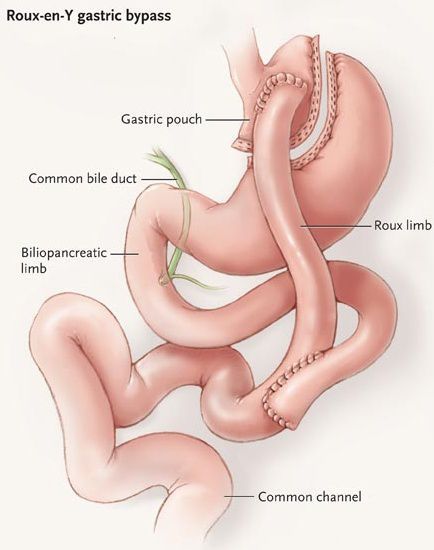
Во время шунтирования, желудок пересекается ниже пищевода таким образом, чтоб его объём сократился до 30 мл. Оставшаяся большая часть желудка не удаляется, а заглушается, предотвращая попадание в неё пищи.[5] В результате пересечения образуется маленький желудок, к которому затем пришивается тонкая кишка, отступив 1 м от её окончания. Таким образом пища будет прямиком попадать в толстую кишку, при этом обработка её пищеварительными соками снизится. Это, свою очередь, провоцирует раздражение L-клеток подвздошной кишки, способствующее снижению аппетита и увеличению роста клеток, синтезирующих инсулин.
Мини шунтирование желудка
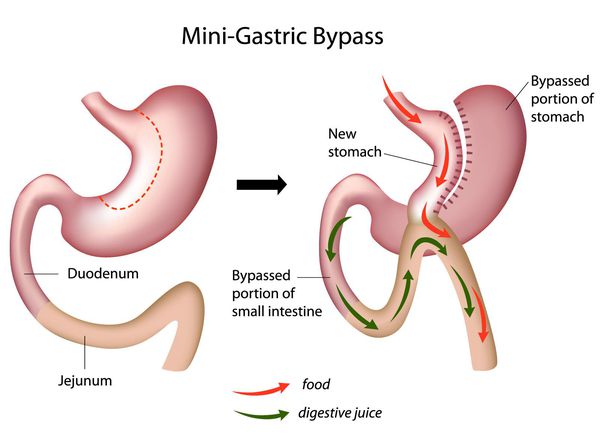
Главное отличие минигастрошунтирования от классического шунтирования желудка — сокращение количества анастомозов (соединений отрезков кишки).[2] При выполнении традиционной операции накладывается два анастомоза: соединение желудка и тонкой кишки и соединение разных отделов тонкой кишки. При минигастрошунтировании анастомоз один — между желудком и тонкой кишкой. Благодаря малому объёму вновь сформированного желудка и быстрому поступлению еды в тонкую кишку у пациента возникает чувство насыщения даже после приёма незначительных порций пищи.
К другим видам бариатрической хирургии относятся:
- гастропликация — ушивание желудка, предотвращающее его растягивание;[8]
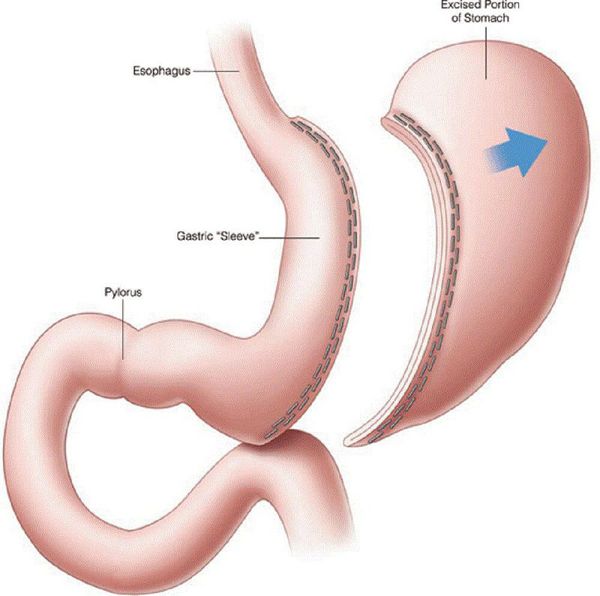
- рукавная гастропластика (иначе её называют лапароскопической продольной резекцией желудка) — отсечение большей части желудка и формирование желудочной трубки объёмом 30 мл, которое способствует быстрому насыщению, а также позволяет избежать соблюдения строгой диеты;

