Вибрационная чувствительность при сахарном диабете
Статья посвящена диагностике и методам выявления диабетической периферической нейропатии
Во всем мире отмечается стремительное увеличение числа больных, страдающих сахарным диабетом (СД). По экспертной оценке IDF (International Diabetes Federation), в 2015 г. это число уже составило 415 млн человек, хотя, по более ранним предварительным прогнозам, только к 2030 г. ожидалась цифра в 520 млн. По современным уточненным прогнозам, к 2040 г. численность пациентов с диагностированным СД увеличится во всем мире до 642 млн [1]. В свою очередь, в 2015 г. количество больных с осложнениями СД, среди которых лидирующую позицию занимает симптомная дистальная симметричная диабетическая полинейропатия (ДПН) [2], оценивалось в 30–40 млн. Это означает, что к 2040 г. симптомная ДПН будет насчитывать 100 млн случаев.
Максимально точное определение ДПН было дано на согласительной конференции в Сан-Антонио (США) в 1988 г.: ДПН – специфическое для СД осложнение, сопровождающееся клинической симптоматикой или без нее, характеризующееся поражением как периферической, так и автономной нервной системы при исключении других причин [3].
ДПН классифицируют по стадиям (табл. 1) [4].![Таблица 1. Классификация ДПН по стадиям [4] Таблица 1. Классификация ДПН по стадиям [4]](https://www.rmj.ru/upload/medialibrary/fb1/572-1.png)
Вследствие изменчивой клинической картины нейропатии ее диагностика является нелегкой задачей. Чаще всего диагноз ДПН может быть установлен на основании жалоб пациента и данных тщательного медицинского осмотра [5]. Проведения дальнейшего неврологического обследования в большинстве случаев не требуется, т. к. оно может лишь достоверно подтвердить наличие полинейропатии без выявления причин ее развития.
NB!
• Для подтверждения болевой формы ДПН не требуется выявление нарушений проводимости по толстым нервным волокнам, т. к. болевая ДПН не коррелирует со скоростью нервной проводимости [6]. Однако исследование проводимости рекомендовано, если при осмотре выявляются признаки моторной нейропатии.
• У всех больных СД 1-го типа необходимо проводить скрининг на наличие ДПН при неудовлетворительном гликемическом контроле спустя 3 года от дебюта заболевания, у больных СД 2-го типа – с момента установления диабета [7].
Среди существующих диагностических методик наиболее признанной является диагностическая система P.J. Dyck (1988), согласно которой диагноз нейропатии выставляется по 4-м критериям:
1) симптомы нейропатии;
2) неврологическое обследование;
3) автономные моторные (сенсорные) функциональные тесты;
4) скорость проведения импульса по моторным/сенсорным волокнам.
Этапы диагностического поиска
1. Сбор анамнеза и выявление жалоб больного.
2. Осмотр и оценка внешнего вида (status localis) нижних конечностей.
3. Оценка субъективных и объективных симптомов:
– использование шкал и опросников;
– неврологическое обследование с определением порога различных видов поверхностной и глубокой чувствительности;
– двусторонняя оценка сухожильных рефлексов (коленного, ахиллова);
– оценка силы в различных группах мышц рук и ног.
4. Электрофизиологические методы обследования.
5. Другие методы оценки:
– панч-биопсия кожи (прижизненное выявление на ранних стадиях поражения тонких немиелинизированых нервных волокон);
– биопсия нерва;
– неинвазивные методы (конфокальная микроскопия тонких нервов роговицы).
1. Анамнез и жалобы
В беседе с пациентом, уточняя жалобы, необходимо задавать наводящие вопросы, т. к. больные нередко затрудняются в описании испытываемых ими ощущений.
Типичная положительная неврологическая симптоматика: жжение, покалывание, парестезии (ощущение ползания «мурашек»), стреляющие боли в покое, аллодиния (ощущение боли при действии безболевого раздражителя).
Необходимо уточнить: 1) с какого времени наблюдается такая симптоматика, как развивается, усиливается ли в вечернее и ночное время; 2) когда возникает боль – при ходьбе или в покое, усиливается ли при изменении положения ног (эти сведения помогут установить специфичность симптомов).
NB! При ДПН болевые ощущения возникают в покое.
Наиболее часто встречающаяся форма ДПН – симметричная сенсомоторная нейропатия дистального типа. Речь идет о симметричных симптомах, затрагивающих в одинаковой мере левые и правые конечности (нижние конечности больше подвержены изменениям).
Типичная отрицательная неврологическая симптоматика (неврологический дефицит): онемение, одеревенение, покалывание, неустойчивость при ходьбе.
NB! Легкоузнаваемыми диагностическими сигналами являются ощущение надетых чулок (перчаток), а также отсутствие чувствительности на конечностях.
2. Осмотр и оценка внешнего вида нижних конечностей
Осмотр стоп и кожных покровов пациента важен для обнаружения характерных для нейропатии проявлений: сухости, участков гиперкератоза (мозолей) в зонах избыточного давления, язвенных дефектов на подошвенной поверхности стоп, деформаций, мышечной атрофии (рис. 1). 
3. Оценка субъективных и объективных симптомов
Опросники и шкалы. В настоящее время существует большое количество алгоритмов, рекомендаций и шкал для диагностики и оценки степени выраженности нейропатии.
Одной из лучших признана шкала невропатических нарушений NIS (Neuropathy Impairment Score). Существует ее модификация – «NIS (LL-Low Limbs) + 7», которая представляет собой методику комплексной оценки неврологического статуса для нижних конечностей, дополненную 7 неврологическими тестами [8]. Данная методика хоть и обладает высокой чувствительностью и специфичностью в диагностике ДПН, однако редко применяется в клинической практике ввиду сложности. Чаще всего она используется в клинических исследованиях. В клинической практике для оценки степени ДПН по интенсивности наиболее часто встречающихся жалоб эффективно применяется шкала TSS.
На сегодняшний день предложено множество скрининговых опросников по симптомам нейропатии, их количественной оценке и выраженности, которые просты в использовании: NSS – опросник, применяемый в большинстве европейских исследований [9, 10]; MNSI (The Michigan Neuropathy Screening Instrument) [11].
Немецкие неврологи P. Dyck et al. [12, 13] разработали и впервые применили шкалу для оценки клинических симптомов NDS, а затем NIS. В настоящее время для определения риска возникновения синдрома диабетической стопы (СДС) лучшей считается шкала NDS (чем больше показано баллов, тем выше риск возникновения СДС) [14].
NB! Необходимо помнить, что вне зависимости от того, какую оценочную шкалу в своей практике использует врач, неврологический осмотр нижних конечностей является важным и неотъемлемым методом диагностики ДПН [15].
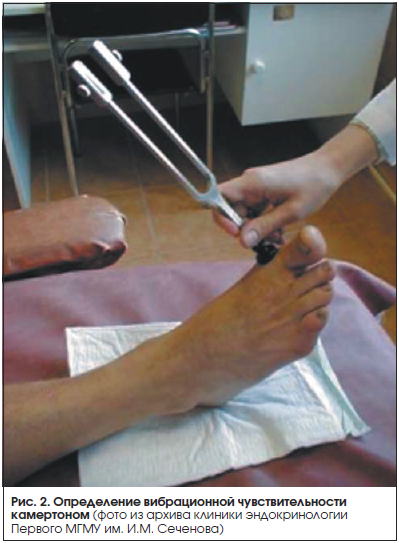
Неврологическое обследование (методы клинического скрининга ДПН). Нередко единственным ранним диагностическим критерием, на основании которого можно выставить ранний диагноз, когда прочие неврологические симптомы еще отсутствуют, является вибрационная чувствительность.
Порог вибрационной чувствительности оценивается при помощи неврологического градуированного камертона с частотой 128 Гц (Rydel-Seiffer) (рис. 2). 
Определение тактильной чувствительности. Определение тактильной чувствительности проводится с помощью монофиламента 10 г (Thio-Feel, Германия) (рис. 3). 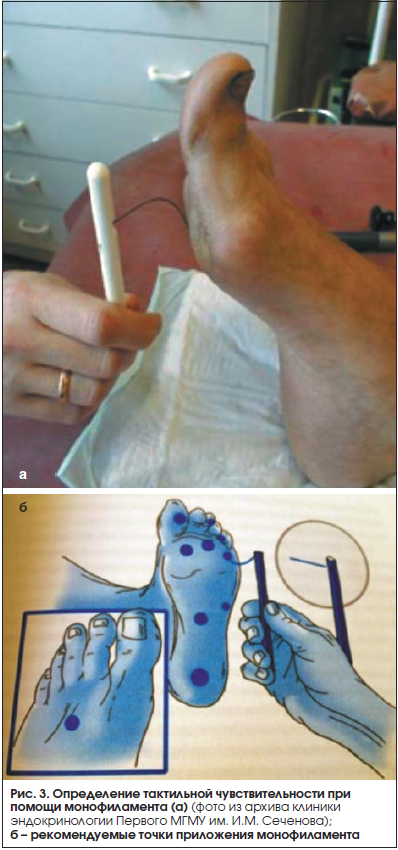
Было проведено множество исследований по применению монофиламента для оценки риска развития СДС, чувствительность метода варьирует от 86 до 100% [16–18].
Определение болевой чувствительности. Болевую чувствительность исследуют с помощью укола тупой неврологической иглы на тыльной поверхности стоп и в области концевой фаланги I пальца стопы.
Определение температурной чувствительности. Температурная чувствительность оценивается при помощи специального инструмента – «тип-терма» (Thip-Term, Германия), представляющего собой термический цилиндр, один конец у которого сделан из металла, другой – из пластика (рис. 4). В норме прикосновение различных материалов ощущается по-разному.
Сухожильные рефлексы исследуют по классической методике, в первую очередь оцениваются ахилловы рефлексы, реже – коленные. 
4. Электрофизиологические методы диагностики
Электрофизиологические методы оценки периферических нервов, в частности стимуляционная электронейромиография, являются важнейшим дополнением клинического обследования.
Характеристика электрофизиологических методов:
• неинвазивные, объективные и достаточно надежные методы диагностики ДПН;
• позволяют оценить степень тяжести, динамику и прогрессирование болезни, включая ДПН 1-й стадии (субклиническую) [19];
• несут информацию не только о функции нервного волокна, но и о его структуре, на основании чего можно установить, имеет болезнь моторную или сенсорную доминанту, а также оценить характер поражения нерва: аксональный или демиелинизирующий;
• основная роль электрофизиологических методов заключается в дифференциальной диагностике нейропатий (мононейропатии, радикулопатии и др.).
Электронейромиография (ЭНМГ) является общим названием 2-х дополняющих друг друга анализов: миография регистрирует электрические сигналы, возникающие в спокойном и функционирующем состоянии мышечных волокон, при помощи электродных игл; нейрография регистрирует данные проводимости нервных волокон (рис. 5). Нейрография и миография представляют собой не замещающие, а дополняющие друг друга методики обследования.
Ограничения в применении ЭНМГ: исследование сопровождается электрическим раздражением, электродные иглы могут причинять боль. 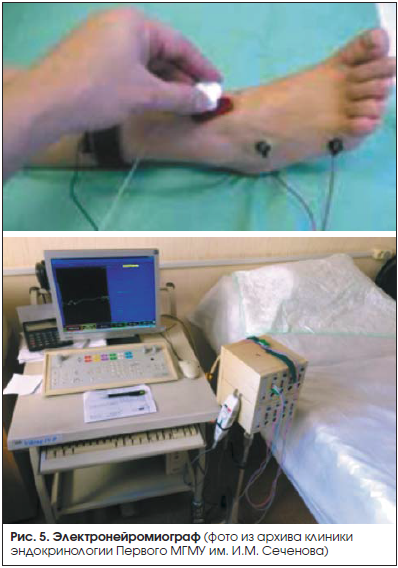
NB!
• Данный вид исследования выявляет поражение лишь толстых миелинизированных нервных волокон. Например, при некоторых патологических изменениях, встречающихся при ДПН, максимальная скорость распространения возбуждения (СРВ) по нерву может оставаться неизменной.
• Снижение СРВ является чувствительным, но неспецифическим показателем начальной ДПН и может указать на субклинические изменения [20, 21].
• СРВ свидетельствует о прогрессировании ДПН, ее тяжести [22].
• Доказано, что изменения СРВ коррелируют со степенью гликемического контроля [23]: изменение уровня HbA1c на 1% связано с изменением максимальной СРВ по нервному волокну на 1,3 м/с [24].
• Для подтверждения болевой формы ДПН не требуется выявление нарушений проводимости по толстым нервным волокнам, т. к. болевая ДПН не коррелирует со скоростью нервной проводимости [25]. Однако исследование проводимости рекомендовано, если при осмотре выявляются признаки моторной нейропатии.
• Электрофизиологические методы исследования чаще всего должны применяться при дифференциально-диагностическом поиске, в случаях атипичного течения и быстрого прогрессирования ДПН.
5. Другие методы оценки
В последние годы во всем мире активно развиваются методы очень ранней диагностики поражения тонких немиелинизированных нервных волокон, которые страдают в первую очередь при СД. К инвазивным методам относится панч-биопсия кожи стоп с последующим иммуногистохимическим анализом плотности нервных волокон с использованием маркера нервной ткани PGP 9,5, а к неинвазивным методам – исследование плотности тонких нервных волокон в роговице с помощью конфокального микроскопа [26]. Целесообразность столь детального исследования состояния тонких нервных волокон диктуется в первую очередь необходимостью начать лечение на самых ранних стадиях поражения нервов.
Панч-биопсия кожи. Для раннего обнаружения сенсорной нейропатии и выявления поражений тонких немиелинизированных нервных волокон все чаще применяется морфологическая оценка ДПН путем прямой визуализации эпидермальных нервов, выполняемой при помощи специального инструмента – панча (рис. 6) [27]. Иммуногистохимический количественный анализ кожных нервов выполняется с применением панаксонального маркера – генного продукта белка PGP 9,5. 
Интерпретация результатов: выявление поражения нервных волокон осуществляется посредством иммуногистохимических методик. Оцениваются количество интра-эпидермальных тонких нервных волокон в препарате, их толщина и длина (рис. 7). Важно правильно выбрать участок тела для выполнения биопсии, поскольку, как показано во многих исследованиях, плотность интраэпидермальных нервных волокон имеет значительно большую диагностическую ценность на дистальных участках, нежели в проксимальных отделах [27, 28]. Высокая диагностическая и прогностическая ценность методики заключается в точном определении поражения тонких волокон и степени его тяжести [28]. 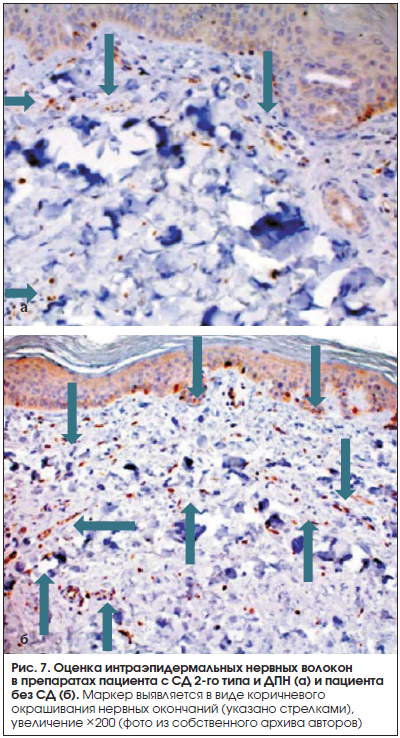
Биопсия нерва. Биопсия икроножного нерва на протяжении многих лет используется в диагностических исследованиях периферической нейропатии [29–31] и является полезной диагностической процедурой у пациентов с неизвестной причиной нейропатии или атипично протекающей ДПН [31]. Однако панч-биопсия представляет собой инвазию глубиной около 10 мм и нередко сопровождается осложнением [32, 33], кроме того, ее востребованность снижается благодаря широкому выбору неинвазивных методов.
Неинвазивные методы. В настоящее время одним из перспективных неинвазивных и наиболее чувствительных методов оценки поражения тонких нервных волокон при ДПН является конфокальная микроскопия роговицы. Известно, что роговица – наиболее иннервируемая ткань в организме (на 1 мм2 роговицы приходится до 7000 ноцицепторов, в то время как в коже их плотность составляет 200 на 1 мм2) [34]. С помощью данной технологии можно определить процессы повреждения и репарации в корнеальном нерве, а сопоставляя эти данные с показателями ЭНМГ, установить взаимосвязь длины нервных волокон роговицы с длительностью СД [35]. Возможно, в ближайшем будущем корнеальная конфокальная микроскопия будет активно применяться в практической медицине для диагностики и динамической оценки ДПН [26].
В собственном когортном исследовании, проведенном в 2012–2015 гг., при помощи шкал TSS и NIS LL, а также ЭНМГ (7 тестов) было обследовано 103 пациента с СД 2–го типа, госпитализированных в отделение диабетологии и общей эндокринологии Университетской клинической больницы № 2 Первого МГМУ им. И.М. Сеченова (табл. 2).
В исследуемой когорте больных выявлена значительная распространенность ДПН, которая составила 74,7% (n=77). При распределении больных с ДПН в исследованной когорте по стадиям отмечено, что наиболее часто выявляется симптомная ДПН (2-я стадия) – 41% случаев, частота выявления субклинической стадии составила 33%.
Достаточно высокая частота выявления субклинической (1-я стадия) ДПН поднимает вопрос о необходимости более широкого использования ЭНМГ для обследования больных с СД, т. к. при отсутствии такого обследования огромное количество пациентов с уже имеющейся патологией периферических нервов не будут получать требуемого патогенетического лечения.
Из общей когорты исследуемых больных были выделены 20 пациентов с субклинической стадией ДПН для сравнения с группой контроля из 10 условно здоровых добровольцев (все участники сопоставимы по полу и возрасту). В обеих группах проведена панч-биопсия кожи голени в области латеральной лодыжки. Основной группе был назначен депротеинизированный гемодериват (препарат Актовегин®) в течение 5 мес.: 10 инфузий 250 мл 20% раствора, с последующим приемом препарата Актовегин® в форме драже 200 мг 3 р./сут. Актовегин® – поликомпонентный препарат, обладающий множественными эффектами, среди которых антигипоксантный (усиление утилизации кислорода клетками), инсулиноподобный (увеличение транспорта глюкозы в клетки), а также улучшение микроциркуляции и нивелирование дисфункции эндотелия. Препарат доказал свою эффективность у пациентов с ДПН в рандомизированных исследованиях, показывая благоприятные терапевтические эффекты в отношении нейропатических симптомов и вибрационной чувствительности [36, 37]. По окончании лечения всем пациентам повторно выполнена панч-биопсия кожи голени. Количество нервных окончаний в коже оценивали путем подсчета положительно окрашенных волокон PGP 9,5 (иммунопероксидазная реакция) в 5 полях зрения при увеличении ×200. Отдельно оценивались волокна в базальном слое эпидермиса и в дерме.
Отличий по количеству нервных волокон в базальной части эпидермиса в исследуемых группах не выявлено. В дерме пациентов основной группы до лечения выявлено небольшое количество волокон, окрашенных PGP 9,5, после лечения количество нервных окончаний увеличилось в 1,5 раза. В группе контроля количество нервных окончаний было наибольшим и составило в среднем 12 (рис. 8).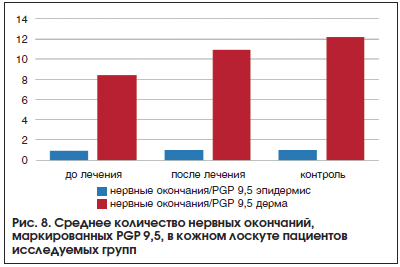
Анализ полученных данных показал достоверное повышение экспрессии маркера после лечения (р=0,018).
Таким образом, можно сделать вывод, что поражение тонких немиелинизированных нервных волокон происходит уже на самых ранних, доклинических этапах развития СД, и выявление структурных изменений должно быть максимально ранним в целях скорейшего и своевременного назначения патогенетического лечения. Собственное исследование и данные литературы подтверждают эффективность применения препарата Актовегин® у больных СД 2-го типа с полинейропатией, в т. ч. на субклинической стадии.
Сахарный диабет является одной из самых частых причин поражения периферической нервной системы. Частота встречаемости этого осложнения напрямую зависит от длительности основного заболевания. В среднем у трети пациентов, страдающих сахарным диабетом, выявляются клинические признаки, свидетельствующие о нарушении функции ПНС, нередко в сочетании с другими основными осложнениями диабета – ретинопатией и нефропатией.
Патогенез диабетических невропатий до конца не изучен. Основным действующим фактором является гипергликемия. Согласно одной из теорий поражение периферической нервной системы связано с метаболическими нарушениями в нейронах и шванновских клетках. Другим механизмом является нарушение реологических свойств крови и микроангиопатия vasa nevrorum с последующим ишемическим повреждением и дегенерацией нервных волокон. Большое значение придается развитию окислительного стресса и аутоиммунным реакциям при диабетической невропатии. Согласно мнению ряда авторов, также существует наследственная предрасположенность к развитию невропатии при сахарном диабете.
Выделяют десять основных подтипов диабетической невропатии (табл. 1), большинство из которых имеют хроническое течение. Имеются важные отличия не только между подтипами невропатии, но также и в типе связанного с ними диабета. Так, при диабете 1 типа поражение периферических нервов возникает только спустя несколько лет после установления диагноза. Наиболее ранними проявлениями являются потеря болевой чувствительности и автономная дисфункция, значительно позже может присоединиться мышечная слабость в дистальных отделах конечностей. Некомпрессионные фокальные невропатии, такие как краниальная невропатия, «диабетическая амиотрофия», редко встречаются при инсулинзависимом диабете, обычно спустя несколько лет. Напротив, при 2 типе диабета, невропатия часто выявляется уже в момент установления основного диагноза. Невропатия носит преимущественно сенсорный характер, однако существует высокая вероятность вовлечения в патологический процесс двигательных и толстых миелинизированных волокон. Подтипы диабетической невропатии представлены в таблица.
Симметричные диабетические невропатии
1. Наиболее часто встречаются хронические дистальные симметричные прогрессирующие формы диабетической невропатии – сенсорная, сенсо–моторная и сенсорно–вегетативная. Известно, что в течение первых 5 лет периферическая невропатия регистрируется у 4–10% пациентов, страдающих сахарным диабетом. Полиневропатия может протекать асимптомно в течение длительного периода времени, чаще при сахарном диабете 1 типа. Объективные (клинические или электрофизиологические) доказательства выявляются у 65–80% всех пациентов, страдающих сахарным диабетом. Электронейрография регистрирует снижение амплитуды суммарного чувствительного потенциала, нормальные или умеренно замедленные скорости распространения возбуждения. Чаще повреждаются аксональные стержни периферических нервов, что подтверждается результатами морфологических исследований, при которых выявляется уменьшение плотности аксонов при моторно–сенсорных невропатиях, признаки аксональной дегенерации, утолщение стенок капилляров, набухание аксонов в дистальных отделах, увеличение количества коллагена в окружении сосудов, особенно коллагена VI типа.
Клинические проявления сенсорных невропатий достаточно хорошо изучены и характеризуются в первую очередь различными чувствительными нарушениями с признаками повреждения тонких немиелинизированных волокон, которые вовлекаются в первую очередь, позднее – толстых миелинизированных. Нарушения чувствительности проявляются чувством онемения, болью и парестезиями в ногах, в виде ощущения холода, жжения, покалывания. Боль может быть жгучей, режущей, пронизывающей, возникает в покое, усиливается в ночные часы и значительно снижает качество жизни пациентов. Вовлечение тонких немиелинизированных волокон приводит к нарушению поверхностных видов чувствительности (в первую очередь болевой), проявляется жгучей болью в отсутствие снижения или выпадения сухожильных рефлексов. Позднее присоединяется нарушение температурной и тактильной чувствительности. Поражение толстых миелинизированных нервных волокон приводит к расстройству глубокой чувствительности – вибрационной, мышечно–суставной, выпадению сухожильных рефлексов.
Вовлечение в патологический процесс двигательных нервов происходит, как правило, при длительно текущем диабете и проявляется умеренно выраженной дистальной мышечной слабостью, вовлекающей нижние и значительно позднее – верхние конечности. Стимуляционная электронейрография выявляет снижение амплитуды М–ответов, небольшое замедление скорости распространения возбуждения. Исследование дистальных мышц конечностей игольчатыми электродами регистрирует денервационные феномены – потенциалы фибрилляций и положительные острые волны.
Поскольку исследование скорости распространения возбуждения по нервам позволяет оценивать функцию только толстых миелинизированных волокон, показатели проводящей функции могут быть относительно нормальными. Патологию тонких миелинизированных и немиелинизированных волокон, ответственных за болевой синдром, можно выявить только при проведении специфических пороговых сенсорных тестов.
Сахарный диабет также является самой частой причиной автономной невропатии в развивающихся странах. Клиническая симптоматика складывается из признаков повреждения симпатических и парасимпатических волокон, часто ассоциируется с дистальной сенсо–моторной полиневропатией. Субклиническая автономная дисфункция может возникать спустя 1 год при диабете 2 типа и два года при 1 типе. С увеличением продолжительности сахарного диабета увеличивается смертность, уровень которой при кардиоваскулярной автономной невропатии колеблется от 27 до 56% в течение первых 5–10 лет.
• Кардиоваскулярная автономная невропатия протекает асимптомно у одной пятой пациентов и выявляется при исследовании вариабельности сердечного ритма, с помощью пробы Вальсавы, проведения ортостатической пробы. Клинически она проявляется постуральной гипотензией, нарушением коронарного кровотока и сократимости миокарда вследствие симпатической денервации, уменьшением вариабельности сердечного ритма, тахикардией покоя вследствие парасимпатической денервации, фиксированным пульсом.
• Урогенитальная невропатия проявляется эректильной дисфункцией (возникает у 30–75% мужчин, страдающих диабетом), ретроградной эякуляцией, нарушением функции опорожнения мочевого пузыря (возникает у 50% больных).
• Гастроинтестинальная форма автономной полиневропатии может вовлекать все отделы желудочно–кишечного тракта, проявляется гастропарезом (в виде тошноты, рвоты, чувством раннего насыщения, диффузной болью в области эпигастрия, потерей веса), ночной диареей, нарушением функции сфинктеров прямой кишки.
• Судомоторные синдромы проявляются раньше всего сухостью кожи, гипогидрозом, нарушением терморегуляции, развитием трофических язв и трещин.
2. Острые диабетические невропатии практически всегда симметричны и возникают гораздо реже хронических форм.
Острая болевая диабетическая невропатия чаще возникает у мужчин при нераспознанном или плохо контролируемом диабете (чаще 1 типа), часто сопровождает анорексию и быстрое снижение веса, иногда после эпизода кетоацидоза. Проявляется жгучими болями в стопах, которые усиливаются в ночное время. При обследовании пациентов выявляются умеренные дистальные симметричные сенсорные нарушения. Полный регресс болевого синдрома наблюдается в течение 6–24 месяцев. Двигательные нарушения наблюдаются нечасто.
Острая обратимая гипергликемическая сенсомоторная невропатия возникает на фоне повышения уровня сахара в крови у пациентов с недавно диагностированным или впервые выявленным диабетом. Клинические проявления характеризуются парестезиями, жжением и тяжелым болевым синдромом в ногах, потерей чувствительности всех модальностей. Вовлекаются преимущественно дистальные отделы нижних конечностей. Симптоматика регрессирует на фоне нормализации уровня гликемии. Стимуляционная электронейрография выявляет замедление скорости проведения по нервам верхних и нижних конечностей от умеренных до тяжелых. Результаты игольчатой электромиографии, как правило, зависят от характера и тяжести предшествующей хронической невропатии.
Асимметричные диабетические невропатии часто имеют острое или подострое начало.
Менее чем у 0,1% пациентов, страдающих сахарным диабетом, развивается пояснично–крестцовая радикулоплексопатия. Клинически она проявляется асимметричной слабостью и гипотрофией мышц проксимальных отделов ног (чаще поражаются четырехглавая, приводящие мышцы бедра, поясничная мышца), а также дистальной слабостью в стопах. Болевой синдром часто предшествует развитию парезов, может быть ярко выраженным и обычно продолжается до нескольких месяцев, локализуясь в области бедер и ягодиц. При осмотре выявляется снижение чувствительности в дистальных отделах ног. При электромиографии выявляется мультифокальная денервация в параспинальных и мышцах ноги. Электронейрография выявляет признаки аксонопатии, снижение амплитуды М–ответов и чувствительных потенциалов. При игольчатой электромиографии регистрируются потенциалы денервации в параспинальных мышцах, нередко регистрируются фасцикуляции. Морфологические данные показывают признаки васкулитной радикулоплексопатии. В лечении применяется в/венная пульс–терапия солу–медролом, внутривенные иммуноглобулины в дозе 2 г на кг веса в течение 3 месяцев. В течение 6–24 месяцев после контроля гликемии наступает частичное или полное медленное восстановление утраченных функций.
Острая или подострая полирадикулопатия–плексопатия (диабетическая амиотрофия) встречается редко, в основном при диабете 2 типа. Клинически она проявляется тяжелым односторонним болевым синдромом, проксимальной слабостью в одной ноге, особенно в четырехглавой и поясничной мышцах. Расстройства чувствительности, как правило, не выражены. Без тщательного электрофизиологического исследования проявления напоминают невропатию бедренного нерва. Игольчатая электромиография на ранних стадиях выявляет выраженную спонтанную активность мышечных волокон, часто без признаков реиннервации. Стимуляционная электронейрография регистрирует умеренное увеличение терминальной латентности и небольшое снижение амплитуды М–ответа, типичные для аксонального процесса. Течение болезни монофазное, восстановление продолжается в течение нескольких месяцев и может наступить даже без лечения.
Также редко может встречаться мультифокальная (множественная) диабетическая невропатия с повреждением более одного нерва. Часто наблюдается сочетание краниальной невропатии с периферической мононевропатией или множественные компрессионные невропатии. Она начинается подостро, клинически проявляется болью и преимущественно дистальной асимметричной слабостью в ногах. Может проявляться в проксимальных отделах ног, в руках (локтевой, лучевой нервы), грудной радикулопатией. При ЭНМГ выявляются признаки асимметричной потери аксонов, в ликворе часто повышен уровень белка. Морфологически выявляется периваскулярное воспаление и геморрагии, в некоторых случаях васкулит, аксональная дегенерация и потеря аксонов.
Диабетическая радикулопатия чаще всего поражает грудные, поясничные, крестцовые и, реже, шейные корешки. Клинические проявления характеризуются остро возникающим болевым синдромом, сегментарным расстройством чувствительности, что по своим симптомам может напоминать проявления постгерпетической невралгии. При вовлечении передних корешков развивается слабость соответствующих мышц (межреберных, мышц живота, разгибателей стопы и т.д.).
При сахарном диабете могут наблюдаться мононевропатии. Чаще всего они представлены туннельными синдромами и некомпрессионным поражением отдельных нервов на фоне полиневропатии. В основном возникает компрессия срединного нерва в области запястного канала (карпальный туннельный синдром), локтевого нерва на уровне локтевого сустава (кубитальный туннельный синдром), малоберцового нерва на уровне коленного сустава (фибулярный туннельный синдром). Реже нарушается функция большеберцового, бедренного, латерального кожного нервов. Из черепных наиболее часто повреждается глазодвигательный нерв, что сопровождается ретроорбитальной болью, птозом, косоглазием, диплопией. Восстановление продолжается от нескольких недель до месяцев. Отводящий и блоковый нервы повреждаются реже. Показано, что функция лицевого нерва нарушается чаще у больных диабетом, чем в обычной популяции. При выполнении электронейромиографии важно провести сравнение показателей проводящей функции по исследуемому нерву с двух сторон.
Лечению и профилактике повреждения периферической нервной системы при диабете посвящено множество исследований. Существующий на данный момент арсенал лекарственных средств дает возможность в определенной степени держать под контролем это осложнение сахарного диабета и вносит вклад в улучшение качества жизни пациентов.
Согласно современным представлениям комплексное лечение диабетических невропатий включает в себя ряд обязательных мер, и в первую очередь контроль уровня сахара в крови. Исследование DCCT (Diabetes Control and Complications Trial) продемонстрировало прямую корреляцию между контролем гликемии и диабетическими осложнениями в течение пятилетнего периода наблюдения при диабете 1 типа. Стоит отметить, что до сих пор до конца не ясно, влияет ли строгий контроль над уровнем гликемии на развитие невропатии.
Для обеспечения энергетического метаболизма нервной ткани требуется восполнение дефицита тиамина (витамин В1). Для этого лучше использовать жирорастворимыми его формы, в сочетании с пиридоксином. a–липоевая кислота (Берлитион) является естественным кофактором пируватгидрогеназного комплекса, связывающего и переносящего ацильные группы из одной части комплекса в другую. Этот препарат обладает антиоксидантным, нейротрофическим действием, способствует утилизации глюкозы. В исследованиях ALADIN (Alfa–Lipoic Acid in Diabetic Neuropathy), SYDNEY (Symptomatic Diabetic NEuropathY Trial) было показано, что внутривенное введение a–липоевой кислоты в течение 2 недель улучшает температурную и вибрационную чувствительность и способствует уменьшению выраженности болевого синдрома. По результатам исследования ALADIN III, a–липоевая кислота в дозе 800 мг в течение 4 месяцев при сахарном диабете 2 типа приводит к ослаблению вегетативной дисфункции. Обычно при диабетической невропатии сначала вводится a–липоевая кислота в дозе 600 мг ежедневно внутривенно капельно в течение 5–10 дней (до 3–4 недель), затем внутрь по 600 мг в сутки в течение не менее чем 1–2 месяцев.
Особое место занимает симптоматическая терапия проявлений диабетической невропатии. Трудности вызывает коррекция болевого синдрома. С этой целью используются габапентин, фенитоин, карбамазепин, трициклические антидепрессанты, капсаицин местно. При «диабетической амиотрофии» для коррекции болевого синдрома в начальной стадии заболевания требуется даже введение наркотических анальгетиков или стероидов. При развитии мышечной слабости необходимы ранние реабилитационные мероприятия.
Вегетативные проявления диабетической невропатии лечить довольно сложно. С целью коррекции ортостатической гипотензии используют флудрокортизон, мидодрин. Тахикардия покоя требует назначения b–адреноблокаторов, антагонистов кальция, препаратов магния. При диарее используют антибактериальные препараты широкого спектра действия. Эректильную дисфункцию корригируют назначением силденафила, йохимбина.
При диабетической пояснично–крестцовой радикулопатии, в основе развития которой предполагается основное участие аутоиммунных механизмов, есть положительный опыт применения кортикостероидов и иммуноглобулинов класса G.
В терапии радикулопатии, радикулоплексопатии, мононевропатии применяются новокаиновые блокады в сочетании с озонотерапией и другими физиотерапевтическими методами.
Литература
1. Левин О.С. «Полинейропатии», МИА,2005
2. Жулев Н.В. «Нейропатии», С–Пб, 2005
2. Madhan K.K., Symmans P., Te Syrake L., VAN Der Merwe W. //Am J Kidney Dis 2000;35:1212–1216
3. Meijer L. // Neurology 2000;55:83–88
4. Lohmann T., Kellner K., Verlohren H.J., Krug J., Steindorf J., Scherbaum W.A., Seissler J. // Diabetologia 2001;44:1005–1010
5. Dickinson P.J., Carrington A.L., Frost G.S., Boulton A.J. // Diabetes Metab Res Rev 2002;18:260–272
6. Ostrowsky K., Magnin M., Ryvlin P., Isnard J., Guenot M., Mauguiere F. // Brain 2003;126:376–385
7. Vinik A.I., Maser R.E., Mitchell B.D., Freeman R. // Diabetes Care 2003;26:1553–1579
8. Hamilton J., Brown M., Silver R., Daneman D. // J Pediatr 2004;144:281–283
9. Tesfaye S., Chaturvedi N., Eaton S.E., Ward J.D., Manes C., Ionescu–Tirgoviste C., Witte D.R., Fuller J.H. // NEJM 2005;352:341–3
