Минеральная плотность костной ткани при сахарном диабете
А.Ф. Вербовой, Д.В. Акимова, Н.И. Вербовая
ГБОУ ВПО “Самарский государственный медицинский университет” Минздрава России
МКБ-10:
IV.E10-E14.E11
Инсулиннезависимый сахарный диабет
XVII.Q65-Q79.Q78.2
Остеопетроз
Численность больных сахарным диабетом неуклонно растет: если в 2011 г. насчитывалось 366 млн больных сахарным диабетом, то к 2012-му их уже было 371 млн человек по всему миру [10]. Подавляющее большинство случаев заболевания приходится на сахарный диабет типа 2 (СД2) [1]. По данным ВОЗ, предполагается, что сахарный диабет будет седьмой главной причиной смерти к 2030 г. (Всемирная организация здравоохранения, 2013) [9].
С увеличением продолжительности жизни больных сахарным диабетом на первый план выступила проблема поздних осложнений заболевания. Метаболические нарушения, сосудистые и неврологические осложнения сахарного диабета приводят к развитию изменений во всех органах и системах, в том числе и в костной [4]. Снижение минеральной плотности костной ткани приводит к развитию остеопороза.
cахарный диабет, костная ткань, остеопороз, остеопения, переломы, витамин D
Остеопороз – это мультифакторное заболевание [2]. В настоящее время основными факторами риска и причинами нарушения обмена в костной ткани являются снижение уровня половых гормонов, женский пол, недостаточная масса тела или ожирение, переломы у родителей, недостаточная или избыточная физическая нагрузка, наличие сопутствующих заболеваний, прием препаратов, влияющих на костную ткань [4]. Как правило, в каждом конкретном случае могут сочетаться несколько причин, приводящих к развитию остеопороза.
Важность этой проблемы определяется грозными осложнениями. [3]. Остеопороз является социально значимым заболеванием для пожилых пациентов в связи с тем, что переломы позвонков и костей периферического скелета обусловливают значительный подъем инвалидности и смертности [6] и приводят к большим материальным затратам в области здравоохранения [7].
Цель − определить состояние костной ткани и оценить роль витамина D3 в развитии остеопороза у женщин с сахарным диабетом типа 2.
Было обследовано 53 женщины, страдающие сахарным диабетом типа 2, средний возраст которых составил 61,96±1,00 год. В качестве контроля взяты 2 категории женщин: в первую вошли 10 практически здоровых девушек, средний возраст 20,50±0,17 года; вторую составили 10 практически здоровых женщин, средний возраст 56,90±1,66 года, не предъявляющие жалоб и в анамнезе которых не было заболеваний эндокринной системы, органов пищеварения, почек, крови, ревматических заболеваний и при осмотре не было обнаружено отклонений.
Критериями исключения из исследования являлись: наличие почечной и печеночной недостаточности, заболевания органов пищеварения, крови, ревматические заболевания, возраст младше 50 лет, инсулинотерапия.
Женщины с СД 2 были разделены на группы в зависимости от степени и типа ожирения, длительности заболевания и состояния костной ткани.
У всех обследованных определяли антропометрические показатели:рост, вес, окружность талии (ОТ), окружность бедер (ОБ), с последующим расчетом индекса массы тела (ИМТ) и соотношения ОТ/ОБ. ИМТ рассчитывался по формуле: ИМТ = масса тела (кг)/рост (м)2. Степень ожирения оценивалась по классификации ВОЗ (1997): при ИМТ 25-29,9 кг/м2 диагностировали избыточную массу тела, при ИМТ 30-34,9 кг/м2 – I степень, при ИМТ 35-39,9 кг/м2 – II степень, более 40 кг/м2 – III степень ожирения. В зависимости от ИМТ пациентки распределялись следующим образом: избыточный вес – 21 человек, I степень ожирения – 13 больных, II степень -19 человек. Тип распределения жировой ткани определяли по отношению ОТ/ОБ. При значении ОТ/ОБ более 0,85 диагностировали абдоминальный (45 человек), при ОТ/ОБ менее 0,85 – глютеофеморальный тип ожирения (8 женщин).
Для определения состояния костной ткани проксимального отдела бедренной кости использовался костный денситометр NORLAND XR-46 (США). Определялись следующие показатели: Т-критерий (представляет собой разницу между плотностью костной ткани у конкретного пациента и минеральной плотностью костной ткани (МПКТ) у здоровых людей в возрасте пика костной массы), Z-критерий (представляет собой разницу между МПКТ у конкретного пациента и МПКТ у здоровых людей того же возраста), минеральная плотность кости (BMD) – критерий, отражающий количество минерализованной костной ткани в сканируемой площади (г/см2);
В зависимости от Т-критерия судили о степени снижения МПКТ: в пределах нормы находились значения, отклоняющиеся менее чем на 1,0 SD; значения Т-критерия от -1,0 до -2,5 SD обозначались как остеопения; при Т-критерии -2,5 SD и ниже диагностировался остеопороз.
В зависимости от степени снижения МПКТ все больные с СД 2 были разделены на группы: с нормальной МПКТ − 19 человек; со сниженной МПКТ (остеопения и остеопороз) − 34 пациентки.
В зависимости от длительности заболевания были выделены 3 группы: с продолжительностью болезни до 5 лет – 27 пациенток, от 5 до 10 лет – 14 больных, более 10 лет – 12 женщин.
Состояние фосфорно-кальциевого обмена оценивали по концентрации кальция (Са) и неорганического фосфора (Р) в сыворотке крови, а также по уровню их экскреции в утренней порции мочи по отношению к экскреции креатинина. Данные показатели определялись спектрофотометрическим методом на биохимическом анализаторе “Screen Master Plus” (Hospitex diagnostic, Швейцария).
Определение уровней маркеров резорбции кости (С-терминального телопептида коллагена I типа) и костеобразования (остеопротегерина, остеокальцина) производилось методом иммуноферментного анализа на микропланшетном анализаторе “Expert Plus” (Asus, Австрия).
Содержание 25-OH-D3 определялось методом иммуноферментного анализа на микропланшетном анализаторе “Expert Plus” (Asus, Австрия).
Статистическая обработка данных проводилась с помощью пакета SPSS 11.5. Проводился однофакторный дисперсионный анализ. Результаты представлены в виде выборочного среднего и его ошибки (М±m). Корреляционный анализ проводился методами Пирсона, Спирмена. Статистически значимые различия определялись при попарном сравнении групп с помощью критерия Манна-Уитни. Критическое значение p=0,05.
Результаты и обсуждение
У 19 пациенток плотность костной ткани была нормальной, у 30 больных диагностирована остеопения, у 4 женщин – остеопороз.
В табл. 1 приведены результаты исследования плотности костной ткани у обследованных.
Таблица 1. Показатели рентгеновской денситометрии у женщин с сахарным диабетом типа 2
Группа Показатель | Контроль 21−40 лет n=10 | Контроль 41−60 лет n=10 | СД2 n=53 |
T-критерий | -0,65±0,39 | 0,61±0,30 р0-1=0,028 | -1,21±0,15 р0-2=0,206 р1-2<0,001 |
Z-критерий | -0,56±0,39 | 1,14±0,22 р0−1=0,010 | 0,50±0,13 р0−2=0,005 р1−2=0,022 |
BMD (г/см2) | 0,91±0,05 | 1,12±0,04 р0−1=0,01 | 0,84±0,02 р0−2=0,159; р1−2<0,001 |
Примечание: n – число обследованных лиц, р0−1 – достоверность различий контрольных групп между собой; p0−2 – достоверность различий с контрольной группой 21−40 лет; p1−2 – достоверность различий с контрольной группой 41−60 лет.
Из табл. 1 видно, что Т-критерий у пациентов с СД2 был ниже, чем в контрольной группе 21−40 лет, хотя статистической значимости это различие не достигло (р=0,206). Достоверное снижение этого показателя отмечено при его сравнении со старшей контрольной группой.
Z-критерий у обследованных был достоверно ниже, чем у контроля 41−60 лет. Минеральная плотность кости (BMD) также достоверно снижена относительно старшей контрольной группы (р<0,001).
Т-критерий у женщин с СД2 соответствовал остеопении (табл. 1). По данным P. Vestergaard и соавт. (2009) сам факт гипергликемии приводит к гликированию коллагена костной ткани, что сопровождается снижением минеральной плотности костной ткани.
Анализ показателей рентгеновской денситометрии в зависимости от степени, типа ожирения и длительности заболевания не выявил сколько-нибудь существенных их изменений (p>0,05).
В группе с абдоминальным типом ожирения выявлена положительная корреляции BMD с ИМТ (r=0,356, p=0,021).
Таблица 2. Показатели костного метаболизма у женщин с сахарным диабетом типа 2
Группа Показатель | Контроль 21−40 лет n=10 | Контроль 41−60 лет n=10 | СД 2 n=53 |
С-терминальный телопептид коллагена I типа, нг/мл | 0,49±0,07 | 0,31±0,06 р0−1=0,049 | 0,78±0,07 р0−2=0,042 р1−2<0,001 |
Остеопротегерин, нмоль/л | 2,86±0,14 | 2,24±0,14 р0−1=0,011 | 4,82±0,18 р0−2<0,001 р1−2<0,001 |
Остеокальцин, нг/мл | 18,49±2,54 | 20,01±2,21 р0−1=0,406 | 29,22±2,28 р0−2=0,014 р1−2=0,065 |
Примечание: n – число обследованных лиц, р0−1 – достоверность различий контрольных групп между собой; p0−2 – достоверность различий с контрольной группой 21−40 лет; p1−2 − достоверность различий с контрольной группой 41−60 лет.
При анализе показателей костного метаболизма у больных с СД2 установлено, что уровень С-терминального телопептида коллагена I значимо выше по сравнению с обеими контрольными группами (р<0,05), что говорит об усилении резорбции костной ткани у больных с СД 2. Повышение С-терминального коллагена I типа было статистически значимо только относительно контроля 21−40 лет у пациенток с избыточной массой тела и при глютеофеморальном типе ожирения. Костеобразование у женщин с СД2 также повышено, о чем свидетельствует повышение остеокальцина (p=0,014) и остеопротегерина (p<0,001) относительно младшей и старшей контрольных групп.
Максимальное повышение остеокальцина было установлено при I степени ожирения. Это можно объяснить прогрессированием снижения плотности костной ткани, так как, по мнению R. Baumgrass и соавт. (1997), остеокальцин не только свидетельствует об ускорении костного метаболизма, но и может являться прогностическим индикатором прогрессирования костного заболевания. Содержание остеопротегерина практически не отличалось в подгруппах с различными степенью и типами ожирения (p>0,05). У обследованных с разной длительностью заболевания максимальное его повышение выявлено при продолжительности СД 2-го типа 10 и более лет.
У пациенток с избыточным весом выявлена положительная корреляция С-терминального телопептида коллагена I типа с ОТ (r=-0,634, p=0,006). В группе с глютеофеморальным типом ожирения выявлена положительная корреляция остеокальцина с ОТ/ОБ (r=0,894, p=0,041). У женщин с СД2 с абдоминальным типом ожирения обнаружена прямая корреляция остеопротегерина с отношением Р/креатинин мочи (r=0,364, p=0,023).
Таблица 3. Показатели костного метаболизма в зависимости от минеральной плотности костной ткани
Группа Показатель | Контроль 21−40 лет, n=10 | Контроль 41−60 лет, n=10 | Нормальная МПКТ, n=17 | Сниженная МПКТ, n=31 | |
С-терминальный телопептид коллагена I типа, нг/мл | 0,49±0,07 | 0,31±0,06 р0−1=0,049 | 0,68±0,12 р0−2=0,429 р1−2=0,008 | 0,84±0,08 р0−3=0,011 р1−3<0,001 р2−3=0,140 | |
Остеопротегерин, нмоль/л | 2,86±0,14 | 2,24±0,14 р0−1=0,011 | 5,10±0,28 р0−2<0,001 р1−2<0,001 | 4,66±0,23 р0−3<0,001 р1−3<0,001 р2−3=0,294 | |
Остеокальцин, нг/мл | 18,49±2,54 | 20,01±2,21 р0−1=0,406 | 23,10±2,50 р0−2=0,196 р1−2=0,598 | 32,71±3,13 р0−3=0,004 р1−3=0,016 р2−3=0,067 |
Примечание: n – число обследованных лиц, р0−1 – достоверность различий контрольных групп между собой; p0−2 – достоверность различий показателей у лиц с нормальной МПКТ с контрольной группой 21−40 лет; p1−2 – достоверность различий показателей у лиц со сниженной МПКТ с контрольной группой 41−60 лет; p0−3 – достоверность различий показателей у лиц с нормальной МПКТ с контрольной группой 21−40 лет; p1−3 − достоверность различий показателей у лиц со сниженной МПКТ с контрольной группой 41−60 лет; р2−3 – достоверность различий показателей у лиц с нормальной и сниженной МПКТ.
Ускорение костного метаболизма выявлено даже при нормальной МПКТ у женщин с сахарным диабетом 2-го типа, о чем свидетельствует повышение показателей и костной резорбции, и костеобразования относительно обеих контрольных групп. При сниженной же минеральной плотности костной ткани выявлено повышение С-терминального телопептида коллагена I типа, остеокальцина не только при сравнении с контрольными группами 21−40 и 41−60 лет, но и с аналогичными показателями обследованных с нормальной МПКТ.
У женщин с нормальной МПКТ выявлена прямая корреляция остеокальцина с Р крови (r=0,559, p=0,024). У пациенток со сниженной МПКТ обнаружена положительная корреляция остеопротегерина с отношением Р/креатинин мочи (r=0,478, p=0,010).
Таблица 4. Показатели кальций-фосфорного обмена у женщин с сахарным диабетом типа 2
Группа Показатель | Контроль 21−40 лет, n=10 | Контроль 41−60 лет, n=10 | СД 2 n=53 |
Ca крови, ммоль/л | 2,15±0,05 | 2,47±0,06 р0−1=0,002 | 2,18±0,02 р0−2=0,598 р1−2<0,001 |
P крови, ммоль/л | 1,07±0,04 | 1,06±0,02 р0−1=0,649 | 1,21±0,03 р0−2=0,018 р1−2=0,045 |
Са/креатинин мочи | 0,27±0,03 | 0,42±0,03 р0−1=0,013 | 0,35±0,01 р0−2=0,039 р1−2=0,021 |
Р/креатинин мочи | 1,303±0,11 | 1,73±0,06 р0−1= 0,275 | 1,62±0,06 р0−2=0,037 р1−2=0,275 |
Примечание: n – число обследованных лиц, р0−1 – достоверность различий контрольных групп между собой; p0−2 – достоверность различий с контрольной группой 21−40 лет; p1−2 – достоверность различий с контрольной группой 41−60 лет.
У женщин с СД2 был снижен уровень кальция крови (табл. 4) при сравнении с контрольной группой 41−60 лет.
У всех пациенток с СД2 выявлено достоверное повышение Р крови относительно контрольной группы и групп 21-40 лет (р=0,018) и 41−60 лет (р1−2=0,045). Оценка его содержания в зависимости от типа и степени ожирения не выявила существенных различий между группами. Необходимо отметить, что концентрация кальция (2,20±0,03) была достоверно выше при абдоминальном ожирении, чем при глютеофеморальном (2,05±0,05, p=0,044). Значимое увеличение соотношений Са к креатинину мочи (p=0,039) свидетельствует об усилении резорбции костной ткани у обследованных женщин. Обнаружены прямые корреляции Р/креатинина мочи с длительностью заболевания (r=0,574, p=0,040), с ОТ/ОБ (r=0,675, p=0,011).
Корреляционный анализ Спирмена выявил прямую связь отношения Р/креатинин мочи и уровня остеопротегерина (r=0,455, p=0,029) в группе женщин с длительностью заболевания до 5 лет. Аналогичная положительная взаимосвязь Р/креатинин мочи и остеопротегерина (r=0,753, p=0,019) обнаружена и при продолжительности болезни от 5 до 10 лет. В группе женщин с СД 2-го типа длительностью более 10 лет выявлены отрицательные корреляции Са крови с возрастом (r=-0,572, p=0,032), отношения Са/креатинин мочи с остеопротегерином (r=-0,610, p=0,035).
У женщин с СД2 выявлено значимое снижение содержания 25-OH-D3 относительно обеих групп контроля (табл. 5). При этом его минимальное содержание выявлено при абдоминальном типе ожирения (50,89±1,68 нмоль/л, р<0,001), хотя при этом практически не отличалось от его уровня при глютеофеморальном (52,46±1,63нмоль/л, р=0,002) типе ожирения.
Таблица 5. Содержание витамина 25-OH-D3 у женщин с сахарным диабетом типа 2
Группа Показатель | Контроль 21−40 лет, n=10 | Контроль 41−60 лет, n=10 | СД 2, n=53 |
25-OH-D3, нмоль/л | 77,14±2,57 | 78,31±6,28 р0−1=0,567 | 51,09±1,50 р0−2<0,001 р1−2<0,001 |
Примечание: n – число обследованных лиц, р0−1 – достоверность различий контрольных групп между собой; p0−2 – достоверность различий с контрольной группой 21−40 лет; p1−2 − достоверность различий с контрольной группой 41−60 лет
Не было выявлено существенных изменений уровня витамина D3 в ни зависимости от степени ожирения, ни в зависимости от длительности заболевания.
Содержание витамина D3 также значимо не различалось между группами пациенток с нормальной и сниженной МПКТ.
У пациенток со сниженной МПКТ корреляционный анализ Спирмена выявил положительную корреляцию уровня витамина D3 с Т-критерием (r=0,461, p=0,014). У больных с избыточной массой тела установлена прямая связь витамина D3 с ИМТ (r=0,576, p=0,015).
Таким образом, в развитии остеопороза у женщин с сахарным диабетом типа 2 определенную роль играет снижение уровня витамина D3.
Выводы
1. У 35% женщин с СД2 плотность костной ткани была нормальной. Сниженная МПКТ диагностирована у 65 % больных (у 57 % − остеопения, у 8 % − остеопороз).
2. Повышение маркеров костной резорбции и костеобразования свидетельствует об ускорении костного метаболизма у женщин с СД2.
3. Содержание витамина D3 снижено у женщин с СД2. Снижение 25-OH-D3 не зависит от степени и типа ожирения, длительности заболевания.
4. Снижение витамина D3 является одним из факторов снижения МПКТ у женщин с СД 2, о чем свидетельствует его прямая корреляция с Т-критерием
СВЕДЕНИЯ О ВЕДУЩЕМ АВТОРЕ
Вербовой Андрей Феликсович − доктор медицинских наук, профессор, заведующий кафедрой эндокринологии ГБОУ ВПО “Самарский государственный медицинский университет” Минздрава России
IV.E10-E14.E11
Инсулиннезависимый сахарный диабет
XVII.Q65-Q79.Q78.2
Остеопетроз
ЛИТЕРАТУРА
1. Майоров А.Ю., Урбанова К.А., Галстян Г.Р. Методы количественной оценки инсулинорезистентности // Ожирение и метаболизм. 2009. № 2. С.19.
2. Рожинская Л.Я. Современные стратегии профилактики и лечения постменопаузального остеопороза // Медицинский совет. 2012. № 7. С. 20-23.
3. Рожинская Л.Я. Диагностика и лечение остеопороза // Клиническая геронтология. 2007. № 2. С. 37-46.
4. Руководство по остеопорозу / под ред. Л.И. Беневоленской. – М.: БИНОМ. Лаборатория знаний. – 2003. – 524 с.
5. Baumgrass R., Williamson M.K. Price P.A. Identification of peptide fragments generated by digestion of bovine and human osteocalcin with the lysosomal proteinases cathepsin B,D,L,H and S // J. Bone Miner. Res. – 1997. – V.12.- H. 447-455.
6. Bliuc D., Nguyen N.D., Milch V.E. Mortaliti risk associated with low-trauma osteoporotic fracture and subsequent fracture in men and women // JAMA 2009; 301(5):513-521.
7. Burge R., Dawson-Hughes B., Solomon D.H. et al. Incidence and economic burden of osteoporosis-related fractures in the United States, 2005-2025 // Bone mineral research. 2007 Mar; 22(3):465-75.
8. Vestergaard P., Rejnmark L., Mosekilde L. Diabets and its complications and their relationship with risk of fracture in type 1 and 2 diabetes. Calcif Tissue Int 2009; 84:1:45-55.
9. www.who.int/mediacentre/factsheets/fs312/en/
10. www.idf.org/sites/default/files/5E_IDFAtlasPoster
Источник
Журавлева Л.Ю.
Сахарный диабет (СД) — одна из серьезнейших проблем нашего времени, ее масштабы продолжают увеличиваться и затрагивать интересы людей всех возрастов и всех стран. По прогнозам Всемирной организации здравоохранения количество больных СД к 2025 г. в развитых странах увеличится на 41 % (с 51 миллиона до 72 миллионов человек). В глобальном масштабе рост числа больных сахарным диабетом составит 122 % – со 135 миллионов до 300 миллионов человек [1]. Нарушение обмена веществ при СД приводит к изменению функциональной активности всех органов и систем. Основным фактором, участвующим в развитии поздних осложнений сахарного диабета, является гипергликемия. Если же при лечении не удается достичь целевых значений гликемии и отсутствия аглюкозурии, то это приводит к хроническим осложнениям СД [2, 3]. Совершенствование методов лечения больных СД способствовало увеличению продолжительности их жизни и, следовательно, повышению частоты поздних осложнений. Именно они определяют качество жизни, а не редко и жизненный прогноз у таких пациентов [4]. В последнее время в группу хронических осложнений СД все чаще включают патологическое изменение костной ткани [5]. Убедительные данные свидетельствуют о том, что при СД имеется тенденция к снижению костной массы и изменению микроархитектоники костной ткани. Процесс, сопровождающийся снижением костной плотности, ведет к повышению риска развития переломов. Несмотря на достаточное количество работ, посвященных обследованию состояния костной ткани у пациентов СД 1 типа, остается не изучен данный вопрос.
Цель исследования: изучить состояние минеральной плотности костной ткани у пациентов сахарным диабетом 1 типа с учетом факторов риска.
Материалы и методы. В исследование включено 100 пациентов (58 женщин и 42 мужчины), с СД 1 типа, в возрасте от 15 до 56 лет (средний возраст 30,58±10,87), мужчины (средний возраст 33,28±8,9), женщины (средний возраст 28,8±8,85). Пациенты находились на лечении в эндокринологическом и нефрологическом отделениях Челябинской Областной клинической больницы с 2008 по 2011 годы. К критериям включения относили пациентов СД 1 типа со стажем диабета не менее 6 месяцев. Из исследования были исключены пациенты хронической болезнью почек 4-5 стадии; СД 2 типа, с заболеваниями других эндокринных желез; с тяжелыми заболеваниями печени, легких, туберкулезом, ревматологическими заболеваниями; с заболеваниями почек аутоиммунного характера; с онкологическими заболеваниями (в том числе с миеломной болезнью); пациенты, получавшие глюкокортикостеройды и цитостатики в течение 5 лет; пациентки с постменопаузальным остеопорозом. В исследовании учитывались пациенты с осложнениями СД – пациенты с диабетической ангиоретинопатией (ДАРП), поражением нервной системы по типу диабетической полинейропатии и поражениями почек по типу диабетической нефропатии (ДН). Проводилась оценка питательного статуса пациентов по следующим критериям: индекс массы тела (ИМТ), уровень альбумина, окружность плеча (ОП), показатель лимфоцитов в общем анализе крови [6]. Для оценки состояния костной ткани применялась двухэнергетическая рентгеновская абсорбциометрия (денситометрия, DXA). Для обследования использован двухфотонный костный денситометр LunarProdigy-3 (США). Исследование проводилось в поясничном отделе позвоночника (позвонки LI–LIV) и проксимальном отделе бедра в области шейки правой и левой бедренной кости. Оценка производилась с использованием Т-критерия для возрастной группы >50 лет и Z-критерия для возрастной группы <50 лет в соответствии с рекомендациями Международного общества по клинической денситометрии 2007 г. У женщин показатели Т- и Z-критериев от -1 SD до -2,5 SD, трактовались как остеопения, остеопороз ниже -2,5 SD. У мужчин остеопении соответствовали Т- и Z-критерии от 0 до -1,5 SD, остеопорозу – ниже -1,5 SD [7]. Никто из пациентов не получал ранее препараты витамина D, фосфатбиндеры. Обследование включало определение уровней кальция (общего и ионизированного), общего белка, альбумина, мочевины, креатинина, мочевой кислоты, липидограммы, глюкозы крови, гликированного гемоглобина, микроальбуминурии и суточной протеинурии, общего анализа крови, общего анализа мочи по стандартным методикам. Всем пациентам проводилось ультразвуковое исследование почек, изотопная ренограмма или непрямая динамическая реноангиосцинтиграфия с клубочковой фильтрацией. Статистический анализ проводился с применением приложения Microsorft Excel полнофункционального офисного пакета Microsorft Starter 2010 и программы статистики IBM SPSS Statistics 20.
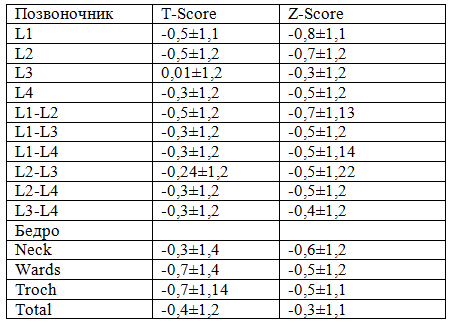
Результаты и обсуждение. Нормальные показатели минеральной плотности костной ткани (МПКТ) по всем исследуемым точкам были зарегистрированы у 33 пациентов (33%). У 67 пациентов (67%) нарушение минеральной плотности костной ткани (НМПКТ) отмечалось хотя бы в одной точке. У 37 (37%) пациентов до остеопении и у 30 (30 %) до остеопороза. Из 52 обследованных женщин у 37 (71%) отмечалось НМПКТ. У 20 (38%) была остеопения и у 17 (33%) остеопороз. Из 42 мужчин у 30 (71%) отмечалось НМПКТ. У 17 пациентов остеопения (40%) и у 13 (31%) остеопороз. Гендерные различия в частоте НМПКТ статистически не значимые. Стаж диабета варьировал от 0,5 до 39 лет (средний стаж 11,08±9,04),в том числе менее 5 лет у 31 пациента (31 %) , от 5 до 10 лет у 26 пациентов (26%), более 10 лет у 43 пациентов (43 %). Артериальная гипертензия имелась у 41 пациента (41%) . Из 41 пациента с первой степенью -6 (15%) пациентов, со второй степенью -22 (53%) пациента, с третьей степенью -13(32%) пациентов. Среднее значение систолического АД -132, 1±27,8 мм рт.ст. В исследуемой группе больных отмечались следующие осложнения СД – у 63 пациентов (63%) поражение глаз по типу диабетической ангиоретинопатии (ДАРП), у 69 (69%) поражение нервной системы по типу диабетической полинейропатии, у 50 человек (50 %) поражение почек по типу диабетической нефропатии (ДН). Диабетическая нефропатия на стадии микроальбуминурии у 13 пациентов (13%) и 37 пациентов (37%) на стадии протеинурии. Одновременно диабетическая полинейропатия, ДН и ДАРП наблюдались у 36 пациентов (36 %) . Средний показатель гликированного гемоглобина составил -9,9±1,8. Полная компенсация сахарного диабета была у 21 пациента (21 %). Низкий ИМТ является важным независимым фактором, влияющим на минеральную плотность костной ткани (МПКТ). В исследуемой группе больных у 1 пациента (1 %) был дефицит массы тела (ИМТ менее 18,49) , у 66 пациентов (66%) нормальная масса тела (ИМТ от 18,5 до 24,9) ,у 29 пациентов (29 %) избыточная масса тела (ИМТ от 25 до 29,9) , у 4 пациентов (4 %) ожирение 1- степени (ИМТ от 30 до 34,9).У 33 пациентов (33 %) была избыточная масса тела и ожирение. Средний показатель ИМТ составил- 23,74±2,8. Показатель альбумина более 35 г/л отмечался у 91 пациента (91%) , от 35 до 30 г/л – 6 пациентов (6%), от 30 до 25 г/л -2 пациента (2%) и менее 25 г/л – 1 пациент (1%).У 9 пациентов (9 %) по уровню альбумина отмечалась недостаточность питания. Средний показатель альбумина -38, 94±2,7 г /л. В зависимости от уровня показателей лимфоцитов пациенты распределились следующим образом – более 1800*109 у 86 пациентов (86 %), от 1800-1500*109 у 7 пациентов (7%), от 1500-900*109 у 7 пациентов (7%).По данным количества лимфоцитов недостаточность питания выявлена у 14 пациентов (14%).В зависимости от показателей ОП больные распределились следующим образом – мужчины с ОП от 29-26 см -33 пациента, ОП 26-23 см – 6 пациентов, ОП 23-20 см – 3 пациента, средняя ОП у мужчин -26,6±1,75см; женщины с ОП 28-25 см -37 пациенток, ОП 25-22, 5 см – 10 пациенток, ОП 22, 5-19, 5 см – 11 пациенток, средняя ОП у женщин -25,06±2,28 см. У 30 (30%) пациентов отмечалась недостаточность питания по данным измерения ОП. У всех пациентов проводилось обследование кальция, как общего, так и ионизированного. Средние показатели общего кальция-2,2±0,2ммоль/л (норма -2,1- 3,0 ммоль/л), средние показатели ионизированного кальция-1,0±0,09 ммоль/л (норма- 0,93 – 1, 15 ммоль/л). В зависимости от показателей кальция пациенты с нарушением МПКТ распределились следующим образом (табл. 1). Не выявлено зависимости нарушения минеральной плотности костной ткани у пациентов СД 1 типа от снижения показателей общего и ионизированного кальция. Проанализированы Т-Score и Z-Score позвоночника и бедренной кости у пациентов СД 1 типа (табл. 2). Особенностей поражения при НМПКТ в различных точках бедренной кости и позвоночника у пациентов СД 1 типа не выявлено.
Таблица 1. Нарушение МПКТ пациентов СД 1 типа в зависимости от уровня кальция.
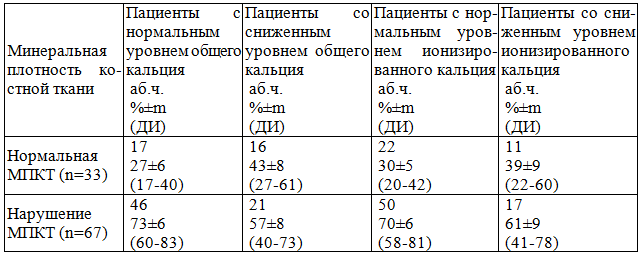
Таблица 2. Т-Score и Z-Score позвоночника и бедренной кости у пациентов СД 1 типа.
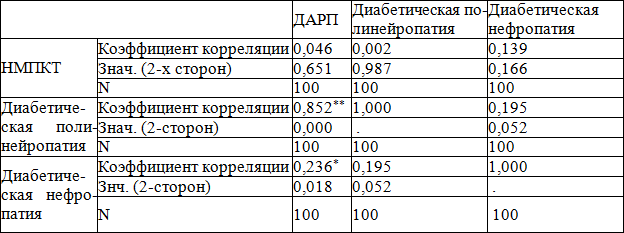
Проанализированы корреляционные взаимосвязи у пациентов СД 1типа между НМПКТ и другими осложнениями СД 1типа и факторами риска (табл. 3,4). Корреляционный анализ показал, что у больных сахарным диабетом 1 типа имеется статистически значимая взаимосвязь между диабетической нефропатией, диабетической полинейропатией и диабетической ангиоретинопатией. Не выявлено взаимосвязей между НМПКТ и диабетической нефропатией, диабетической ангиоретинопатией и диабетической полинейропатией у пациентов СД 1 типа. Корреляционный анализ показал, что у больных сахарным диабетом 1 типа имеется обратная статистически значимая взаимосвязь между НМПКТ и ИМТ. Чем ниже ИМТ, тем чаще встречается НМПКТ. Имеется обратная статистически значимая взаимосвязь между систолическим и диастолическим артериальным давлением и альбумином. Чем ниже альбумин, тем выше систолическое и диастолическое артериальное давление. Выявлена статистически значимая взаимосвязь между систолическим и диастолическим артериальным давлением и холестерином, ИМТ. Чем выше холестерин и больше ИМТ, тем выше систолическое и диастолическое артериальное давление.
Таблица 3. Корреляционные взаимосвязи у пациентов СД 1 типа между НМПКТ и другими осложнениями СД 1 тип.

Примечания: здесь и далее *р<0,05 корреляция значима (1-сторонняя); **р<0,01 корреляция значима (2-сторонняя).
Таблица 4. Корреляционные взаимосвязи между НМПКТ и ИМТ и другими факторами риска у пациентов СД 1 типа.
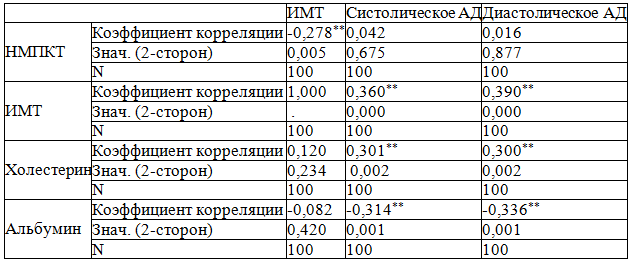
Нарушение кальциевого обмена возможны на разных этапах развития заболевания, однако сведения о характере и степени выраженности этих нарушений немногочисленны и противоречивы [8-10]. Ряд авторов, в том числе H.Heath и P.McNair, сообщают о нормокальциемии при сахарном диабете, но другие исследователи отметили повышение уровня кальция у таких больных [8-10]. J. Auwerx и соавторы в клинических исследованиях наблюдали снижение уровня биологически активного кальция [11,12]. В нашем исследовании не выявлено изменения показателей общего и ионизированного кальция у пациентов сахарным диабетом 1 типа. В работе Рожинской Л.Я. не выявлено типичных точек поражения НМПКТ у пациентов СД 1 типа [4,5], в нашей работе типичных точек поражения при НМПКТ у пациентов СД 1 типа так же не выявлено. Многочисленные исследования показывают взаимосвязь между выраженностью микроваскулярных осложнений и плотностью кости. Данные Mathiassen et al. [13], полученные в ходе проспективного исследования, длившегося в течение 11 лет, свидетельствуют о том, что у пациентов с ретинопатией, протеинурией и выраженной периферической нейропатией наблюдалось достоверное снижение МПК, по сравнению с больными без осложнений. Схожие результаты были получены в исследовании Forst et al. [14], у больных СД 1 типа с наличием периферической нейропатии отмечалось снижение плотности костной ткани. Таким образом, связь наличия и прогрессирования поздних осложнений диабета со снижением МПК подчеркивает патогенетическую значимость длительной декомпенсации заболевания в развитии диабетической остеопатии. В нашей работе не выявлено взаимосвязи между НМПКТ и диабетической нефропатией, диабетической ангиоретинопатией и диабетической полинейропатией у пациентов СД 1типа. Можно предположить, что механизм развития осложнений при СД 1 типа (ДАРП, ДН, диабетической полинейропатии ) и появления НМПКТ различен. Известно, что при снижении ИМТ чаще встречаются пациенты с НМПКТ [15]. В нашем исследовании выявлена обратная взаимосвязь у пациентов СД 1 типа между ИМТ и НМПКТ, чем ниже ИМТ, тем чаще встречается НМПКТ. Сахарный диабет и артериальная гипертензия – две взаимосвязанные патологии, которые обладают мощным взаимоусиливающим повреждающим действием, направленным на несколько органов-мишеней: сердце, почки, сосуды мозга, сосуды сетчатки. Крайне важно рано распознать присоединившуюся артериальную гипертензию на фоне сахарного диабета, для того, чтобы вовремя назначить соответствующее лечение и остановить развитие тяжелых сосудистых осложнений. Артериальная гипертензия осложняет течение СД 1 типа [16]. Выявлена четкая взаимосвязь между уровнем липидов и повышением риска смерти у пациентов с СД. Липидный профиль для больных СД характеризуется повышением уровней триглицеридов, холестерина липопротеидов очень низкой плотности, холестерина липопротеидов низкой плотности и малых частиц липопротеидов низкой плотности, и снижением уровней холестерина липопротеидов высокой плотности [17]. Многочисленные исследования последних лет показали, что основная роль в патогенезе сосудистых осложнений СД нарушению липидного обмена. Нарушение обмена липидов напрямую связано с избыточной массой тела. С увеличением индекса массы тела (ИМТ) повышается частота гиперхолестеринемии. Кроме того, с увеличением ИМТ повышается уровень триглицеридов [18]. В нашем исследований выявлена статистически значимая взаимосвязь между артериальным давлением и холестерином, между артериальным давлением и ИМТ. Чем выше холестерин, тем выше артериальное давление у пациентов СД 1 типа. При повышении ИМТ у пациентов СД 1типа повышается артериальное давление. Систолическое и диастолическое артериальное давление, ИМТ и холестерин являются модифицированными факторами риска, что важно для профилактических мероприятий.
Выводы:
1) У пациентов СД 1 типа НМПКТ диагностируются в 67% в том числе, как у мужчин, так и у женщин, гендерные различия статистически незначимые.
2) Не выявлено зависимости нарушения минеральной плотности костной ткани у пациентов СД 1 типа от снижения показателей общего и ионизированного кальция.
3) Особенностей поражения при НМПКТ в различных точках бедренной кости и позвоночника у пациентов СД 1 типа не выявлено.
4) Не выявлено взаимосвязей между НМПКТ и диабетической нефропатией, диабетической ангиоретинопатией и диабетической полинейропатией у пациентов СД 1 типа.
5) У пациентов сахарным диабетом 1 типа имеется обратная статистически значимая взаимосвязь между НМПКТ и ИМТ.
6) В группе пациентов СД 1 типа выявлена обратная статистически значимая взаимосвязь между систолическим и диастолическим артериальным давлением и альбумином.
7) У пациентов СД 1 типа выявлена статистически значимая взаимосвязь между систолическим и диастолическим артериальным давлением и холестерином, ИМТ.
1. Diabetes mellitus: Report of a WHO Study Group// WHO Techn. Rep. Ser. 1985. № 727.
2. Вартанян К.Ф. Состояние костной ткани при сахарном диабете// Диабетография. 1997. № 10. С. 18–20.
3. Tomas M.B., Patel M., Marwin S.E., Palestro C.J. The diabetic foot// Brit. J. Radiol. 2000. Vol. 73. №868. P. 443–450.
4. Рожинская Л.Я. Системный остеопороз (патогенез, диагностика, лечение). – М.: КРОН-ПРЕСС, 1996. 208 с.
5. Рожинская Л. Я. Остеопенический синдром при заболеваниях эндокринной системы и постменопаузальный остеопороз (патогенетические аспекты, диагностика и лечение): Дис. … д-ра мед. наук. – М., 2001. 318 с.
6. Шумилкин В.Р., Хорошилов И.Е., Веретенникова 3.М., Гуревич К.Я. Оценка питательного статуса// Серия: Нефрологический семинар. -СПб.: ТНА, 2007. 58 с.
7. Лесняк О.М. Остеопороз. Диагностика, профилактика и лечение/ Под ред. О.М.Лесняк, Л.И.Беневоленской. – М.: Гоэтар-Медиа, 2009.-204с.
8. Levin M.E., Boisseau V.C., Avioli L.V. Effects of diabetes mellitus on bone mass in juvenile and adult onset diabetes// New Enql. J. Med 1976, Vol.294, P.241.
9. American association of en
